Какие свойства проявляет водород
Атомная масса – 1 а.е.м. Молекула водорода двухатомна – Н2.
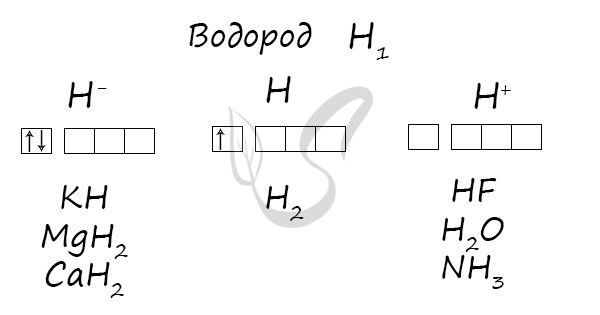
Электронная конфигурация атома водорода – 1s1. Водород относится к семейству s-элементов. В своих соединениях проявляет степени окисления -1, 0,
+1. Природный водород состоит из двух стабильных изотопов – протия 1Н (99,98%) и дейтерия 2Н (D) (0,015%) – и радиоактивного изотопа трития 3Н (Т) (следовые количества, период полураспада – 12,5 лет).
Химические свойства водорода
При обычных условиях молекулярный водород проявляет сравнительно низкую реакционную способность, что объясняется высокой прочностью связей в молекуле. При нагревании вступает во взаимодействие практически со всеми простыми веществами, образованными элементами главных подгрупп (кроме благородных газов, B, Si,
P, Al). В химических реакциях может выступать как в роли восстановителя (чаще), так и окислителя (реже).
Водород проявляет свойства восстановителя (Н20 -2е → 2Н+) в следующих реакциях:
1. Реакции взаимодействия с простыми веществами – неметаллами. Водород реагирует с галогенами, причем, реакция взаимодействия со фтором при обычных условиях, в темноте, со взрывом, с хлором – при освещении (или УФ-облучении) по цепному механизму, с бромом и йодом только при нагревании; кислородом (смесь кислорода и водорода в объемном отношении 2:1 называют «гремучим газом»), серой, азотом и углеродом:
H2 + Hal2 = 2HHal;
2H2 + O2 = 2H2O + Q (t![]() );
);
H2 + S = H2S (t![]() = 150 – 300
= 150 – 300![]() C);
C);
3H2 + N2 ↔ 2NH3 (t![]() = 500
= 500![]() C, p, kat = Fe, Pt);
C, p, kat = Fe, Pt);
2H2 + C ↔ CH4 (t![]() , p, kat).
, p, kat).
2. Реакции взаимодействия со сложными веществами. Водород реагирует с оксидами малоактивных металлов, причем он способен восстанавливать только металлы, стоящие в ряду активности правее цинка:
CuO + H2 = Cu + H2O (t![]() );
);
Fe2O3 + 3H2 = 2Fe + 3H2O (t![]() );
);
WO3 + 3H2 = W + 3H2O (t![]() ).
).
Водород реагирует с оксидами неметаллов:
H2 + CO2 ↔ CO + H2O (t![]() );
);
2H2 + CO ↔ CH3OH (t![]() = 300
= 300![]() C, p = 250 – 300 атм., kat = ZnO, Cr2O3).
C, p = 250 – 300 атм., kat = ZnO, Cr2O3).
Водород вступает в реакции гидрирования с органическими соединениями класса циклоалканов, алкенов, аренов, альдегидов и кетонов и др. Все эти реакции проводят при нагревании, под давлением, в качестве катализаторов используют платину или никель:
CH2 = CH2 + H2 ↔ CH3-CH3;
C6H6 + 3H2 ↔ C6H12;
C3H6 + H2 ↔ C3H8;
CH3CHO + H2 ↔ CH3-CH2-OH;
CH3-CO-CH3 + H2 ↔ CH3-CH(OH)-CH3.
Водород в качестве окислителя (Н2![]() +2е → 2Н—) выступает в реакциях взаимодействия со щелочными и щелочноземельными металлами. При этом образуются гидриды – кристаллические ионные соединения, в которых водород проявляет степень окисления -1.
+2е → 2Н—) выступает в реакциях взаимодействия со щелочными и щелочноземельными металлами. При этом образуются гидриды – кристаллические ионные соединения, в которых водород проявляет степень окисления -1.
2Na +H2 ↔ 2NaH (t![]() , p).
, p).
Ca + H2 ↔ CaH2 (t![]() , p).
, p).
Физические свойства водорода
Водород – легкий бесцветный газ, без запаха, плотность при н.у. – 0,09 г/л, в 14,5 раз легче воздуха, tкип = -252,8![]() С, tпл = — 259,2
С, tпл = — 259,2![]() С. Водород плохо растворим в воде и органически растворителях, хорошо растворим в некоторых металлах: никеле, палладии, платине.
С. Водород плохо растворим в воде и органически растворителях, хорошо растворим в некоторых металлах: никеле, палладии, платине.
По данным современной космохимии водород является самым распространенным элементом Вселенной. Основная форма существования водорода в космическом пространстве – отдельные атомы. По распространенности на Земле водород занимает 9 место среди всех элементов. Основное количество водорода на Земле находится в связанном состоянии – в составе воды, нефти, природного газа, каменного угля и т.д. В виде простого вещества водород встречается редко – в составе вулканических газов.
Получение водорода
Различают лабораторные и промышленные способы получения водорода. К лабораторным способам относят взаимодействие металлов с кислотами (1), а также взаимодействие алюминия с водными растворами щелочей (2). Среди промышленных способов получения водорода большую роль играют электролиз водных растворов щелочей и солей (3) и конверсия метана (4):
Zn + 2HCl = ZnCl2 + H2↑ (1);
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] +3 H2↑ (2);
2NaCl + 2H2O = H2↑ + Cl2↑ + 2NaOH (3);
CH4 + H2O ↔ CO + H2 (4).
Примеры решения задач
Источник
Химические свойства
водорода
При обычных условиях молекулярный Водород сравнительно мало активен, непосредственно соединяясь лишь с наиболее активными из неметаллов (с фтором, а на свету и с хлором). Однако при нагревании он вступает в реакции со многими элементами.
Водород вступает в реакции с простыми и сложными веществами:

– Взаимодействие водорода с металлами приводит к образованию сложных веществ – гидридов, в химических формулах которых атом металла всегда стоит на первом месте:

При высокой температуре Водород непосредственно реагирует с некоторыми металлами (щелочными, щелочноземельными и другими), образуя белые кристаллические вещества – гидриды металлов (LiН, NaН, КН, СаН2 и др.):
Н2 + 2Li = 2LiH
Гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода:
СаH2 + 2Н2О = Са(ОН)2 + 2Н2↑
– При взаимодействии водорода с неметаллами образуются летучие водородные соединения. В химической формуле летучего водородного соединения, атом водорода может стоять как на первом так и на втором месте, в зависимости от местонахождения в ПСХЭ (см. табличку в слайде):

1). С кислородом
Водород образует воду:
Видео “Горение водорода”
2Н2 + О2 = 2Н2О + Q
При обычных температурах реакция протекает крайне
медленно, выше 550°С – со взрывом (смесь
2 объемов Н2 и 1 объема О2 называется гремучим газом).
Видео “Взрыв гремучего газа”
Видео “Приготовление и взрыв гремучей смеси”
2). С галогенами
Водород образует галогеноводороды, например:
Н2 + Cl2 = 2НСl
При этом с фтором Водород взрывается (даже в темноте и
при – 252°С), с хлором и бромом реагирует лишь при освещении или нагревании, а
с йодом только при нагревании.
3). С азотом
Водород взаимодействует с образованием аммиака:
ЗН2 + N2 = 2NН3
лишь на катализаторе и при повышенных температуpax и
давлениях.
4). При нагревании Водород энергично реагирует с серой:
Н2 + S = H2S (сероводород),
значительно труднее с селеном и теллуром.
5). С чистым
углеродом Водород может реагировать без катализатора только при высоких
температуpax:
2Н2 + С (аморфный) = СН4 (метан)
– Водород вступает в реакцию замещения с оксидами металлов, при этом образуются в продуктах вода и восстанавливается металл. Водород – проявляет свойства восстановителя:

Водород используется для восстановления многих металлов, так как отнимает кислород у их
оксидов:
CuO + H2 = Cu + H2O,
Fe3O4 + 4H2 = 3Fe +
4Н2О, и т. д.
Применение
водорода
Видео “Применение водорода”
В настоящее время водород получают в огромных
количествах. Очень большую часть его используют при синтезе аммиака,
гидрогенизации жиров и при гидрировании угля, масел и углеводородов. Кроме
того, водород применяют для синтеза соляной кислоты, метилового спирта,
синильной кислоты, при сварке и ковке металлов, а также при изготовлении ламп
накаливания и драгоценных камней. В продажу водород поступает в баллонах под
давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной
надписью “Водород”.
Водород используется для
превращения жидких жиров в твердые (гидрогенизация), производства жидкого
топлива гидрогенизацией углей и мазута. В металлургии водород используют как
восстановитель оксидов или хлоридов для получения металлов и неметаллов
(германия, кремния, галлия, циркония, гафния, молибдена, вольфрама и др.).
Практическое применение водорода
многообразно: им обычно заполняют шары-зонды, в химической промышленности он
служит сырьём для получения многих весьма важных продуктов (аммиака и др.), в
пищевой – для выработки из растительных масел твёрдых жиров и т. д. Высокая
температура (до 2600 °С), получающаяся при горении водорода в кислороде,
используется для плавления тугоплавких металлов, кварца и т. п. Жидкий водород
является одним из наиболее эффективных реактивных топлив. Ежегодное мировое
потребление водорода превышает 1 млн. т.
ТРЕНАЖЕРЫ
№1. Химические свойства водорода
№2. Водород
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
Задание №1
Составьте уравнения реакций взаимодействия водорода со следующими веществами: F2, Ca, Al2O3, оксидом ртути (II), оксидом вольфрама (VI). Назовите продукты реакции, укажите типы реакций.
Задание №2
Осуществите превращения по схеме:
H2O -> H2 -> H2S -> SO2
Задание №3.
Вычислите массу воды, которую можно получить при сжигании 8 г водорода?
Источник
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) – самый легкий химический элемент, при обычных условиях – газ
без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород – самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
Проявляет степени окисления: -1, 0, +1.
Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
- Методом газификации угля, торфа, сланца
- Электролизом водных растворов щелочей
- Каталитическим окислением кислородом (неполное окисление)
CH4 + H2O → CO + H2
C + H2O → CO + H2
H2O → H2↑ + O2↑
CH4 + O2 → CO + H2

Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
- Гидролизом гидридов
- Взаимодействием активных металлов с водой
- Реакцией цинка или алюминия с раствором щелочи
Fe + HCl → FeCl2 + H2↑
CaH2 + H2O → Ca(OH)2 + H2↑
Ca + H2O → Ca(OH)2 + H2↑
Al + NaOH + H2O → Na[Al(OH)4] + H2↑
Химические свойства
- Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных
реакция идет только со фтором. - Как окислитель реагирует с металлами
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых
выше, чем у водорода:
H2 + O2 → (t) H2O
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
H2 + N2 → NH3
H2 + S → H2S
H2 + ZnO → Zn + H2O

Na + H2 → NaH (гидрид натрия)
Mg + H2 → MgH2
Вода
Химические свойства:
- Реакция с металлами
- Реакции с основными и кислотными оксидами
- Гидролиз солей
- Реакция с гидридами активных металлов
- Реакции с C, CO, CH4
- С галогенами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
K + H2O → KOH + H2
Реагирует с основными оксидами – с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами –
с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
CaO + H2O → Ca(OH)2
P2O5 + H2O → H3PO4
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3),
а другой – по аниону (Na2CO3).
Na2CO3 + CrBr3 + H2O → Cr(OH)3↓ + CO2 + NaBr
LiH + H2O → LiOH + H2↑
C + H2O → CO + H2
H2O + CO → (кат.) CO2 + H2
H2O + CH4 → (кат.) CO + H2
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты – без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты – при нагревании)

Кристаллогидраты
Кристаллогидраты – кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в
состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O,
Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O.
Медный купорос имеет характерный голубой цвет, а безводный сульфат меди – белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует
вычесть кристаллизационную воду и найти массу безводного сульфата калия.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
K2O2 + H2O → KOH + H2O2
BaO2 + H2SO4 → BaSO4 + H2O2
В разбавленных растворах пероксид водорода легко разлагается:
H2O2 → H2O + H2↑
Также перекись проявляет окислительные свойства:
KCl + H2O2 + H2SO4 → Cl2 + K2SO4 + H2O
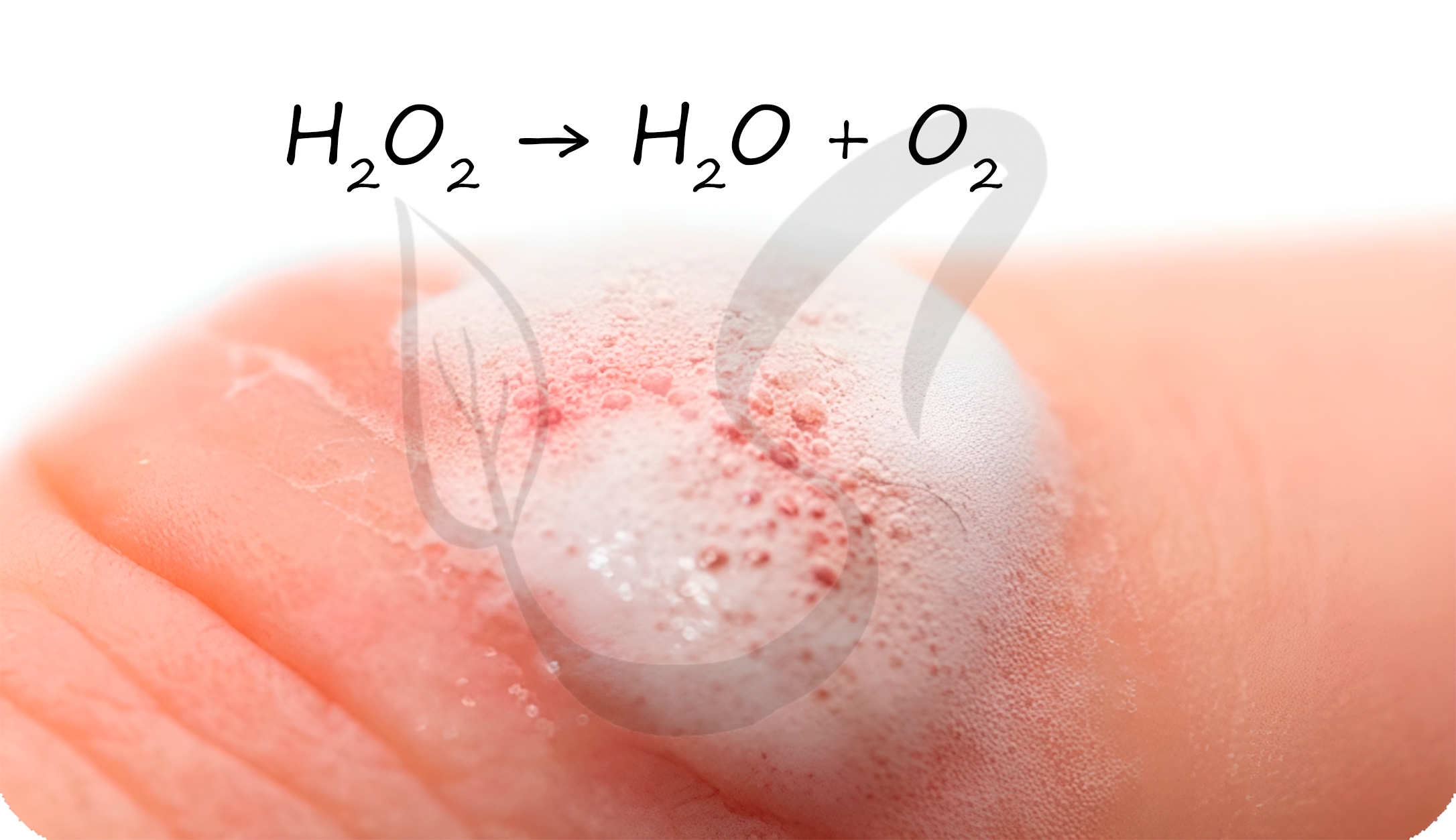
Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки,
предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Химические свойства водорода
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s1. С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов. Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов. Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:

С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
Галоген | Физические свойства |
| F2 | Светло-желтый газ с резким раздражающим запахом |
| Cl2 | Желто-зеленый газ с резким удушливым запахом |
| Br2 | Красно-бурая жидкость с резким зловонным запахом |
| I2 | Твердое вещество с резким запахом, образующее черно-фиолетовые кристаллы |
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns2np5, где n – номер периода таблицы Менделеева, в котором расположен галоген. Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике. Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ. Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены. К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5). При этом происходит образование пентафторида фосфора:
При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
Источник
