Какие свойства проявляет сернистая кислота в окислительно
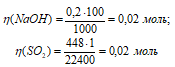
Задача 863.
Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при ее взаимодействии: а) с магнием; б) с сероводородом; в) с йодом? Какой из входящих в ее состав ионов обусловливает эти свойства в каждом из указанных случаев?
Решение:
а) Mg + H2SO3 ↔ MgSO3 + H2↑
Уравнения ионно-молекулярного баланса:
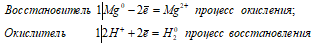
Ионно-молекулярное уравнение:
Mg0 + 2H+ = Mg2+ + H20
Молекулярная форма:
Mg + H2SO3 ↔ MgSO3 + H2↑
Таким образом, сернистая кислота проявляет свойства окислителя, уменьшая степень окисления водорода от +2 до 0.
б) H2SO3 + 2H2S ↔ 3S↓ + 3H2O.
Уравнения ионно-молекулярного баланса:
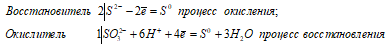
Ионно-молекулярное уравнение:
2S2- + SO32- + 6H+ ↔ 3S0 + 3H2O
Молекулярная форма:
H2SO3 + 2H2S ↔ 3S↓+ 3H2O.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая свою степень окисления серы от -2 до 0.
в) H2SO3 + I2 ↔ SO3 + 2HI
Уравнения ионно-молекулярного баланса:
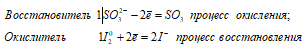
Ионно-молекулярное уравнение:
SO32- + I20 ↔ SO3 + 2I–
Молекулярная форма:
H2SO3 + I2 ↔ SO3 + 2HI.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая степень окисления серы от +4 до +6.
Тиосульфат натрия
Задача 864.
Через 100 мл 0,2 н. раствора NаОН пропустили 448 мл SO2 (условия нормальные). Какая соль образовалась? Найти ее массу.
Решение:
Уравнение реакции имеет вид:
2NaOH + SO2 ↔ Na2SO3 + H2O
Находим количество NaOH и SO2:
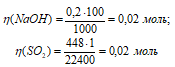
Из уравнения реакции вытекает, что из 2 молей NaOH и 1 моля SO2 образуются 1 моль Na2SO3, значит , NaOH взято в недостатке, поэтому расчет массы Na2SO3 производим по количеству NaOH. Исходя из этих рассуждений в результате реакции из 0,02 моль NaOH образовалось 0,01 моль Na2SO3.
Рассчитаем массу Na2SO3, учитывая, что М( Na2SO3) равна 126 г/моль, получим:
m( Na2SO3) = M( Na2SO3) . n( Na2SO3) = 126 .0,01 = 1,26 г.
Ответ: m( Na2SO3) = 126 г.
Тетратионовая кислота
Написать уравнения реакций взаимодействия тиосульфата натрия: а) с хлором (при его недостатке и при его избытке); б) с йодом.
Решение:
а) Взаимодействие тиосульфата натрия с хлором (при его недостатке):
Na2S2O3 + 2Cl2 + H2O ↔ 2NaCl + 2SO2↑ + 2HCl
Уравнения ионно-молекулярного баланса:
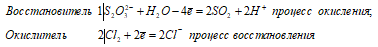
Ионно-молекулярное уравнение:
S2O32- + 2Cl20 + H2O ↔ 2SO2↑ + 4Cl–+ 2H+
Молекулярная форма:
Na2S2O3 + 2Cl2 + H2O ↔ 2NaCl + 2SO2↑ + 2HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от -2 до +4.
б) Взаимодействие тиосульфата натрия с хлором (при его избытке):
Na2S2O3 + 4Cl2 + 5H2O ↔ + 2H2SO4 + 2NaCl + 6HCl
Уравнения ионно-молекулярного баланса:
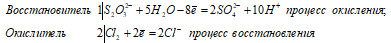
Ионно-молекулярное уравнение:
S2O32- + 4Cl20 + 5H2O ↔ 2SO42- + 8Cl- + 10H+
Молекулярная форма:
Na2S2O3 + 4Cl2 + 5H2O ↔ + 2H2SO4 + 2NaCl + 6HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
в) Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Взаимодействие тиосульфата натрия с йодом:
2Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI
Уравнения ионно-молекулярного баланса:
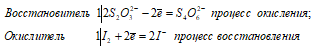
Ионно-молекулярное уравнение:
2S2O32- + I20 ↔ S4O62- + 2I–
Молекулярная форма:
2Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4.
Под действием слабого окислителя йода тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Источник
Дать характеристику окислительно-восстановительных свойств диоксида серы и сернистой кислоты. Ответ подтвердить примерами. [c.226]
В окислительно-восстановительном отношении сернистая кислота повторяет свойства диоксида серы. Она может играть роль восстановителя в реакциях с сильными окислителями и действовать как окислитель в реакциях с сильными восстановителями. [c.572]
Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при ее взаимодействии а) с магнием б) с сероводородом в) с иодом Какой из входящих в ее состав ионов обусловливает эти свойства в каждом из указанных случаев [c.226]
Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при взаимодействии а) с магнием, б) с иодом, в) с сероводородом Составить уравнения соответствующих реакций. [c.245]
Окислительно-восстановительные свойства. Сернистая кислоТа, сульфиты и гидросульфиты — сильные восстановители и слабые окислители. Они окисляются не только сильными окислителями — такими, как, например, перманганат-ион, галогены, перекись водорода, но и слабыми, как, например, солями железа (III) и даже кислородом воздуха. Окисляется сульфит-ион обычно до сульфат-иона. Ион SO3- в качестве слабого окислителя окисляет только сильные восстановители, например H2S, восстанавливаясь сам до элементарной серы [c.182]
Окислительные или восстановительные свойства проявляет сернистая кислота при взаимодействии с сероводородом и с хлором [c.151]
Сероводородная кислота, образование кислых и средних солей. Гидролиз сульфидов. Растворимость сульфидов. Оксид серы (IV), строение молекулы, получение. Физические и химические свойства. Получение сернистой кислоты. Соли кислые и средние. Окислительно-восстановительные свойства соединений серы со степенью окисления +4. Оксид серы (IV), строение молекулы, получение. Физические и химические свойства. Получение серной кислоты. Химические свойства разбавленной и концентрированной серной кислоты (взаимодействие с металлами, неметаллами, органическими веществами). [c.7]
Восстановительные и окислительные свойства сернистой кислоты [c.155]
Используя данные таблицы 4 (см. приложение), определите, в какой среде сернистая кислота и ее соли проявляют окислительные свойства, а в какой — восстановительные. [c.123]
Сероводород НзЗ является типичным восстановителем. В своих кислородных соединениях элементы этой подгруппы проявляют степень окисления +4 и +6, что соответствует оксидам КОз и КОз. Сернистый газ проявляет как окислительные, так и восстановительные свойства. Эти же свойства характерны и для сернистой кислоты. В производстве серной кислоты оксид серы (VI) 80 3 получают контактным методом, поэтому этот метод называется контактным. Серная кислота двухосновна и образует два типа солей — сульфаты и гидросульфаты. Концентрированная серная кислота при нагревании взаимодействует со многими металлами, расположенными в электрохимическом ряду напряжений металлов после водорода. Разбавленная серная кислота взаимодействует с металлами, стоящими в этом ряду перед водородом. [c.214]
Какие окислительно-восстановительные свойства может проявлять сернистая кислота [c.249]
Характеризуйте окислительно-восстановительные свойства сернистой кислоты, иллюстрировав ответ уравнениями реакций этой кислоты а) с иодом б) с хлор новатой кислотой. Сколько литров сернистого ангидрида SO2, взятого при 0° С и 760 мм рт. ст., надо пропустить через раствор хлорноватой кислоты, чтобы восстановить 16,9 г последней до H l [c.225]
Сернистая кислота и ее соли обладают как окислительными, так и восстановительными свойствами, что определяется природой партнера по реакции. Так, под действием кислорода сульфиты окисляются до сульфатов [c.186]
Сероводород НзЗ является типичным восстановителем. В своих кислородных соединениях элементы этой подгруппы проявляют степень окисления + 4 и -н 6, что соответствует оксидам КОг и КОз. Сернистый газ ЗОг проявляет как окислительные, так и восстановительные свойства. Эти же свойства характерны и для сернистой кислоты НгЗОз. Оксид серы (VI) 80з получают контактным методом в производстве серной кислоты, поэтому этот метод называется контактным. [c.193]
Сложные молекулы и ионы. К этой группе восстановителей относятся молекулы таких веществ, в которых элементы-восстановители обладают промежуточной степенью окисления моноксид азота, моноксид углерода, моноксиды железа и хрома, диоксиды серы и марганца, сернистая кислота и ее соли, азотистая кислота и ее соли, пероксид водорода и другие. Значительная часть этих соединений (диоксиды серы и марганца, сернистая и азотистая кислоты, пероксид водорода и др.) в зависимости от свойств веществ, с которыми они реагируют, могут проявлять как окислительные, так и восстановительные свойства. Так, диоксид серы или сернистая кислота при взаимодействии с окислителями (кислород, галогены) проявляют восстановительные свойства, а при взаимодействии с сероводородом — окислительные. [c.20]
Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при взаимодействии а) с магнием, [c.276]
Таким образом, 80г, сернистая кислота и ее соли могут проявлять как окислительные, так и восстановительные свойства. [c.196]
Приведите примеры окислительно-восстановительных реакций, в которых сернистая кислота обладает как окислительными, так и восстановительными свойствами. Составьте схему электронно-ионного баланса. [c.30]
Восстановительные свойства соединений в ряду — Sb” —Bi уменьшаются, окислительные свойства в ряду —Sb —Bi ” возрастают. Их сернистые соединения нерастворимы в воде и разбавленных минеральных кислотах. Трех-и пятисернистые соединения мышьяка и сурьмы растворяются в растворимых сернистых металлах и в сернистом аммонии с образованием солей соответствую-щ,их тиокислот. Сульфид висмута в сернистых металлах и [c.157]
Окислительно-восстановительные свойства манганата. В одну из трех пробирок (предыдущий опыт) добавить несколько капель хлорной воды, в другую — раствор серной кислоты (до кислой реакции), а в третью — раствор сернистой кислоты. Как изменяется окраска Составить уравнения реакций. [c.320]
Для окончательного суждения о проявлении восстановительных или окислительных свойств серы в различных валентных состояниях провести следующий опыт. Поместить в пробирку микрошпатель кристаллов сульфита натрия, прибавить 5—6 капель 2 н. раствора серной кислоты и, после полного растворения кристаллов, пропустить через прозрачный раствор струю сероводорода (прибор для получения НгЗ поместить в вытяжном шкафу) до выпадения серы. Написать уравнение взаимодействия сернистой кислоты, образовавшейся при растворении сульфита натрия в серной кислоте, с сероводородом. [c.99]
Написать уравнение реакции. Окислительными или восстановительными свойствами обладает в этой реакции сернистая кислота [c.185]
Относительно высокое значение потенциалов систем Э/Н2ЗО3 в кислой среде позволяет проводить выделение селена и теллура в элементарной форме под действием различных восстановителей металлических цинка и кадмия, двухлористого олова, сернистого газа, солянокислого гидразина. Необходимо, однако, подчеркнуть, что следует очень осторожно опираться на приведенные значения потенциалов при оценке возможности протекания той или иной окислительно-восстановительной реакции, участниками которой являются анионы кислородных кислот селена и теллура. Имеется не мало примеров того, когда нормальные потенциалы не увязываются с химическими свойствами кислородных кислот селена и теллура. Показательным является то, что Н23е04 не восстанавливается таким восстановителем, как сернистый газ, и восстанавливается соляной кислотой. [c.517]
Почему сернистая кислота обладает восстановительными и окислительными свойствами, а серная кислота — только окислительными [c.136]
Кислоты весьма реакционноспособны и взаимодействуют с многими простыми и сложными веществами. Азотная, хлорная, серная кислоты — сильные окислители галогенводородные кислоты — сильные восстановители. Азотистая и сернистая кислоты проявляют как окислительные, так и восстановительные свойства. [c.25]
Таким образом, сернистый газ, сернистая кислота и ее соли могут проявлять как окислительные, так и восстановительные свойства, однако практически для этих соединений наиболее характерны восстановительные свойства. Сернистая кислота практического значения не имеет, однако ее соли, особенно МагЗОз и NaHSOs, широко используются в фотографии. Двуокись серы получается при обжиге железного колчедана, в огромных количествах используется для получения серного ангидрида с последующим получением серной кислоты. [c.295]
Окислительные и восстановительные свойства сернистой кислоты, а. Налить в пробирку 2—3 мл сероводородной воды и столько же раствора сернистой кислоты. Наблюдать выделение серы в виде мути. Объяснить. Напцеать уравнение окислительно-восстановительной реакции. [c.150]
При нагревании на воздухе или в кислороде сера и селен сгорают синим, а теллур — зеленовато-синим пламенем с образованием двуокисей. Двуокись серы — бесцветный газ с характерным резким запахом, ядовитый, тяжелее воздуха. Двуокиси селена и теллура при обычных условиях — белые кристаллические вещества они ядовиты. ЗОг и ЗеОг растворимы в воде, ТеОг — очень плохо. Будучи кислотными оксидами, они при растворении в воде образуют соответственно сернистую, селенистую и теллуристую кислоты. ТеОг проявляет амфотерные свойства. Сернистая кислота — кислота средней силы, селенистая и теллуристая — более слабые. В противоположность производным серы (IV) (50г, НгЗОз, МаНЗОд), для которых характерны восстановительные свойства, ЗеОг, ТеОг, НгЗеОз, НгТеОз (и их соли) проявляют окислительные свойства. Но сильными окислителями они могут быть сами окислены до степени окисления +VI. [c.206]
Вообще же разделение веществ на окислители и восстановители не является очень строгим. Некоторые соединения, в зависимости от того, с каким веществом реагируют, могут проявлять либо восстановительные свойства, либо окислительные. Например сернистая кислота при взаргмодействии с хлором проявляет восстановительные свойства она восстанавливает хлор в хлорид-анионы, окисляясь при этом в серную кислоту [c.319]
Диоксид серы. Окислительно-восстановительные свойства диоксида серы ЗОг (сернистый газ) можно изучать, используя его в газовом состоянии (пропускать через раствор реагента) или же в виде водного раствора— сернистой Кислоты. Такие же результаты получаются при использовании подкисленных растворов сульфитов КааЗОз или Кг50з. [c.279]
Зная степень окисления элемента в соединении, можно предсказать, окислительные или восстановительные свойства проявит это соединение. Так, сера в серной кислоте H2SO4 имеет высшую степень окисления (-Ь6) и, следовательно, больше не может отдавать электронов, а потому серная кислота может быть только окислителем. В сероводороде HjS сера, наоборот, имеет низшую степень окисления (—2) и больше не может присоединять электронов (образован октет), а потому сероводород может быть только восстановителем. Однако сернистая кислота HjSOg (сера в ней имеет промежуточную степень окисления -(-4 и может как отдавать, так и присоединять электроны) в зависимости от условий может проявлять как окислительные, так и восстановительные свойства. Подобное заключение можно сделать об однотипных соединениях аналогов серы — селена и теллура. В высшей степени окисления атомы селена и теллура сильно отличаются от атомов со степенью окисления +4 и особенно —2. Это относится к элементам и других подгрупп периодической системы. [c.84]
У металлов, расположенных в ряду напряжений слева от в дорода, преобладают восстановительные свойства, тем ярче в раженные, чем отрицательнее нормальный потенциал. У мета лов, стоящих справа от водорода, преобладают окислительн свойства, тем более сильные, чем положительнее нормальн потенциал. Однако нельзя говорить об абсолютных окислител или восстановителях, так как многие элементы и соответству щие им ионы меняют свой характер в зависимости от среды, также от химической природы веществ, с которыми они вступа во взаимодействие. Так, например, сернистая кислота являет восстановителем в слабокислой и окислителем в сильнокисл) среде [c.142]
Смотреть страницы где упоминается термин Восстановительные и окислительные свойства сернистой кислоты:
[c.312]
[c.185]
[c.65]
Источник
Задача 863.
Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при ее взаимодействии: а) с магнием; б) с сероводородом; в) с йодом? Какой из входящих в ее состав ионов обусловливает эти свойства в каждом из указанных случаев?
Решение:
а) Mg + H2SO3 ↔ MgSO3 + H2↑
Уравнения ионно-молекулярного баланса:
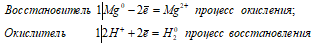
Ионно-молекулярное уравнение:
Mg0 + 2H+ = Mg2+ + H20
Молекулярная форма:
Mg + H2SO3 ↔ MgSO3 + H2↑
Таким образом, сернистая кислота проявляет свойства окислителя, уменьшая степень окисления водорода от +2 до 0.
б) H2SO3 + 2H2S ↔ 3S↓ + 3H2O.
Уравнения ионно-молекулярного баланса:
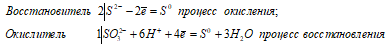
Ионно-молекулярное уравнение:
2S2- + SO32- + 6H+ ↔ 3S0 + 3H2O
Молекулярная форма:
H2SO3 + 2H2S ↔ 3S↓+ 3H2O.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая свою степень окисления серы от -2 до 0.
в) H2SO3 + I2 ↔ SO3 + 2HI
Уравнения ионно-молекулярного баланса:
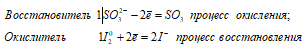
Ионно-молекулярное уравнение:
SO32- + I20 ↔ SO3 + 2I–
Молекулярная форма:
H2SO3 + I2 ↔ SO3 + 2HI.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая степень окисления серы от +4 до +6.
Тиосульфат натрия
Задача 864.
Через 100 мл 0,2 н. раствора NаОН пропустили 448 мл SO2 (условия нормальные). Какая соль образовалась? Найти ее массу.
Решение:
Уравнение реакции имеет вид:
2NaOH + SO2 ↔ Na2SO3 + H2O
Находим количество NaOH и SO2:
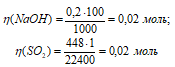
Из уравнения реакции вытекает, что из 2 молей NaOH и 1 моля SO2 образуются 1 моль Na2SO3, значит , NaOH взято в недостатке, поэтому расчет массы Na2SO3 производим по количеству NaOH. Исходя из этих рассуждений в результате реакции из 0,02 моль NaOH образовалось 0,01 моль Na2SO3.
Рассчитаем массу Na2SO3, учитывая, что М( Na2SO3) равна 126 г/моль, получим:
m( Na2SO3) = M( Na2SO3) . n( Na2SO3) = 126 .0,01 = 1,26 г.
Ответ: m( Na2SO3) = 126 г.
Тетратионовая кислота
Написать уравнения реакций взаимодействия тиосульфата натрия: а) с хлором (при его недостатке и при его избытке); б) с йодом.
Решение:
а) Взаимодействие тиосульфата натрия с хлором (при его недостатке):
Na2S2O3 + 2Cl2 + H2O ↔ 2NaCl + 2SO2↑ + 2HCl
Уравнения ионно-молекулярного баланса:
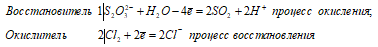
Ионно-молекулярное уравнение:
S2O32- + 2Cl20 + H2O ↔ 2SO2↑ + 4Cl–+ 2H+
Молекулярная форма:
Na2S2O3 + 2Cl2 + H2O ↔ 2NaCl + 2SO2↑ + 2HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от -2 до +4.
б) Взаимодействие тиосульфата натрия с хлором (при его избытке):
Na2S2O3 + 4Cl2 + 5H2O ↔ + 2H2SO4 + 2NaCl + 6HCl
Уравнения ионно-молекулярного баланса:
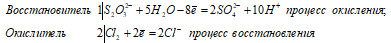
Ионно-молекулярное уравнение:
S2O32- + 4Cl20 + 5H2O ↔ 2SO42- + 8Cl- + 10H+
Молекулярная форма:
Na2S2O3 + 4Cl2 + 5H2O ↔ + 2H2SO4 + 2NaCl + 6HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
в) Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Взаимодействие тиосульфата натрия с йодом:
2Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI
Уравнения ионно-молекулярного баланса:
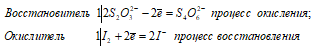
Ионно-молекулярное уравнение:
2S2O32- + I20 ↔ S4O62- + 2I–
Молекулярная форма:
2Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4.
Под действием слабого окислителя йода тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Источник
