Какие свойства проявляет сернистая кислота в
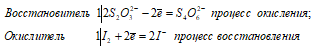
Задача 863.
Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при ее взаимодействии: а) с магнием; б) с сероводородом; в) с йодом? Какой из входящих в ее состав ионов обусловливает эти свойства в каждом из указанных случаев?
Решение:
а) Mg + H2SO3 ↔ MgSO3 + H2↑
Уравнения ионно-молекулярного баланса:
Ионно-молекулярное уравнение:
Mg0 + 2H+ = Mg2+ + H20
Молекулярная форма:
Mg + H2SO3 ↔ MgSO3 + H2↑
Таким образом, сернистая кислота проявляет свойства окислителя, уменьшая степень окисления водорода от +2 до 0.
б) H2SO3 + 2H2S ↔ 3S↓ + 3H2O.
Уравнения ионно-молекулярного баланса:
Ионно-молекулярное уравнение:
2S2- + SO32- + 6H+ ↔ 3S0 + 3H2O
Молекулярная форма:
H2SO3 + 2H2S ↔ 3S↓+ 3H2O.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая свою степень окисления серы от -2 до 0.
в) H2SO3 + I2 ↔ SO3 + 2HI
Уравнения ионно-молекулярного баланса:
Ионно-молекулярное уравнение:
SO32- + I20 ↔ SO3 + 2I–
Молекулярная форма:
H2SO3 + I2 ↔ SO3 + 2HI.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая степень окисления серы от +4 до +6.
Тиосульфат натрия
Задача 864.
Через 100 мл 0,2 н. раствора NаОН пропустили 448 мл SO2 (условия нормальные). Какая соль образовалась? Найти ее массу.
Решение:
Уравнение реакции имеет вид:
2NaOH + SO2 ↔ Na2SO3 + H2O
Находим количество NaOH и SO2:
Из уравнения реакции вытекает, что из 2 молей NaOH и 1 моля SO2 образуются 1 моль Na2SO3, значит , NaOH взято в недостатке, поэтому расчет массы Na2SO3 производим по количеству NaOH. Исходя из этих рассуждений в результате реакции из 0,02 моль NaOH образовалось 0,01 моль Na2SO3.
Рассчитаем массу Na2SO3, учитывая, что М( Na2SO3) равна 126 г/моль, получим:
m( Na2SO3) = M( Na2SO3) . n( Na2SO3) = 126 .0,01 = 1,26 г.
Ответ: m( Na2SO3) = 126 г.
Тетратионовая кислота
Написать уравнения реакций взаимодействия тиосульфата натрия: а) с хлором (при его недостатке и при его избытке); б) с йодом.
Решение:
а) Взаимодействие тиосульфата натрия с хлором (при его недостатке):
Na2S2O3 + 2Cl2 + H2O ↔ 2NaCl + 2SO2↑ + 2HCl
Уравнения ионно-молекулярного баланса:
Ионно-молекулярное уравнение:
S2O32- + 2Cl20 + H2O ↔ 2SO2↑ + 4Cl–+ 2H+
Молекулярная форма:
Na2S2O3 + 2Cl2 + H2O ↔ 2NaCl + 2SO2↑ + 2HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от -2 до +4.
б) Взаимодействие тиосульфата натрия с хлором (при его избытке):
Na2S2O3 + 4Cl2 + 5H2O ↔ + 2H2SO4 + 2NaCl + 6HCl
Уравнения ионно-молекулярного баланса:
Ионно-молекулярное уравнение:
S2O32- + 4Cl20 + 5H2O ↔ 2SO42- + 8Cl- + 10H+
Молекулярная форма:
Na2S2O3 + 4Cl2 + 5H2O ↔ + 2H2SO4 + 2NaCl + 6HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
в) Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Взаимодействие тиосульфата натрия с йодом:
2Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI
Уравнения ионно-молекулярного баланса:
Ионно-молекулярное уравнение:
2S2O32- + I20 ↔ S4O62- + 2I–
Молекулярная форма:
2Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4.
Под действием слабого окислителя йода тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Источник
Задача 863.
Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при ее взаимодействии: а) с магнием; б) с сероводородом; в) с йодом? Какой из входящих в ее состав ионов обусловливает эти свойства в каждом из указанных случаев?
Решение:
а) Mg + H2SO3 ↔ MgSO3 + H2↑
Уравнения ионно-молекулярного баланса:
Ионно-молекулярное уравнение:
Mg0 + 2H+ = Mg2+ + H20
Молекулярная форма:
Mg + H2SO3 ↔ MgSO3 + H2↑
Таким образом, сернистая кислота проявляет свойства окислителя, уменьшая степень окисления водорода от +2 до 0.
б) H2SO3 + 2H2S ↔ 3S↓ + 3H2O.
Уравнения ионно-молекулярного баланса:
Ионно-молекулярное уравнение:
2S2- + SO32- + 6H+ ↔ 3S0 + 3H2O
Молекулярная форма:
H2SO3 + 2H2S ↔ 3S↓+ 3H2O.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая свою степень окисления серы от -2 до 0.
в) H2SO3 + I2 ↔ SO3 + 2HI
Уравнения ионно-молекулярного баланса:
Ионно-молекулярное уравнение:
SO32- + I20 ↔ SO3 + 2I–
Молекулярная форма:
H2SO3 + I2 ↔ SO3 + 2HI.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая степень окисления серы от +4 до +6.
Тиосульфат натрия
Задача 864.
Через 100 мл 0,2 н. раствора NаОН пропустили 448 мл SO2 (условия нормальные). Какая соль образовалась? Найти ее массу.
Решение:
Уравнение реакции имеет вид:
2NaOH + SO2 ↔ Na2SO3 + H2O
Находим количество NaOH и SO2:
Из уравнения реакции вытекает, что из 2 молей NaOH и 1 моля SO2 образуются 1 моль Na2SO3, значит , NaOH взято в недостатке, поэтому расчет массы Na2SO3 производим по количеству NaOH. Исходя из этих рассуждений в результате реакции из 0,02 моль NaOH образовалось 0,01 моль Na2SO3.
Рассчитаем массу Na2SO3, учитывая, что М( Na2SO3) равна 126 г/моль, получим:
m( Na2SO3) = M( Na2SO3) . n( Na2SO3) = 126 .0,01 = 1,26 г.
Ответ: m( Na2SO3) = 126 г.
Тетратионовая кислота
Написать уравнения реакций взаимодействия тиосульфата натрия: а) с хлором (при его недостатке и при его избытке); б) с йодом.
Решение:
а) Взаимодействие тиосульфата натрия с хлором (при его недостатке):
Na2S2O3 + 2Cl2 + H2O ↔ 2NaCl + 2SO2↑ + 2HCl
Уравнения ионно-молекулярного баланса:
Ионно-молекулярное уравнение:
S2O32- + 2Cl20 + H2O ↔ 2SO2↑ + 4Cl–+ 2H+
Молекулярная форма:
Na2S2O3 + 2Cl2 + H2O ↔ 2NaCl + 2SO2↑ + 2HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от -2 до +4.
б) Взаимодействие тиосульфата натрия с хлором (при его избытке):
Na2S2O3 + 4Cl2 + 5H2O ↔ + 2H2SO4 + 2NaCl + 6HCl
Уравнения ионно-молекулярного баланса:
Ионно-молекулярное уравнение:
S2O32- + 4Cl20 + 5H2O ↔ 2SO42- + 8Cl- + 10H+
Молекулярная форма:
Na2S2O3 + 4Cl2 + 5H2O ↔ + 2H2SO4 + 2NaCl + 6HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
в) Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Взаимодействие тиосульфата натрия с йодом:
2Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI
Уравнения ионно-молекулярного баланса:
Ионно-молекулярное уравнение:
2S2O32- + I20 ↔ S4O62- + 2I–
Молекулярная форма:
2Na2S2O3 + I2 ↔ Na2S4O6 + 2NaI
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4.
Под действием слабого окислителя йода тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Источник
Сернистая кислота – это неорганическая двухосновная неустойчивая кислота средней силы. Непрочное соединение, известна только в водных растворах при концентрации не более шести процентов. При попытках выделить чистую сернистую кислоту она распадается на оксид серы (SO2) и воду (H2O). Например, при воздействии серной кислоты (H2SO4) в концентрированном виде на сульфит натрия (Na2SO3) вместо сернистой кислоты выделяется оксид серы (SO2). Вот так выглядит данная реакция:
Na2SO3 (сульфит натрия) + H2SO4 (серная кислота) = Na2SO4 (сульфат натрия) + SO2 (серы диоксид) + H2O (вода)
Раствор сернистой кислоты
При его хранении необходимо исключить доступ воздуха. Иначе сернистая кислота, медленно поглощая кислород (O2), превратится в серную.
2H2SO3 (кислота сернистая) + O2 (кислород) = 2H2SO4 (кислота серная)
Растворы сернистой кислоты имеют довольно специфический запах (напоминает запах, остающийся после зажжения спички), наличие которого можно объяснить присутствием оксида серы (SO2), химически не связанного водой.
Химические свойства сернистой кислоты
1. Сернистая кислота (формула H2SO3) может использоваться в качестве восстановителя или окислителя.
H2SO3 является хорошим восстановителем. С ее помощью можно из свободных галогенов получить галогеноводороды. Например:
H2SO3 (кислота сернистая) + Cl2 (хлор, газ) + H2O (вода) = H2SO4 (кислота серная) + 2HCl (соляная кислота)
Но при взаимодействии с сильными восстановителями данная кислота будет выполнять роль окислителя. Примером может послужить реакция сернистой кислоты с сероводородом:
H2SO3 (кислота сернистая) + 2H2S (сероводород) = 3S (сера) + 3H2O (вода)
2. Рассматриваемое нами химическое соединение образует два вида солей – сульфиты (средние) и гидросульфиты (кислые). Эти соли являются восстановителями, так же, как и (H2SO3) сернистая кислота. При их окислении образуются соли серной кислоты. При прокаливании сульфитов активных металлов образуются сульфаты и сульфиды. Это реакция самоокисления-самовосстановления. Например:
4Na2SO3 (сульфит натрия) = Na2S (сульфид натрия) + 3Na2SO4 (сульфат натрия)
Сульфиты натрия и калия (Na2SO3 и K2SO3) применяются при крашении тканей в текстильной промышленности, при отбеливании металлов, а также в фотографии. Кальция гидросульфит (Ca(HSO3)2), существующий только в растворе, используется для переработки древесного материала в специальную сульфитную целлюлозу. Из нее потом делают бумагу.
Применение сернистой кислоты
Сернистая кислота используется:
– для обесцвечивания шерсти, шелка, древесной массы, бумаги и других аналогичных веществ, не выдерживающих отбеливания при помощи более сильных окислителей (например, хлора);
– как консервант и антисептик, например, для предотвращения ферментации зерна при получении крахмала или для предотвращения процесса брожения в бочках вина;
– для сохранения продуктов, например, при консервировании овощей и плодов;
– в переработке щепы древесной в целлюлозу сульфитную, из которой потом получают бумагу. В этом случае используется раствор кальция гидросульфита (Ca(HSO3)2), который растворяет лигнин – особое вещество, связывающее волокна целлюлозы.
Сернистая кислота: получение
Данную кислоту можно получить посредством растворения сернистого газа (SO2) в воде (H2O). Вам понадобятся серная кислота в концентрированном виде (H2SO4), медь (Cu) и пробирка. Алгоритм действий:
1. Осторожно налейте в пробирку концентрированную сернистую кислоту и затем поместите туда кусочек меди. Нагрейте. Происходит следующая реакция:
Cu (медь) + 2H2SO4 (серная кислота) = CuSO4 (сульфат серы) + SO2 (сернистый газ) + H2O (вода)
2. Поток сернистого газа необходимо направить в пробирку с водой. При его растворении частично происходит химическая реакция с водой, в результате которой образуется сернистая кислота:
SO2 (сернистый газ) + H2O (вода) = H2SO3
Итак, пропуская сернистый газ через воду, можно получить сернистую кислоту. Стоит учесть, что данный газ оказывает раздражающее воздействие на оболочки дыхательных путей, может вызвать их воспаление, а также потерю аппетита. При длительном его вдыхании возможна потеря сознания. Обращаться с этим газом нужно с предельной осторожностью и внимательность.
Источник
Се́рная
кислота́ H2SO4 – сильная двухосновная
кислота, отвечающая высшей степени
окисления серы (+6). При обычных условиях
концентрированная серная кислота –
тяжёлая маслянистая жидкость без цвета
и запаха, с кислым «медным» вкусом. В
технике серной кислотой называют её
смеси как с водой, так и с серным ангидридом
SO3. Если молярное отношение SO3: H2O 1 – раствор SO3 в серной кислоте
(олеум).
Физические
и физико-химические свойства
Очень
сильная кислота, при 18оС pKa (1) = −2,8, pKa
(2) = 1,92 (К₂ 1,2 10−2); длины связей в молекуле
S=O 0,143 нм, S-OH 0,154 нм, угол HOSOH 104°, OSO 119°;
кипит, образуя азеотропную смесь (98,3 %
H2SO4 и 1,7 % H2О с температурой кипения
338,8оС). Серная кислота, отвечающая
100%-ному содержанию H2SO4, имеет состав
(%): H2SO4 99,5, HSO4− – 0,18, H3SO4+ – 0,14, H3O+ – 0,09,
H2S2O7, – 0,04, HS2O7⁻ – 0,05. Смешивается с водой
и SO3, во всех соотношениях. В водных
растворах серная кислота практически
полностью диссоциирует на H3О+, HSO3+, и
2НSO₄−. Образует гидраты H2SO4·nH2O, где n =
1, 2, 3, 4 и 6,5.
H 2 SO 4 –
сильная двухосновная кислота, водный
раствор изменяет окраску индикаторов
(лакмус и универсальный индикатор
краснеют)
1)
Диссоциация протекает ступенчато:
H 2 SO 4 →H + +HSO 4 – (первая
ступень, образуется гидросульфат –
ион)
HSO 4 – →H + +SO 4 2- (вторая
ступень, образуется сульфат – ион)
H 2 SO 4 образует
два ряда солей – средние (сульфаты) и
кислые (гидросульфаты)
2)
Взаимодействие с металлами:
Разбавленная
серная кислота растворяет только
металлы, стоящие в ряду напряжений левее
водорода:
Zn 0 +
H 2 +1 SO 4 (разб)
→ Zn +2 SO 4 +
H 2 0
Zn 0 +
2H + →Zn 2+ +H 2 0
3)
Взаимодействие с основными и
амфотерными оксидами:
CuO
+ H 2 SO 4 →
CuSO 4 +
H 2 O
CuO
+ 2H + →
Cu 2+ +
H 2 O
4)
Взаимодействие
с основаниями:
· H 2 SO 4 +
2NaOH →Na 2 SO 4 +
2H 2 O(реакция
нейтрализации)
H + +OH – →H 2 O
Если
кислота в избытке, то образуется кислая
соль:
H
2
SO
4
+
NaOH
→
Na
Н
SO
4
+
H
2
O
· H 2 SO 4 +Cu(OH) 2 →CuSO 4 +
2H 2 O
2H + +Cu(OH) 2 →Cu 2+ +
2H 2 O
5)
Обменные реакции с солями:
образование
осадка
BaCl 2 +
H 2 SO 4 →
BaSO 4 ↓
+ 2HCl
Ba 2+ + SO 4 2- → BaSO 4 ↓
Сернистая
кислота
–
неустойчивая двухосновная неорганическая кислота средней
силы.
Отвечает степени окисления серы +4.
Химическая формула .
Химические
свойства сернистой кислоты
1. Сернистая
кислота (формула H2SO3) может использоваться
в качестве восстановителя или окислителя.
H2SO3 является
хорошим восстановителем. С ее помощью
можно из свободных галогенов получить
галогеноводороды. Например:
H2SO3 (кислота
сернистая) + Cl2 (хлор, газ) + H2O (вода) = H2SO4
(кислота серная) + 2HCl (соляная кислота)
Но при
взаимодействии с сильными восстановителями
данная кислота будет выполнять роль
окислителя. Примером может послужить
реакция сернистой кислоты с сероводородом:
H2SO3 (кислота
сернистая) + 2H2S (сероводород) = 3S (сера) +
3H2O (вода)
2.
Рассматриваемое нами химическое
соединение образует два вида солей –
сульфиты (средние) и гидросульфиты
(кислые). Эти соли являются восстановителями,
так же, как и (H2SO3) сернистая кислота. При
их окислении образуются соли серной
кислоты. При прокаливании сульфитов
активных металлов образуются сульфаты
и сульфиды. Это реакция
самоокисления-самовосстановления.
Например:
4Na2SO3 (сульфит
натрия) = Na2S (сульфид натрия) + 3Na2SO4 (сульфат
натрия)
Сульфиты
натрия и калия (Na2SO3 и K2SO3) применяются
при крашении тканей в текстильной
промышленности, при отбеливании металлов,
а также в фотографии. Кальция гидросульфит
(Ca(HSO3)2), существующий только в растворе,
используется для переработки древесного
материала в специальную сульфитную
целлюлозу. Из нее потом делают бумагу.
Сероводоро́д
(серни́стый водоро́д, сульфи́д водоро́да,
дигидросульфи́д) – бесцветный газ со
сладковатым вкусом, имеющий запах
протухших куриных яиц. Бинарное химическое
соединение водорода и серы. Химическая
формула – H2S. Плохо растворим в воде,
хорошо – в этаноле. Ядовит. При больших
концентрациях взаимодействует со
многими металлами. Огнеопасен.
Концентрационные пределы воспламенения
в смеси с воздухом составляют 4,5-45 %
сероводорода. Используется в химической
промышленности для синтеза некоторых
соединений, получения элементарной
серы, серной кислоты, сульфидов.
Сероводород также используют в лечебных
целях, например, в сероводородных ваннах.
В воде
сероводород мало растворим, водный
раствор H2S является очень слабой кислотой:
H2S → HS− + H+
С основаниями
реагирует:
H2S + 2NaOH =
Na2S + 2H2O (обычная соль, при избытке NaOH)
H2S + NaOH = NaHS
+ H2O (кислая соль, при отношении 1:1)
Сероводород
– сильный восстановитель. На воздухе
он горит синим пламенем:
2H2S + ЗО2 =
2Н2О + 2SO2
при недостатке
кислорода:
2H2S + O2 = 2S +
2H2O
(на этой
реакции основан промышленный способ
получения серы).
Сероводород
реагирует также со многими другими
окислителями, при его окислении в
растворах образуется свободная сера
или SO42-, например:
3H2S
+ 4HClO3 = 3H2SO4 + 4HCl
2H2S
+ SO2 = 2Н2О +
3S
Cтраница 2
Для окисления селенистой кислоты в растворах до селеновой кислоты необходимы более энергичные окислители, чем для окисления сернистой кислоты.
Образование перекиси водорода при действии молекулярного кислорода на сернистую кислоту давно установлено и никем не оспаривается. Таким образом, окисление сернистой кислоты молекулярным кислородом как под действием света, так и под действием окиси меди можно представить себе как цепную, разветвляющуюся (согласно теории И. Н. Семенова) реакцию, не прибегая к помощи гидроксила, образование которого при обыкновенной температуре не доказано.
Определен нем асе осой доли общей сернистой кислоты ускоренным методом. Метод основан на окислении сернистой кислоты йодом. При определении раствор объекта исследования предварительно обрабатывают последовательно раствором гадрокседа калия или натрия и серной кислотой для превращения связанной сернистой кислоты в свободную.
Покажите путем подсчетов возможность окисления сернистой кислоты в сульфат-ион кислородом воздуха.
Другие методы основаны на реакциях окисления сернистой кислоты до серной с последующим нефелометрическим определением либо на восстановлении сернистой кислоты до сероводорода и определением его в виде метиленового голубого.
В пробирке, где был добавлен глицерин, помутнение будет значительно слабее. Какую роль играет глицерин в процессе окисления сернистой кислоты кислородом.
Является ли сульфат-ион единственным возможным продуктом окисления сернистой кислоты.
Особенно убедительные доказательства этому были приведены впервые в работах Кирхгоффа (1811 – 1814 гг.) по превращению крахмала в декстрин и глюкозу в присутствии минеральных кислот и энзимов. Несколько ранее (1806 г.) Клеман и Дезорм показали регенерацию окислов азота в процессе окисления сернистой кислоты в серную.
Приведенная реакция не дает, конечно, возможности с уверенностью открывать следы карбонатов, но она удовлетворяет обычному испытанию при условии отсутствия сульфита. Через одно отверстие вставляют маленькую капельную воронку так, чтобы конец ее доходил почти до дна склянки; в другое отверстие вставляют согнутую под прямым углом стеклянную трубку для отвода выделяющегося газа – во вторую склянку; во второй склянке находится около 51 г хромового ангидрида СгОз, растворенного в небольшом количестве воды и 25 ял 6N серной кислоты. Эта склянка служит для окисления сернистой кислоты или сернистого водорода, могущих выделяться из анализируемого вещества. Трубки во (второй склянке устанавливают так, чтобы газ поступал в склянку у са. Эту склянку присоединяют таким же путем к третьей склянке, выходная трубка которой соединена с хлоркальциевой трубкой, наполненной натронной известью, чтобы воспрепятствовать попаданию в прибор углекислоты из воздуха. Растертое в порошок вещество1 всыпают в первую склянку, куда затем наливают 25 мл воды. Через прибор, включая и третью порожнюю склянку, пропускают в течение 10 мин. Для этого присоединяют хлоркальциевую1 трубку третьей склянки к насосу, а в горлышко капельной воронки (присоединенной к (первой склянке) вставляют на резиновой пробке трубку с натронной известью.
Приведенная реакция не дает, конечно, возможности с уверенностью открывать следы карбонатов, но она удовлетворяет обычному испытанию при условии отсутствия сульфита. Через одно отверстие вставляют маленькую капельную воронку так, чтобы конец ее доходил почти до дна склянки; в другое отверстие вставляют согнутую под прямым углом стеклянную трубку для отвода выделяющегося газа – во вторую склянку; во второй склянке находится около – б1 г хромового ангидрида СгОз, растворенного в небольшом количестве воды и 25 мл 6 / V серной кислоты. Эта склянка служит для окисления сернистой кислоты или сернистого водорода, могущих выделяться из анализируемого вещества. Трубки во второй склянке устанавливают так, чтобы газ поступал в склянку у самого дна, проходил через раствор и выходил из склянки через отводную трубку, заканчивающуюся непосредственно под резиновой пробкой. Эту склянку присоединяют таким же путем к третьей склянке, выходная трубка которой соединена с хлоркальциевой трубкой, наполненной натронной известью, чтобы воспрепятствовать попаданию в прибор углекислоты из воздуха. Растертое в порошок вещество1 всыпают в первую склянку, куда затем наливают 25 мл воды. Через прибор, включая и третью порожнюю склянку, пропускают в течение 10 мин. Для этото присоединяют хлоркальциевую1 трубку третьей склянки к насосу, а в горлышко капельной воронки (присоединенной к (первой склянке) вставляют на резиновой пробке трубку с натронной известью.
Установить, в какой из пробирок окисление шло более энергично. В пробирке, где был добавлен глицер. Какую роль играет глицерин в процессе окисления сернистой кислоты кислородом.
Большинство этих окислителей приводит к сульфированию производных 2-нафтола; выход сульфокислот зависит от природы окислителя и от условий реакции. При использовании Ре Оз, AgNOa, воздуха и 4-сульфофенилдиазосульфоната получен малый выход сульфокислот. Реакция нитросоединений с бисульфитом замедляется в присутствии оксисоединений, сульфирующихся при окислении сернистой кислоты.
Количество газа, поступающего на очистку, составляет около 1200000 м3 / час. Газ после каждого котла интенсивно промывается водой в камерах, затем в длинном горизонтальном общем газоходе. Между камерами и газоходом газ проходит через железную насадку. Благодаря железной насадке увеличивается поверхность соприкосновения газа с водой; кроме того, железо способствует окислению сернистой кислоты в серную, которая далее нейтрализуется с образованием сернокислого железа. Вода, поступающая на орошение, продувается воздухом также для того, чтобы усилить окисление.
Количество газа, поступающего на очистку, составляет около 1 200000 м3 / час. Газ после каждого котла интенсивно промывается водой в камерах, затем в длинном горизонтальном общем газоходе. Между камерами и газоходом газ проходит через железную насадку. Благодаря железной насадке увеличивается поверхность соприкосновения газа с водой; кроме того, железо способствует окислению сернистой кислоты в серную, которая далее нейтрализуется с образованием сернокислого железа. Вода, поступающая на орошение, продувается воздухом также для того, чтобы усилить окисление.
Формы сернистой кислоты
Для предупреждения окисления ценных компонентов сусла и вина в виноделии применяют сернистую кислоту. Её получают растворением Сернистого ангидрида
(диоксид серы (IV) – SO2) в сусле или вине. Водным раствором (1 – 2 %) диоксида серы пользуются для ополаскивания бутылок и всех поверхностей, соприкасающихся с вином. Как антисептик, как дезинфицирующее средство с давних времен используют также газообразное SO2. Его всегда получали сжиганием серы прямо на месте применения. Им окуривают для уничтожения грибков и других микроорганизмов подвалы, винные бочки и бродильные чаны. SO2 находит применение и для обработки изюма, сабзы, других сушеных фруктов, для отбеливания шерсти и шелка путем сжигания обычной серы. В старое время для обработки новых дубовых бочек использовали сульфитированную воду, которую готовили в специальных серокурках путем сжигания и распыления воды над сернистым газом. Для виноделия SO2 (диоксид серы) готовят в виде сжиженного (сжатого) газа в специальных стальных баллонах.
В продуктах переработки винограда сернистая кислота содержится в двух формах: Свободной и связанной
, каждая из которых имеет свои свойства и значение.
Под термином «Свободная Сернистая кислота
» подразумевают сумму SO2 и всех его производных: H2SO3, HSO3−, SO3−2 – соотношение которых зависит от рН и температуры среды. При этом в растворе обычно обнаруживается следовые количества SO2, 3-5 % недиссоциированной кислоты, 94–96 % анионов HSO2− и до 1 % анионов SO32−.
Антисептическое действие сернистой кислоты против культурных дрожжей вида Saccharomyces vini значительно слабее, чем против других дрожжей и бактерий. Поэтому и сульфитируется свежеотжатое сусло, направляемое на отстаивание. Под влиянием H2SO3 практически вся микрофлора виноградного сусла погибает и его брожение осуществляется на чистой культуре дрожжей.
«Связанные формы сернистой кислоты»
Образуются при её взаимодействии с сахарами, ацетальдегидом, высшими альдегидами, кетокислотами, фенольными и другими веществами. Сумма свободной и связанной сернистой кислоты называется «общей сернистой кислотой»
. Обычно свободные формы составляют 10 – 30 % общего количества сернистой кислоты. Общее и свободное количество H2SO3 определяется йодометрическим титрованием и строго нормируется правилами производства виноградных вин.
Сернистая кислота пока является единственным универсальным средством одновременной избирательной антимикробной и антиоксидантной обработки сусла и вина. Все остальные заменители её неэффективны или вредны для человека.
Диссоциация.
Находясь в водном растворе, S02 образует сернистую кислоту H2SO3, которая диссоциирует с образованием ионов бисульфита и сульфита в различных соотношениях:
3-5% 94-96% до 1%
Наибольшей антимикробной активностью обладает недиссоцийрованная форма сернистой кислоты. Она хорошо подавляет молочнокислые и уксуснокислые бактерии, несколько хуже – дикие и пленчатые дрожжи, слабо действует на плесени. Наиболее устойчивы к H2S03 приученные к ней культурные дрожжи Saccharomyces vini.
Окисление.
Сернистая кислота является сильным восстановителем, необратимо окисляясь растворенным в сусле или вине кислородом:
H2S03+1/2О2 →H2S04.
Образующаяся серная кислота в свободном виде не остается, а вытесняет органические кислоты из их солей и тем самым повышает активную кислотность среды:
H2S04+2KHC4H406 → 2Н2С4Н406+K2S04.
Количество образующихся сульфатов в пересчете на K2SO4 должно быть ограничено 2 г/л.
Подвергаясь окислению, сернистая кислота, таким образом, не дает окисляться другим веществам (ароматическим, красящим): кроме того, она блокирует деятельность окислительных ферментов, смягчает естественные окислительно-восстановительные процессы в сусле и вине. Сульфитация при настаивании мезги мускатных сортов винограда дозами до 100 мг/л гарантирует хорошее экстрагирование эфирных масел и надежную защиту их от окисления.
Взаимодействие сернистой кислоты с ацетальдегидом. Легче всего связывается сернистая кислота с ацетальдегидом, образуя нестойкую, но химически сильную альдегидсернистую кислоту:
В этой реакции 66 мг сернистой кислоты связывают 44 мг ацетальдегида. Это явление особенно нежелательно для бродящего сусла шампанского и столового направления, так как происходит искусственное накопление в виноматериалах ацетальдегида за счет распада альдегидсернистой кислоты при ее окислении:
СН3−С − ОН + 1/2О2→СН3−С + Н2S04
Связывание кислоты в комплексы. Сернистая кислота связывается с сахарами, имеющими альдегидную группу (глюкоза, арабиноза и др.). Это характерно для сусла, полусладких и десертных вин. Скорость связывания H2S03 с сахарами зависит от температуры и рН, а процесс продолжается в среднем 10-20 ч, что вполне достаточно для настаивания мезги и отстаивания сусла, так как связанная сернистая кислота антимикробным действием не обладает.
Сернистая кислота соединяется также с кетокислотами, пектиновыми веществами, аминокислотами. Для красных и розовых вин особенно важно временное, связывание сернистой кислотой антоцианов. При этом окрашенные соединения – антоцианы превращаются в бесцветные антоциан-сернистокислые соединения. Со временем, при нагревании, а также переливках и обработках вин их цвет восстанавливается, сохраняя чистый и яркий первоначальный тон. Это объясняется тем, что при нагревании антоциан-сернистокйслый комплекс распадается, а при переливках и обработках кислород или образующийся ацетальдегид вытесняют антоцианы, связываясь с H2SO3.
Некоторые виды дрожжей способны продуцировать сернистую кислоту на основе сульфатов или элементарной серы, которой опыливают виноград. В йодометрическом титровании могут участвовать природные антиоксиданты типа аскорбиновой кислоты и это может несколько завысить показатель уровня сульфитации сусла и вина.
Источник
