Какие свойства проявляет p2o5
Оксид
фосфора (V) – фосфорный ангидрид
Физические свойства: Оксид фосфора (V) Р2О5 — белый гигроскопичный порошок (поглощает воду),
следует хранить в плотно закрытых сосудах.
Получение: Получается при горении фосфора в избытке воздуха или
кислорода
4P + 5O2 = 2P2O5
Применение:
Оксид фосфора (V) очень
энергично соединяется с водой, а также отнимает воду от других соединений. Применяется
как осушитель газов и жидкостей.
Химические
свойства: Оксид фосфора (V) – это кислотный оксид, взаимодействует, подобно другим
кислотным оксидам с водой, основными оксидами и основаниями.
Фосфорный ангидрид
особым образом взаимодействует с водой, взаимодействуя с водой при обычных условиях (без нагревания),
образует в первую очередь метафосфорную кислоту НРО3:
P2O5 + H2O = HPO3
при нагревании образуется ортофосфорная кислота H3PO4:
P2O5 + 3H2O = 2H3PO4 (t˚C)
При нагревании H3PO4
можно получить пирофосфорнуюкислоту H4P2O7:
2H3PO4 = H2O + H4P2O7 (t˚C)
Ортофосфорная
кислота
Наибольшее
практическое значение имеет ортофосфорная кислота Н3РO4.
Строение
молекулы: В молекуле фосфорной
кислоты атомы водорода соединены с атомами кислорода:

Физические
свойства: Фосфорная кислота
представляет собой бесцветное, гигроскопичное твердое вещество, хорошо
растворимое в воде.
Получение:
1) Взаимодействие
оксида фосфора (V) с водой при нагревании:
P2O5 + 3H2O = 2H3PO4 (t˚C)
2) Взаимодействие
природной соли – ортофосфата кальция с
серной кислотой при нагревании:
Сa3(PO4)2
+ 3H2SO4 = 3CaSO4 + 2H3PO4 (t˚C)
3) При
взаимодействии фосфора с концентрированной азотной кислотой
3P + 5HNO3+
2H2O = 3H3PO4+
5NO
Химические
свойства:
Свойства, общие с другими кислотами | Специфические |
1. Водный раствор кислоты изменяет окраску индикаторов Ортофосфорная кислота диссоциирует H3PO4 H2PO4- ↔ H+ + HPO42- (гидроортофосфат-ион) HPO42- ↔ H+ + PO43- (ортофосфат-ион) 2. Взаимодействует металл+ H3PO4=соль+Н2↑ 3. оксид металла + H3PO4 = соль + Н2О 4. основание + H3PO4 = соль + Н2О если H3PO4(изб) + NaOH = NaH2PO4 + H2O или H3PO4(изб) + 2NaOH = Na2HPO4 + 2H2O 5. H3PO4 H3PO4 H3PO4 + 3NH3 = (NH3)3PO4 6. 2H3PO4+3Na2CO3 = 2Na3PO4 | 1. При 2H3PO4 (t˚C) →H2O + H4P2O7 H4P2O7 (t˚C)→H2O + 2HPO3 2. Качественная реакция на PO43- – фосфат Отличительной реакцией ортофосфорной Н3РО4 3. Играет |
Применение:
В основном для
производства минеральных удобрений.
А также, используется
при пайке, для очищения от ржавчины металлических поверхностей. Также
применяется в составе фреонов, в промышленных морозильных установках как
связующее вещество. Ортофосфорная кислота зарегистрирована в качестве пищевой
добавки E338. Применяется как регулятор кислотности в газированных напитках.
Фосфорные удобрения
Фосфор – элемент важнейшего
органического соединения для любого организма аденозинтрифосфорной кислоты –
АТФ. Эта кислота служит аккумулятором энергии в живой клетке. Фосфор входит в
состав нуклеиновых кислот – ДНК и РНК, а без них невозможно хранение и
воспроизведение генетической информации, содержащейся в клетке. Фосфор
принимает активное участие в восстановлении и и распаде углеводов, оказывая
большое влияние на рост растения, его цветение и плодоношение.
Растения усваивают фосфор из почвы
главным образом в виде фосфат – иона (РО4-3). Как известно,
фосфорная кислота образует три типа солей: орто-, гидро- и дигидрофосфаты. Для
усвоения растением удобрение должно быть растворимо в воде, из средних фосфатов
растворимы только соли щелочных металлов, гидрофосфаты растворимы лучше, зато
дигидрофосфаты растворимы все без исключения.
Однако, и нерастворимая фосфоритная
мука Са3(РО4)2 и труднорастворимый преципитат
СаНРО4 прекрасно усваиваются некоторыми культурами (люпин,
горох, горчица, гречиха…). Дело в том, что корневые волоски этих растений
выделяют органические кислоты, растворяющие неподатливые в воде соли.
Одно из первых фосфорных удобрений
– это простой суперфосфат CaSO4. Ca(H2PO4)2.
Массовая доля оксида фосфора в нем не превышает 20% (это немного), кроме того,
большую часть этого удобрения составляет балласт – сульфат кальция. Однако,
пользоваться им будут еще долго, из-за легкости его получения:
Са3(РО4)2 +
2Н2SO4 =
2Ca SO4 + Ca(H2PO4)2
В другом фосфорном удобрении –
двойном суперфосфате Са(Н2РО4)∙Н2О – в отличие
от простого нет балласта – неусваиваемого растениями гипса. Производство этого
удобрения связано с применением фосфорной кислоты вместо серной, сырьем может
служить как фосфорит (ортофосфат кальция), так и известняк (карбонат кальция):
Са3(РО4)2 +
4Н3РО4+ 3Н2О = 3Са (Н2РО4)2∙Н2О
СаСО3 + 2Н3РО4 =
Са(Н2РО4)2∙Н2О + СО2
На основе фосфорной кислоты также
можно получить еще одно фосфорное удобрение – преципитат СаНРО4,
содержащий 27–42 % фосфорного ангидрида:
2Н3РО4 +
Са(ОН)2 = Са(Н2РО4)2 + 2Н2О
Са(Н2РО4)2+
Са(ОН)2 = 2СаНРО4 + 2Н2О
А если заменить в этих удобрениях
довольно безразличный для растений кальций на ион аммония? Нейтрализацией
фосфорной кислоты газообразным аммиаком получают высокоэффективные удобрения –
аммофосы:
NH3 + H3PO4 =
NH4H2PO4
или
2NH3 + H3PO4 =
(NH4)2HPO4
ТРЕНАЖЁРЫ
Тренажёр №1. “Свойства фосфора и его соединений”
Тренажёр №2. Тестовые задания по теме: “Азот и фосфор, их соединения”
№1. Составьте уравнения реакций оксида фосфора (V) с
1. Na2O
2. NaOH
3. H2O при нагревании
4. H2O без нагревания
Для 2 реакции запишите полное и краткое ионное уравнение.
№2. Составьте молекулярные и ионные уравнения реакций ортофосфорной кислоты с:
1. калием
2. оксидом калия
3. гидроксидом калия
4. сульфитом калия
№3. Осуществите превращения по схеме:
Сa3(PO4)2 -> P -> PH3 -> P2O5 -> H3PO4 -> Ca3(PO4)2
Назовите вещества
№4. Вычислите (в %), какое из фосфорных удобрений: двойной суперфосфат или
преципитат богаче фосфором? Химические формулы удобрений найдите в схеме
самостоятельно.
Источник
Что мы делаем. Каждая страница проходит через несколько сотен совершенствующих техник. Совершенно та же Википедия. Только лучше.
Из Википедии — свободной энциклопедии
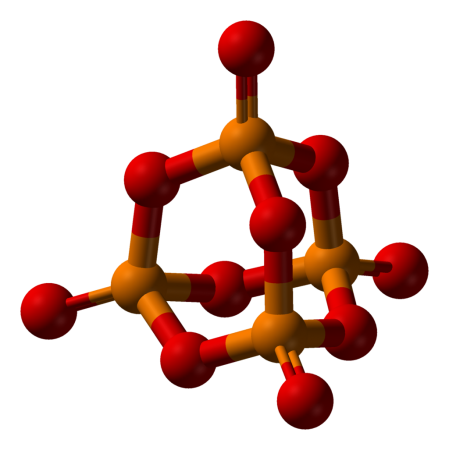
Пентаоксид фосфора, также оксид фосфора(V) (фо́сфорный ангидрид, пятиокись фосфора) — неорганическое химическое соединение класса кислотных оксидов с формулами P4O10 и P2O5.
Строение
Пары оксида фосфора(V) имеют состав P4O10. Твердый оксид склонен к полиморфизму. Существует в аморфном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространств, гр. R3С) и орторомбическая О-форма (а = 0,923 нм, b = 0,718 нм, с = 0,494 нм, пространств, гр. Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространств. гр. Fdd2). Молекулы P4O10 (Н-форма) построены из 4 групп PO4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль ребер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360°С) и активно взаимодействует с водой.
Другие модификации имеют слоистую полимерную структуру из тетраэдров PO4, объединенные в 10-членные (О-форма) и 6-членные (О’-форма) кольца. Эти модификации имеют более высокую температуру возгонки (~580°С) и менее химически активны. H-форма переходит в О-форму при 300—360оC.
Свойства
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
При сильном нагревании распадается на:
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:
Оксид фосфора(V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
Карбоновые кислоты переводит в соответствующие ангидриды:
Оксид фосфора(V) также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с NH3 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
При сплавлении P4O10 с основными оксидами образует различные твёрдые фосфаты, природа которых зависит от условий реакции.
Получение
Оксид фосфора(V) получают сжиганием фосфора в избытке кислорода или воздуха. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Применение
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной кислоты H3PO4 термическим способом.
Широко используется в органическом синтезе в реакциях дегридратации и конденсации.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- Ф. Коттон, Дж. Уилкинсон «Современная неорганическая химия» М.: Мир, 1969
- Зефиров Н.С. и др. т.5 Три-Ятр // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1998. — 783 с. — ISBN 5-85270-310-9.
Источник
| Оксид фосфора | |
|---|---|
 | |
 | |
| Систематическое наименование | Оксид фосфора (V) |
| Хим. формула | P2O5 |
| Состояние | белый порошок |
| Молярная масса | 141,94 г/моль |
| Плотность | 2.39 г/см³ |
| Т. плав. | 420оС(Н-форма),569 (О-форма) |
| Т. кип. | возгоняется при 359 (Н-форма) °C |
| Энтальпия образования | -3010,1 кДж/моль |
| Растворимость в воде | реагирует |
| Рег. номер CAS | [1314-56-3] (P2O5) [16752-60-6] (P4O10) |
| PubChem | 14812 |
| SMILES | O=P12OP3(=O)OP(=O)(O1)OP(=O)(O2)O3 |
| InChI | 1S/O10P4/c1-11-5-12(2)8-13(3,6-11)10-14(4,7-11)9-12 DLYUQMMRRRQYAE-UHFFFAOYSA-N |
| RTECS | TH3945000 |
| ChEBI | 37376 |
| ChemSpider | 14128 и 21428497 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Пентаоксид фосфора, также оксид фосфора (V) (фосфорный ангидрид, пятиокись фосфора) — неорганическое химическое соединение класса кислотных оксидов с формулами P4O10 и P2O5
Строение
Пары оксида фосфора(V) имеют состав P4O10. Твердый оксид склонен к полиморфизму. Существует в аморфном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространств, гр. R3С) и орторомбическая О-форма (а = 0,923 нм, b = 0,718 нм, с = 0,494 нм, пространств, гр. Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространств. гр. Fdd2). Молекулы P4O10 (Н-форма) построены из 4 групп PO4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль ребер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360°С) и активно взаимодействует с водой. Другие модификации имеют слоистую полимерную структуру из тетраэдров PO4, объединенные в 10-членные (О-форма) и 6-членные (О’-форма) кольца. Эти модификации имеют более высокую температуру возгонки (~580°С) и менее химически активны. H-форма переходит в О-форму при 300—360оC.

Свойства
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
P4O10 + 6H2O → 4H3PO4
При сильном нагревании распадается на:
P4O10 → P4O6 + 2O2
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:
4HNO3 + P4O10 → 4HPO3 + 2N2O5 4HClO4 + P4O10 → (HPO3)4 + 2Cl2O7
Оксид фосфора(V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
P4O10 + RCONH2 → P4O9(OH)2 + RCN
Карбоновые кислоты переводит в соответствующие ангидриды:
P4O10 + 12RCOOH → 4H3PO4 + 6(RCO)2O
Оксид фосфора(V) также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с NH3 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
P4O10 + 8PCl3 + O2 → 12POCl3
При сплавлении P4O10 с основными оксидами образует различные твёрдые фосфаты, природа которых зависит от условий реакции.
Получение
Оксид фосфора(V) получают сжиганием фосфора в избытке кислорода или воздуха. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
4P + 5O2 → P4O10
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Применение
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной кислоты H3PO4 термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.
Неорганические соединения фосфора | |
|---|---|
| Оксиды |
|
| Фосфорные кислоты |
|
| Соли |
|
| Соединения фосфония |
|
| Прочее |
|
Источник
I. Оксид фосфора (V) – фосфорный ангидрид
Физические свойства: Оксид фосфора (V) Р2О5 — белый гигроскопичный порошок (поглощает воду), следует хранить в плотно закрытых сосудах.
Применение: Оксид фосфора (V) очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
Химические свойства: Оксид фосфора (V) – это кислотный оксид, взаимодействует, подобно другим кислотным оксидам с водой, основными оксидами и основаниями.
Фосфорный ангидрид особым образом взаимодействует с водой, взаимодействуя с водой при обычных условиях (без нагревания), образует в первую очередь метафосфорную кислоту НРО3:
II. Ортофосфорная кислота
Строение молекулы: В молекуле фосфорной кислоты атомы водорода соединены с атомами кислорода:
Физические свойства: Фосфорная кислота представляет собой бесцветное, гигроскопичное твердое вещество, хорошо растворимое в воде.
1) Взаимодействие оксида фосфора (V) с водой при нагревании:
2) Взаимодействие природной соли – ортофосфата кальция с серной кислотой при нагревании:
3) При взаимодействии фосфора с концентрированной азотной кислотой
В основном для производства минеральных удобрений.
А также, используется при пайке, для очищения от ржавчины металлических поверхностей. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество. Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
III. Минеральные удобрения
Минеральные удобрения — неорганические соединения, содержащие необходимые для растений элементы питания.
В почвах обычно имеются все необходимые растению питательные элементы. Но часто отдельных элементов бывает недостаточно для удовлетворительного роста растений. На песчаных почвах растения нередко испытывают недостаток магния, на торфяных почвах – молибдена, на черноземах – марганца и т. п. Применениеминеральных удобрений – один из основных приемов интенсивного земледелия. С помощью минеральных удобренийможно резко повысить урожаи любых культур на уже освоенных площадях без дополнительных затрат на обработку новых земель. Для внесения минеральных удобрений используются туковые сеялки.
Установлено, что в состав растений входит около 70 элементов. Некоторые из них – макроэлементы – необходимы растениям в больших количествах; другие же – микроэлементы – требуются в незначительных количествах.
1. Макроэлементы – углерод, кислород, водород, азот, фосфор, сера, магний, калий, кальций.
2. Ммкроэлементы – железо, марганец, бор , медь, цинк, молибден, кобальт и др.
Тир важнейших элемента – азот, фосфор и калий – необходимы растениям в больших количествах. Поэтому удобрения, содержащие эти элементы, получают в промышленных масштабах.
При недостатке азота задерживается образование зелёной массы, растения плохо растут, их листья желтеют. Азотные удобрения необходимы растениям в весенний период.
Фосфор необходим при росте и развитии репродуктивных органов растений (цветков, плодов).
Калий ускоряет процесс фотосинтеза и содействует накоплению углеводов (сахара – в сахарной свекле, крахмала в картофеле). У злаковых он способствует укреплению стебля и тем самым устраняет их полегание.
Железо, марганец, бор и другие микроэлементы играют определённую роль в жизни растений. Так, например, при наличии микроэлемента бора растения лучше усваивают азот, фосфор, и калий.Медь, марганец и цинк ускоряют окислительно-восстановительные процессы и тем самым способствуют росту растений. Железо участвует в синтезе хлорофилла.
Растения поглощают макро – и микроэлементы из почвенного раствора в виде ионов (NH4+, NO3-,K+ и других)
Минеральные удобрения содержат питательные вещества в виде различных минеральных солей. В зависимости от того, какие питательные элементы содержатся в них, минеральные удобренияподразделяют на простые и комплексные.
1) Простые минеральные удобрения содержат один какой-либо элемент питания (P,K, N). К ним относятся фосфорные, азотные, калийные и микроудобрения.
2) Комплексные минеральные удобрения содержат одновременно два или более основных питательных элемента.
IV. Тренажеры
V. Закрепление
Задание №1. Составьте уравнения реакций оксида фосфора (V) с
1. Na2O
2. NaOH
3. H2O при нагревании
4. H2O без нагревания
Для 2 реакции запишите полное и краткое ионное уравнение.
Задание №2. Составьте молекулярные и ионные уравнения реакций ортофосфорной кислоты с:
1. калием
2. оксидом калия
3. гидроксидом калия
4. сульфитом калия
Задание №3. Осуществите превращения по схеме:
Сa3(PO4)2 -> P -> PH3 -> P2O5 -> H3PO4 -> Ca3(PO4)2
Назовите вещества
Задание №4. Вычислите (в %), какое из фосфорных удобрений: двойной суперфосфат или преципитат богаче фосфором? Химические формулы удобрений найдите в схеме самостоятельно.
Источник
