Какие свойства проявляет оксид кальция

Оксид кальция – это кристаллическое соединение белого цвета. Другие названия этого вещества – негашеная известь, окись кальция, «кирабит», «кипелка». Оксид кальция, формула которого CaO, и его продукт взаимодействия с (H2O) водой – Ca(OH)2 («пушонка», или гашеная известь) нашли широкое применение в строительном деле.
Как получают оксид кальция?
1. Промышленный способ получения данного вещества заключается в термическом (под воздействием температуры) разложении известняка (кальция карбоната):
CaCO3 (известняк) = CaO (кальция оксид) + CO2 (углекислый газ)
2. Также кальция оксид можно получить посредством взаимодействия простых веществ:
2Ca (кальций) + O2 (кислород) = 2CaO (кальция оксид)
3. Третий способ получения оксида кальция заключается в термическом разложении кальция гидроксида (Ca(OH)2) и кальциевых солей нескольких кислородсодержащих кислот:
2Ca(NO3)2 (нитрат кальция) = 2CaO (получаемое вещество) + 4NO2 (оксид азота) + O2 (кислород)
Физические свойства оксида кальция
1. Внешний вид: кристаллическое соединение белого цвета. Кристаллизуется по типу хлорида натрия (NaCl) в кубической кристаллической гранецентрированной решетке.
2. Молярная масса составляет 55,07 грамм/моль.
3. Плотность равна 3,3 грамм/сантиметр³.
Термические свойства оксида кальция
1. Температура плавления равна 2570 градусов
2. Температура кипения составляет 2850 градусов
3. Молярная теплоёмкость (при стандартных условиях) равна 42.06 Дж/(моль·К)
4. Энтальпия образования (при стандартных условиях) составляет -635 кДж/моль
Химические свойства оксида кальция
Оксид кальция (формула CaO) – это основной оксид. Поэтому он может:
– растворяться в воде (H2O) с выделением энергии. При этом образуется гидроксид кальция. Эта реакция выглядит так:
CaO (оксид кальция) + H2O (вода) = Ca(OH)2 (кальциевый гидроксид) + 63,7 кДж/моль;
– реагировать с кислотами и кислотными оксидами. При этом образуются соли. Вот примеры реакций:
CaO (кальциевый оксид) + SO2 (сернистый ангидрид) = CaSO3 (сульфит кальция)
CaO (кальциевый оксид) + 2HCl (соляная кислота) = CaCl2 (кальциевый хлорид) + H2O (вода).
Применение оксида кальция:
1. Основные объемы рассматриваемого нами вещества используются при производстве силикатного кирпича в строительстве. Раньше негашеную известь использовали в качестве известкового цемента. Его получали при ее смешивании с водой (H2O). В результате оксид кальция переходил в гидроксид, который потом, поглощая из атмосферы углекислый газ (CO2), сильно твердел, превращаясь в кальция карбонат (CaCO3). Несмотря на дешевизну этого метода, в настоящее время цемент известковый практически не применяется в строительстве, так как он обладает способностью хорошо впитывать и накапливать в себе жидкость.
2. В качестве огнеупорного материала оксид кальция подходит как недорогой и доступный материал. Плавленый кальциевый оксид имеет устойчивость к воздействию воды (H2O), что позволило его применять в качестве огнеупора там, где использование дорогостоящих материалов нецелесообразно.
3. В лабораториях используют высший оксид кальция для сушения тех веществ, которые с ним не реагируют.
4. В пищевой отрасли данное вещество зарегистрировано в качестве пищевой добавки под обозначением Е 529. Используется в качестве эмульгатора для создания однородной смеси из несмешиваемых между собой веществ – воды, масла и жира.
5. В промышленности кальциевый оксид используют для удаления сернистого ангидрида (SO2) из дымовых газов. Применяют, как правило, 15% раствор водяной. В результате реакции, в которой взаимодействуют гашеная известь и диоксид серы, получается гипс CaCO4 и CaCO3. При проведении экспериментов ученые добивались показателя в 98% отчистки дыма от диоксида серы.
6. Используется в специальной «самогреющейся» посуде. Емкость с небольшим количеством кальциевого оксида располагается между двух стенок сосуда. При прокалывании капсулы в воде начинается реакция с выделением некоторого количества тепла.
Источник
Негашёная известь – это оксид кальция. Его получают в лабораториях и промышленным путём из природных материалов. Вещество активно используется в строительстве и промышленности.

Физические свойства
Оксид кальция – неорганическое кристаллическое вещество в виде белого или серо-белого порошка без запаха и вкуса. Твёрдое вещество кристаллизуется в кубические гранецентрированные кристаллические решётки по типу хлорида натрия (NaCl).
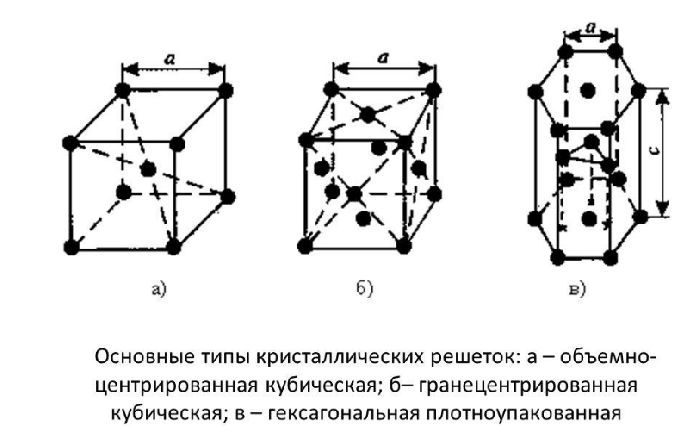
Рис. 1. Кубические гранецентрированные кристаллические решётки.
Общее описание вещества представлено в таблице.
Признак | Значение |
Формула соединения оксид кальция | CaO |
Температура плавления | 2627°C |
Температура кипения | 2850°C |
Растворимость | В глицерине. В этаноле не растворяется, с водой образует гидроксид |
Молярная масса | 56,077 г/моль |
Плотность | 3,37 г/см3 |
Химическая связь в кристалле | Ионная |
Оксид кальция – едкое вещество, относящееся ко второму классу опасности. Агрессивные свойства проявляет при взаимодействии с водой, образуя гашёную известь.

Рис. 2. Порошок оксида кальция.
Получение
Оксид кальция также называют жжёной известью из-за способа получения. Получают негашёную известь путём нагревания и разложения известняка – карбоната кальция (CaCO3).
Это природное вещество, встречающееся в форме минералов – арагонита, ватерита, кальцита. Входит в состав мрамора, мела, известняка.
Реакция получения оксида кальция из известняка выглядит следующим образом:
CaCO3 → CaO + CO2.
Кроме того, негашёную известь можно получить двумя способами:
- из простых веществ, наращивая оксидный слой на металле –
2Ca + O2 → 2CaO;
- при термической обработке гидроксида или солей кальция –
Ca(OH)2 → CaO + H2O; 2Ca(NO3)2 → 2CaO + 4NO2 + O2.
Реакции протекают при высоких температурах. Температура сожжения известняка – 900-1200°C. При 200-300°C на поверхности металла начинает образовываться оксид. Для разложения солей и гидроксида необходима температура в 500-600°C.
Химические свойства
Оксид кальция является высшим оксидом и максимально проявляет окислительные свойства. Соединения взаимодействует с неорганическими веществами и свободными галогенами. Основные химические свойства оксида приведены в таблице.
Реакции | Что образуется | Молекулярное уравнение |
С водой | Образуется гидроксид (гашёная известь). Реакция протекает бурно с выделением тепла | CaO + H2O → Ca(OH)2 |
С кислотами | Растворяется, образуя соли | CaO + 2HCl → CaCl2 +H2O |
С оксидами неметаллов (кислотными остатками) | Образуются соли | CaO + SO2 → CaSO3 |
С углеродом при нагревании | Образуется карбид кальция | CaO + 3С → СаС2 + CO |
С алюминием | Восстанавливает кальций. Образуется оксид алюминия | 3CaO + 2Al → Са + Al2O3 |
Применение
Оксид используется в пищевой промышленности в качестве:
- улучшителя муки и хлеба;
- пищевой добавки Е529;
- регулятора кислотности;
- питательной среды для дрожжей;
- катализатора гидрогенизации (присоединения водорода) жиров.
Кроме того, негашёная известь применяется в химической и строительной промышленности для производства различных веществ:
- масел;
- стеарата кальция;
- солидола;
- огнеупорных материалов;
- гипса;
- высокоглиноземистого цемента;
- силикатного кирпича.

Рис. 3. Цемент, кирпич, гипс получают из оксида кальция.
Что мы узнали?
Оксид кальция или негашёная известь – кристаллическое вещество, бурно реагирующее с водой и образующее гашёную известь. Широко используется в промышленности, в частности пищевой и строительной. Зарегистрирован как пищевая добавка Е529. Имеет высокие температуры плавления и кипения, растворяется только в глицерине. Образуется при сжигании карбоната кальция. Проявляет окислительные свойства, образует соли с оксидами и кислотами, взаимодействует с углеродом и алюминием.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-

Сергей Ефремов
4/10
Оценка доклада
Средняя оценка: 4.7. Всего получено оценок: 81.
Источник
Оксид кальция — неорганическое соединение с  формулой CaO. В литературе также можно встретить такие его названия, как негашеная известь, окись кальция, жженая известь, кирабит, «кипелка».
формулой CaO. В литературе также можно встретить такие его названия, как негашеная известь, окись кальция, жженая известь, кирабит, «кипелка».
Негашеная известь называется так для отличия от гашеной извести, когда при соединении оксида кальция с водой проходит бурная реакция — известь «гасится» водой. Получается гашеная известь Ca(OH)2, востребованная во многих областях.
Жженой известью реактив называют с отсылкой на способ получения: известь (карбонат кальция CaCO3) обжигают до тех пор, пока она не начинает разлагаться, в результате чего получается жженая известь (окись кальция).
Обычно негашеной или жженой известью называют техническую квалификацию реактива.
Получить окись кальция можно разными методами.
• Промышленный способ описан выше: разложением известняка CaCO3 при нагревании.
• Разложением при нагревании гидроокиси кальция или солей кальция (солей определенных кислот, содержащих кислород). Например, разложением нитрита кальция Ca(NO3)2 получают CaO высокой чистоты.
• Прямым окислением (сжиганием) кальция в воздухе.
Свойства
Реагент представляет собой порошкообразное вещество белого или сероватого цвета без запаха. Структура кристаллов подобна структуре поваренной соли. Реактив гигроскопичен, поглощает из воздуха влагу и углекислый газ. Хорошо растворяется в глицерине, не растворяется в этиловом спирте. В воде не растворяется, а вступает с ней в химическую реакцию. Не горит. Токсичен.
С химической точки зрения очень активное соединение, осно́вный оксид. Реагирует с водой с образованием щелочи Ca(OH)2 и выделением большого количества тепла. В реакции с кислотами и кислотными оксидами образует соли. Взаимодействует с углеродом (получается карбид CaC2). Вступает в реакцию с метиловым спиртом, оксидами металлов, с металлами, с хлором, бромом и другими галогенами, углекислым газом, серой, фосфором, кремнием и многими другими веществами.
Меры предосторожности
Негашеная известь — едкое вещество, которое относится ко 2-му (высокоопасному) классу веществ. Особенно опасно смешивать оксид с водой. Во-первых, можно обжечься; во-вторых, образующаяся щелочь разъедает кожу. Но даже без воды оксид действует на кожу как щелочь: вытягивает влагу из кожи, разрушает белки, омыляет жиры, вызывает химический ожог.
Опасность представляют известковая пыль, ее пары и аэрозольные частицы. Они попадают в органы дыхания, вызывая раздражение и кашель. При попадании в легкие могут вызвать пневмонию. Проглатывание оксида кальция вызывает ожог пищевода и желудка.
Очень опасен реактив для слизистых носа и особенно глаз. Способен вызвать язвы слизистой носа и даже прободение носовой перегородки.
Пострадавшему от контакта с химикатом обязательно следует вызвать скорую помощь. До приезда скорой нужно хорошо промыть место поражения: кожу, глаза, пищевод.
При работе с оксидом кальция (как на производствах, так и в быту) следует использовать защитную одежду; респиратор; очки; перчатки, стойкие к щелочам. На предприятиях обязательно контролируют ПДК реактива в воздухе. Рабочее место должно располагаться в помещении с общей принудительной вентиляцией. Места высокого риска пыления дополнительно снабжаются локальной вытяжной вентиляцией.
Хранят реактив в герметичной упаковке  (многослойные ламинированные бумажные мешки), на сухих крытых складах с хорошей механической вентиляцией, при комнатной температуре. Реактив несовместим с водой, фтором, сильными кислотами.
(многослойные ламинированные бумажные мешки), на сухих крытых складах с хорошей механической вентиляцией, при комнатной температуре. Реактив несовместим с водой, фтором, сильными кислотами.
В лабораториях работы следует проводить в вытяжном шкафу. Хранят реактив в герметичных стеклянных или пластиковых сосудах с обязательными предупреждающими этикетками.
Источник
Оксид кальция

Окси́д ка́льция (окись кальция, негашёная и́звесть) — белое кристаллическое вещество, формула CaO.
Негашёная известь и продукт её взаимодействия с водой — Ca(OH)2 (гашёная известь, или «пушонка») находят обширное использование в строительном деле.
Получение[ | ]
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
C a C O 3 → C a O + C O 2 {displaystyle {mathsf {CaCO_{3}
ightarrow CaO+CO_{2}}}}
Также оксид кальция можно получить при взаимодействии простых веществ, на практике в виде корки на металле:
2 C a + O 2 → 2 C a O {displaystyle {mathsf {2Ca+O_{2}
ightarrow 2CaO}}}
или при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
2 C a ( N O 3 ) 2 → 2 C a O + 4 N O 2 + O 2 {displaystyle {mathsf {2Ca(NO_{3})_{2}
ightarrow 2CaO+4NO_{2}+O_{2}}}}
Физические свойства[ | ]
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической кристаллической решётке, по типу хлорида натрия.
Химические свойства[ | ]
Оксид кальция относится к основным оксидам. Энергично взаимодействует с водой с выделением тепла и образованием гидроксида кальция, насыщенный раствор которого является сильным основанием:
C a O + H 2 O → C a ( O H ) 2 {displaystyle {mathsf {CaO+H_{2}O
ightarrow Ca(OH)_{2}}}} + 63,7 кДж/моль.
При температуре выше 580 °C [источник не указан 318 дней] эта реакция обратима.
Как основной оксид реагирует с кислотными оксидами и кислотами, образуя соли:
C a O + S O 2 → C a S O 3 {displaystyle {mathsf {CaO+SO_{2}
ightarrow CaSO_{3}}}} C a O + 2 H C l → C a C l 2 + H 2 O {displaystyle {mathsf {CaO+2HCl
ightarrow CaCl_{2}+H_{2}O}}}
При нагревании с углеродом в высокотемпературной печи или электрической дуге образует карбид кальция (используемый для получения ацетилена):
C a O + 3 C → C a C 2 + C O {displaystyle {mathsf {CaO+3C
ightarrow CaC_{2}+CO}}}
Несмотря на массовое промышленное производство ацетилена более эффективными способами, эта реакция сохраняет небольшое практическое значение, так как карбид кальция является удобным источником ацетилена в лабораторной практике и в аппаратах для сварочных работ.
Применение[ | ]
В настоящее время в основном используются в производстве строительных материалов, высокоглиноземистого цемента, силикатного кирпича и тд.
До второй половины XX века известь широко использовали в качестве строительной побелки — прокаленный мел или известняк (оксид кальция) при смешивании с водой образует ярко-белую гашеную известь (Ca(OH)2), обладающую хорошими адгезионными свойствами к различным поверхностям.
Далее известь медленно поглощает из воздуха углекислый газ, покрываясь коркой карбоната кальция.
В настоящее время известковый цемент при строительстве жилых домов практически не применяется в виду значительной гигроскопичности (склонности поддерживать высокую влажность, провоцирующую рост плесени), уступив место более эффективным материалам.
В лабораторной практике оксид кальция используется как дешевый и эффективный агент для осушения растворителей и жидких веществ.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E-529.
В промышленности водный раствор используют в одном из способов удаления диоксида серы из дымовых газов. В результате реакции гашеной извести Са(OH)2 и диоксида серы получается осадок сульфита кальция СаSO3. В настоящее время вытеснен современными абсорберами на основе четвертичных аммонийных соединений, способных обратимо связывать SO2 и CO2.
Использовался в «саморазогревающейся» посуде. Оксид кальция, помещенный между двух стенок емкости, при прокалывании капсулы с водой реагирует с ней с выделением тепла.
Безопасность[ | ]
Оксид кальция относится к высокотоксическим веществам (Класс опасности 2). Это едкое вещество, особенно опасен при разбавлении водой.
В виде пыли или капель взвеси раздражают слизистые, вызывая чихание и кашель.
Действие CaO, подобно действию щелочи, состоит в омылении жиров, поглощении из кожи влаги, растворении белков, раздражении и прижигании тканей.
Сильно действует на слизистую глаз. На слизистой рта и носа наблюдаются поверхностные изъязвления; иногда прободение носовой перегородки.
Страдают также глубокие дыхательные пути. Вдыхание известковой пыли может вызвать воспаление легких.
Литература[ | ]
Оксид кальция, характеристика, свойства и получение, химические реакции

Оксид кальция – неорганическое вещество, имеет химическую формулу CaO.
Краткая характеристика оксида кальция
Физические свойства оксида кальция
Получение оксида кальция
Химические свойства оксида кальция
Химические реакции оксида кальция
Применение и использование оксида кальция
Краткая характеристика оксида кальция:
Оксид кальция – неорганическое вещество белого или бесцветного цвета.
Так как валентность кальция равна двум, то оксид кальция содержит один атом кислорода и один атом кальция.
Химическая формула оксида кальция CaO.
В воде не растворяется, а вступает в реакцию с ней.
Оксид кальция относится к высокотоксическим веществам. Класс опасности 2. Это едкое вещество, особенно опасен при смешивании с водой.
| Наименование параметра: | Значение: |
| Химическая формула | CaO |
| Синонимы и названия иностранном языке | calcium oxide (англ.)известь негашеная (рус.)кальция окись (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | Бесцветные, белые кубические кристаллы |
| Цвет | бесцветный, белый |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 3370 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 3,37 |
| Температура кипения, °C | 2850 |
| Температура плавления, °C | 2570 |
| Молярная масса, г/моль | 56,077 |
* Примечание:
— нет данных.
Получение оксида кальция:
Оксид кальция получается в результате следующих химических реакций:
- 1. путем термического разложения известняка:
Сa2СО3 → CaО + СО2 (t = 900-1200 oC).
Это промышленный способ получения оксида кальция. Технологически данный процесс в промышленности реализуют в специальных шахтных печах.
- 2. путем сжигания кальция на воздухе:
2Сa + О2 → 2CaО (t = 300 oC).
- 3. путем термического разложения гидроксида кальция:
Сa(OH)2 → СaO + H2О (t = 520-580 oC).
- 4. путем термического разложения нитрата кальция:
2Сa(NO3)2 → 2СaO + 4NO2 + O2 (t = 450-500 oC).
Оксид кальция относится к основным оксидам.
Химические свойства оксида кальция аналогичны свойствам основных оксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида кальция с хлором:
2CaO + 2Cl2 → 2CaCl2 + O2 (t = 700 oC).
В результате реакции образуется хлорид кальция и кислород.
2. реакция оксида кальция с кремнием:
2CaO + 5Si → 2CaSi2 + SiO2 (t = 1300 oC).
В результате реакции образуется силицид кальция и оксид кремния.
3. реакция оксида кальция с углеродом:
CaО + 3С → CaС2 + СО (t = 1900-1950 oC);
2CaO + 5C → 2CaC2 + CO2 (t = 700 oC).
В результате реакции образуется карбид кальция и оксид углерода.
4. реакция оксида кальция с алюминием:
4CaО + 2Al → 2Ca + Ca(AlO2)2 (t = 1200 oC);
2Al + 6CaO → 3CaO•Al2O3 + 3Ca (to);
2Al + 6CaO → Ca3Al2O6 + 3Ca (to).
В результате реакции образуется кальций и соответственно алюминат кальция, оксид алюминия-кальция и алюмината трикальция.
5. реакция оксида кальция с водой:
CaО + Н2О → Ca(ОН)2.
Оксид кальция реагирует с водой, образуя гидроксид кальция. Процесс имеет название «гашение извести». Химическая реакция происходит с выделением энергии (тепла).
6. реакция оксида кальция с оксидом углерода (углекислым газом):
CaО + СО2 → CaСО3.
Оксид кальция реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат кальция.
7. реакция оксида кальция с оксидом серы:
CaО + SО2 → CaSО3;
CaО + SО3 → CaSО4.
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит кальция, во втором случае – сульфат кальция.
8. реакция оксида кальция с оксидом кремния:
CaО + SiО2 → CaSiО3 (t = 1100-1200 oC).
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат кальция.
9. реакция оксида кальция с оксидом фосфора:
CaO + P2O5 → Ca(PO3)2;
3CaO + P2O5 → Ca3(PO4)2 (to);
2CaO + P2O5 → Ca2P2O7.
Оксид фосфора также является кислотным оксидом. В результате реакции образуется соль соответственно: метафосфат кальция, фосфат кальция и дифосфата кальция.
Аналогично проходят реакции оксида кальция и с другими кислотными оксидами.
10. реакция оксида кальция с оксидом алюминия:
CaО + Al2O3 → Ca(AlО2)2 (t = 1200-1300 °C).
Оксид алюминия является амфотерным оксидом. Это значит, что как амфотерный оксид оксид алюминия проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – алюминат кальция.
11. реакция оксида кальция с оксидом марганца:
CaО + MnO2 → CaMnO3 (t°);
Mn2O3 + CaO → CaMn2O4 (t = 900 °C).
Оксид алюминия является амфотерным оксидом. Это значит, что как амфотерный оксид оксид алюминия проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соответственно: соль – манганит кальция либо оксид марганца-кальция.
Аналогично проходят реакции оксида кальция и с другими амфотерными оксидами.
12. реакция оксида кальция с оксидом свинца:
СaО + 2PbO2 → Сa2PbО4 (tо).
В результате реакции образуется соль – плюмбит кальция. Реакция протекает при сплавлении реакционной смеси.
Аналогично проходят реакции оксида кальция и с другими оксидами.
13. реакция оксида кальция с тетраоксидом диазота:
СaО + 2N2О4 → N2O3 + Сa(NO3)2 (t = 250 °C).
Реакция идет в жидком тетраоксиде диазота. В результате реакции образуются оксид азота (III) и соль – нитрат кальция.
14. реакция оксида кальция с плавиковой кислотой:
СaO + 2HF → СaF2 + H2O.
В результате химической реакции получается соль – фторид кальция и вода.
15. реакция оксида кальция с азотной кислотой:
СaO + 2HNO3 → 2Сa(NO3)2 + H2O.
В результате химической реакции получается соль – нитрат кальция и вода.
Аналогично проходят реакции оксида кальция и с другими кислотами.
16. реакция оксида кальция с бромистым водородом (бромоводородом):
СaO + 2HBr → СaBr2 + H2O.
В результате химической реакции получается соль – бромид кальция и вода.
17. реакция оксида кальция с йодоводородом:
СaO + 2HI → СaI2 + H2O.
В результате химической реакции получается соль – йодид кальция и вода.
Применение и использование оксида кальция:
Оксид кальция используется в производстве строительных материалов, в качестве пищевой добавки E-529.
Примечание: © Фото //www.pexels.com, //pixabay.com
карта сайта
оксид кальция реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида кальция
реакции с оксидом кальция
by HyperComments
Оксид и гидроксид кальция. Свойства и применение

Урок посвящен изучению веществ, которые имеют огромное практическое значение в жизни человека, а именно в такой области его жизни, как строительство. Учитель расскажет о способах получения, свойствах и применении оксида и гидроксида кальция.
Тема: Вещества и их превращения
Урок: Оксид и гидроксид кальция. Свойства и применение
1. Способы получения оксида кальция
Еще в древние времена люди заметили, что если обжечь известняк, мел или мрамор, то получится белый порошок с особыми свойствами. Основным компонентом мела, мрамора и известняка является вещество, называемое карбонатом кальция. Его химическая формула – СаСО3. При обжиге известняка протекает реакция, уравнение которой:
СаСО3 = СаО + СО2
Рис. 1. Минералы, основу которых составляет карбонат кальция
Оксид кальция может быть получен и при непосредственном сжигании кальция в атмосфере кислорода:
2Са + О2 = 2СаО
При этом протекает реакция соединения кальция с кислородом с образованием оксида кальция.
2. Исторические названия оксида и гидроксида кальция
Свойства образовавшегося оксида кальция используют в строительстве до сих пор. Оксид кальция – это номенклатурное название соединения СаО. Кроме номенклатурного, это вещество имеет несколько исторически сложившихся названий. Как вы уже знаете, оксид кальция можно получить путем обжига известняка, поэтому одно из его исторических названий – обожженная известь.
Если к полученному оксиду кальция добавить воду, то вода зашипит, как будто он раскален. Поэтому обожженная известь получила название «кипелка». При соприкосновении с водой оксид кальция как бы гасится, отдавая теплоту. Поэтому происходящий процесс назвали гашением, а оксид кальция – негашеной известью.
Образующийся при гашении водяной пар разрыхляет негашеную известь, она как бы обрастает пухом. В связи с этим получающаяся при взаимодействии с водой гашеная известь еще стала называться пушонкой.
3. Свойства оксида кальция
Что же происходит при гашении негашеной извести? Установлено, что одна молекула оксида кальция взаимодействует с одной молекулой воды и образуется только одно новое вещество – гашеная известь. Эта реакция относится к типу соединения.
СаО + Н2О = Са(ОН)2
Формулу гашеной извести принято записывать так: Са(ОН)2. Номенклатурное название данного вещества – гидроксид кальция:
4. Использование оксида и гидроксида кальция в строительстве
Смесь гашеной извести и воды называется известковым раствором, который используется в строительстве. Так как гидроксид кальция мало растворим в воде, известковый раствор содержит в себе осадок гидроксида кальция и собственно раствор (известковую воду).
Использование известкового раствора в строительстве для прочного соединения камней связано с его отвердеванием на воздухе.
Таким образом, весь процесс получения и применения оксида кальция можно представить в виде схемы (Рис.2).
Рис. 2. Получение и применение оксида кальция
При прокаливании карбоната кальция образуется негашеная известь — оксид кальция. При смешении с водой оксид кальция превращается в гашеную известь – гидроксид кальция. Смесь малорастворимого в воде гидроксида кальция и воды называется известковым раствором. При стоянии на воздухе известковый раствор взаимодействует с углекислым газом и превращается снова в карбонат кальция.
Уравнение реакции, соответствующей процессу затвердевания известкового раствора:
Са(ОН)2 + СО2 = СаСО3 + Н2О
Затвердевание известкового раствора происходит потому, что образуется нерастворимое вещество – карбонат кальция.
Список рекомендованной литературы
1. Сборник задач и упражнений по химии: 8-й кл.: к учеб. П. А. Оржековского и др. «Химия. 8 класс» / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с.92-96)
2. Ушакова О. В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с. 84-86)
3. Химия. 8 класс. Учеб. для общеобр. учреждений / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.:Астрель, 2013. (§27)
4. Химия: 8-й класс: учеб. для общеобр. учреждений / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. М.: АСТ: Астрель, 2005. (§33)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Оксид и гидроксид кальция .
2. Неорганическая химия .
Домашнее задание
1) с. 84-86 №№ 1,2,8 из Рабочей тетради по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
2) с.155-156 №№ 2, А1, А2 из учебника П. А. Оржековского, Л. М. Мещеряковой, М. М. Шалашовой «Химия: 8кл.», 2013 г.
Источник
