Какие свойства проявляет оксид as2o5

Мышьяк является неметаллом, образует соединения, подобные по его химическим свойствам. Однако, наряду с неметаллическими свойствами, мышьяк проявляет и металлические. На воздухе при обычных условиях мышьяк слегка окисляется с поверхности. Ни в воде, ни в органических растворителях мышьяк и его аналоги нерастворимы.
Мышьяк химически активен. На воздухе при нормальной температуре даже компактный (плавленый) металлический мышьяк легко окисляется, при нагревании порошкообразный мышьяк воспламеняется и горит голубым пламенем с образованием оксида As2O3. Известен также термически менее устойчивый нелетучий оксид As2O5.
При нагревании (в отсутствие воздуха) As возгоняется (температура возгонки 615оС). Пар состоит из молекул As4 с ничтожной (порядка 0,03%) примесью молекул As2.
Мышьяк относится к группе элементов окислителей-восстановителей. При действии сильных восстановителей он проявляет окислительные свойства. Так, при действии металлов и водорода в момент выделения он способен давать соответствующие металлические и водородистые соединения:
6Ca +As4 = 2Ca3As2
При действии сильных окислителей мышьяк переходит в трех- или пятивалентное состояние. Например, при накаливании на воздухе мышьяк, окисляясь кислородом, сгорает и образует белый дым – оксид мышьяка (III) As2O3:
As4 + 3O2 =2As2O3
Устойчивые формы оксида мышьяка в газовой фазе – сесквиоксид (мышьяковистый ангидрид) As2O3 и его димер As4O6. До 300оС основная форма в газовой фазе – димер, выше этой температуры он заметно диссоциирован, а при температурах выше 1800оС газообразный оксид состоит практически из мономерных молекул As2O3.
Газообразная смесь As4O6 и As2O3 образуется при горении As в кислороде, при окислительном обжиге сульфидных минералов As, например арсенопирита, руд цветных металлов и полимерных руд.
При конденсации пара As2O3 (As4O6) выше 310оС образуется стекловидная форма As2O3. При конденсации пара ниже 310оС образуется бесцветная поликристаллическая кубическая модификация арсенолит. Все формы As2O3 хорошо растворимы в кислотах и щелочах.
Оксид As(V) (мышьяковый ангидрид) As2O5 – бесцветные кристаллы ромбической сингонии. При нагревании As2O5 диссоциирует на As4O6 (газ) и О2. Получают As2O5 обезвоживанием концентрированных растворов H3AsO4 с последующим прокаливанием образующихся гидратов.
Известен оксид As2O4, получаемый спеканием As2O3 и As2O5 при 280оС в присутствии паров воды. Известен также газообразный монооксид AsO, образующийся при электрическом разряде в парах триоксида As при пониженном давлении.
При растворении в воде As2O5 образует существующие только в растворе ортомышьяковистую H3AsO3, или As(OH)3, и метамышьяковистую HAsO2, или AsO(OH), кислоты, обладающие амфотерными, преимущественно кислыми, свойствами.
По отношению к кислотам мышьяк ведет себя следующим образом:
— с соляной кислотой мышьяк не реагирует, но в присутствии кислорода образуется трихлорид мышьяка AsCl3:
4As +3O2 +12HCl = 4AsCl3 +6H2O
— разбавленная азотная кислота при нагревании окисляет мышьяк до ортомышьяковистой кислоты H3AsO3, а концентрированная азотная кислота – до ортомышьякой кислоты H3AsO4:
3As + 5HNO3 + 2H2O = 3H2AsO4 +5NO
Ортомышьяковая кислота (мышьяковая кислота) H3AsO4*0.5H2O – бесцветные кристаллы; температура плавления – 36оС (с разложением); растворима в воде (88% по массе при 20оС); гигроскопична; в водных растворах – трехосновная кислота; при нагревании около 100оС теряет воду, превращаясь в пиромышьяковую кислоту H4As5O7, при более высоких температурах переходит в метамышьяковую кислоту HAsO3. Получают окислением As или As2O3 концентрированной HNO3. Она легкорастворимая в воде и по силе приблизительно равна фосфорной.
Окислительные свойства мышьяковой кислоты заметно проявляются лишь в кислой среде. Мышьяковая кислота способна окислить HI до I2 по обратимым реакциям:
H3AsO4 + 2HI = H3AsO3 + I2 + H2O
Ортомышьяковистая кислота (мышьяковистая кислота) H3AsO3 существует только в водном растворе; слабая кислота; получают растворением As2O3 в воде; промежуточный продукт при получении арсенитов (III) и других соединений.
— концентрированная серная кислота реагирует с мышьяком по следующему уравнению c образованием ортомышьяковистой кислоты:
2As + 3H2SO4 = 2H3AsO3 +3SO2
— растворы щелочей в отсутствие кислорода с мышьяком не реагируют. При кипячении мышьяка со щелочами он окисляется в соли мышьяковистой кислоты H3AsO3. При сплавлении со щелочами образуется арсин (мышьяковистый водород) AsH3 и арсенаты (III). Применяют AsH3
для легирования полупроводниковых материалов мышьяком, для получения As высокой чистоты.
Известны неустойчивые высшие арсины: диарсин As2H4, разлагается уже при -100оС; триарсин As3H5.
Металлический мышьяк легко взаимодействует с галогенами, давая летучие галогениды AsHal3:
As +3Cl2 = 2AsCl3
AsCl3 – бесцветная маслянистая жидкость, дымящаяся на воздухе, при застывании образует кристаллы с перламутровым блеском.
C F2 образует также и AsF5 — пентафторид – бесцветный газ, растворимый в воде и растворах щелочей (с небольшим количеством тепла), в диэтиловом эфире, этаноле и бензоле.
Порошкообразный мышьяк самовоспламеняется в среде F2 и Cl2.
С S, Se и Te мышьяк образует соответствующие халькогениды:
сульфиды — As2S5, As2S3 ( в природе – минерал аурипигмент), As4S4 (минерал реальгар) и As4S3 (минерал диморфит); селениды – As2Se3 и As4Se4; теллурид – As2Te3. Халькогениды мышьяка устойчивы на воздухе, не растворимы в воде, хорошо растворимы в растворах щелочей, при нагревании – в HNO3. Обладают полупроводниковыми свойствами, прозрачны в ИК области спектра.
С большинством металлов дает металлические соединения – арсениды. Галлия арсенид и индия арсенид – важные полупроводниковые соединения.
Известны многочисленные мышьякорганические соединения. Мышьякорганические соединения содержат связь As-C. Иногда к мышьякорганическим соединениям относят все органические соединения, содержащие As, например эфиры мышьяковистой кислоты (RO)3As и мышьяковой кислоты (RO)3AsO. Наиболее многочисленная группа мышьякорганических соединений – производные As с координационным числом 3. К ней относятся органоарсины RnAsH3-n, тетраорганодиарсины R2As-AsR2, циклические и линейные полиарганоарсины (RAs)n, а также органоарсонистые и диарганоарсинистые кислоты и их производные RnAsX3-n (X= OH, SH, Hal, OR’, NR2’ и др.). Большинство мышьякорганических соединений – жидкости, полиорганоарсины и органические кислоты As – твердые вещества, CH3AsH2 и CF3AsH2 – газы. Эти соединения, как правило, растворимы в органических растворителях, ограничено растворимы в воде, в отсутствие кислорода и влаги сравнительно устойчивы. Некоторые тетраорганодиарсины на воздухе воспламеняются.
Источник
В таблице Менделеева такой химический элемент, как мышьяк, занимает позицию на границе металл – неметалл. По своей активности он находится между водородом и медью. Неметаллический характер проявляется в том, что он способен проявлять степень окисления -3 (AsH3 – арсин). Соединения с положительной степенью окисления +3 обладают амфотерными свойствами, а со степенью +5 проявляются его кислотные свойства. Что представляет собой оксид мышьяка?

Оксиды и гидроксиды
Существуют следующие оксиды мышьяка: As2О3 и As2О5. Также есть соответствующие гидроксиды:
- Метамышьяковистая кислота HAsO2.
- Ортомышьяковистая кислота H3AsO3.
- Метамышьяковая кислота HAsO3.
- Ортомышьяковая кислота H3AsO4.
- Пиромышьяковая кислота H4As2O7.

Что такое триоксид мышьяка?
Мышьяк образует два оксида, из которых As2О3 имеет название триоксид. Это вещество, которое часто используется для лечения, но это не совсем безобидный химикат. Это неорганическое соединение, которое является основным источником органоарсенических соединений (соединений, содержащих химическую связь c углеродом) и многих других. Многие применения As2О3 являются спорными из-за токсичной природы элемента. Торговым названием этого соединения является Trisenox.
Общие сведения о триоксиде
Химическая формула триоксида мышьяка имеет следующий вид As2О3. Молекулярная масса этого соединения составляет 197,841 г/моль. Существует много способов получения этого оксида. Одним из них них является обжиг сульфидной руды. Химическая реакция происходит следующим образом:
2As2О3 + 9O2 → 2As2О3 + 6SO2
Большинство оксидов может быть получено в качестве побочного продукта переработки других руд. Арсенопирит является общей примесью в золоте и меди, и он высвобождает триоксид мышьяка при нагревании в присутствии воздуха. Это может привести к серьезному отравлению.

Структура триоксида мышьяка
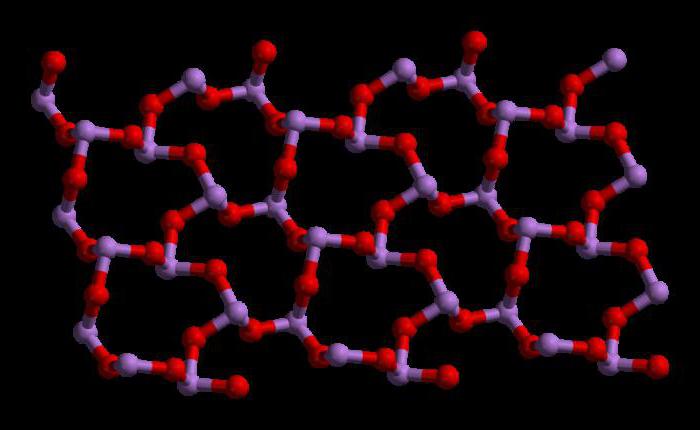
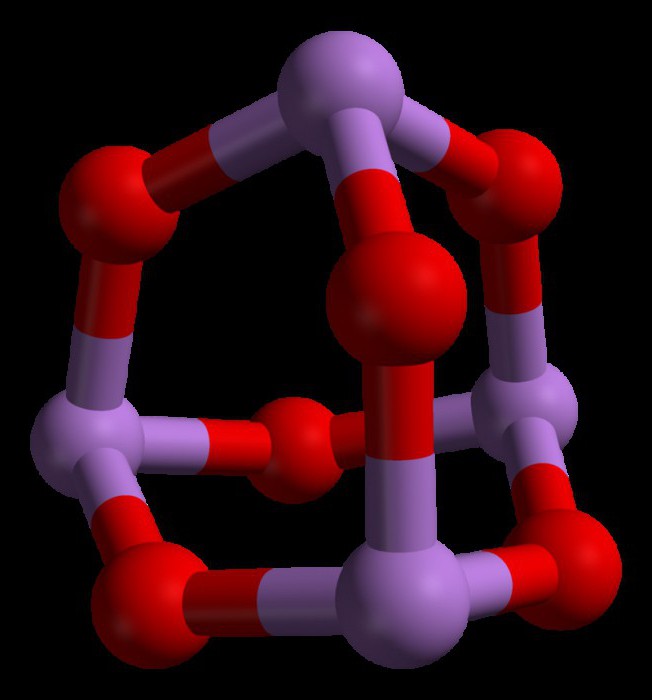
Триоксид мышьяка имеет формулу As4O6 в жидкой и газовой фазах (ниже 800°C). В этих фазах он является изоструктурным с фосфоровым триоксидом (P4O6). Но при температуре выше 800°C As4O6 разрушается до молекулярного As2O3. В этой фазе он является изоструктурным с триоксидом диизотрона (N2O3). В своем твердом состоянии это соединение показывает полиморфную способность (способность существовать в двух или более формах кристаллической структуры).
Свойства триоксида мышьяка
Некоторые из основных свойств триоксида мышьяка заключаются в следующем:
- Растворы триоксида образуют слабые кислоты с водой. Это связано с тем, что соединение представляет собой амфотерный оксид мышьяка.
- Он растворим в щелочных растворах и дает арсенаты.
- Триоксид мышьяка обладает высокой растворимостью в соляной кислоте (HCl) и, наконец, дает трихлорид мышьяка и концентрированную кислоту.
- Он дает пентаоксид (As2O5) в присутствии сильных окислителей, таких как пероксид водорода, озон и азотная кислота.
- Он почти нерастворим в органических растворителях.
- Он выглядит как белое твердое тело в нормальном физическом состоянии.
- Он имеет температуру плавления 312,2°C и температуру кипения 465°C.
- Плотность этого вещества составляет 4,15 г/см3.
Применение триоксида мышьяка в медицине
Это химическое вещество относится к классу противоопухолевых средств и применяется при лечении рака. Токсичность мышьяка хорошо известна. Но триоксид мышьяка является химиотерапевтическим препаратом и используется для лечения определенных видов рака в течение многих лет. Решение, используемое для этой обработки, называется раствором Фаулера. В 1878 году Бостонская городская больница сообщила, что этот раствор может быть эффективным в снижении количества лейкоцитов у человека.
В результате As2O3 был главным образом использован для лечения лейкемии до тех пор, пока его не заменила лучевая терапия. Но после 1930-х годов он постепенно восстановил свою популярность в лечении лейкемии, до тех пор, пока не появилась современная химиотерапия. Этот оксид мышьяка считался лучшим методом лечения хронической миелогенной лейкемии. Даже сегодня это вещество используется для лечения конкретного типа острого промиелоцитарного лейкоза при неудачной ретиноидной или антрациклиновой химиотерапии. Он также используется для лечения хронического миелоидного лейкоза, множественной миеломы, острого миелоидного лейкоза, лимфомы, рака лимфатической системы.

Использование триоксида
Триоксид мышьяка широко используется в производстве бесцветного стекла. Это соединение также полезно в области электроники для создания полупроводников и некоторых сплавов. Он используется и в красках. Триоксид мышьяка может оказаться эффективным средством лечения опухоли головного мозга.
В прошлом это вещество использовалось в стоматологии, но поскольку это высокотоксичное соединение, его применение современными стоматологами было прекращено. Оксид мышьяка (формула As2O3) используется также в качестве консерванта для древесины, но такие материалы запрещены во многих частях мира. В сочетании с ацетатом меди трехокись мышьяка дает яркий пигмент зеленого цвета.
Высокотоксичное вещество
Сам по себе триоксид обладает высоким уровнем токсичности. Поэтому всегда необходимо принять необходимые меры предосторожности, прежде чем его использовать. Он может быть очень опасным в следующих случаях:
- Прием пищи. Если As2O3 случайно попадает в пищеварительный тракт, нужно немедленно обратитесь к врачу. Не рекомендуется пытаться вызвать рвоту, прежде чем обращаться за медицинской помощью. Нужно убрать любую плотную одежду, снять галстук, расстегнуть воротник, пояс и т. д.
- Контакт с кожей. В случае соприкосновения с любой поверхностью тела стоит немедленно промыть пораженный участок большим количеством воды. Зараженная одежды и обувь должны быть немедленно удалены, и их следует вымыть перед повторным использованием. В случае серьезного контакта с кожей вам следует немедленно обратиться за медицинской помощью. Может быть полезно промывание зараженной области дезинфицирующим мылом и применение антибактериального крема.
- Попадание в глаза. Если As2O3 вступает в контакт с глазами, первое, что нужно сделать, это удалить любые контактные линзы и промывать глаза большим количеством воды в течение 15 минут. Рекомендуется использовать холодную воду. Параллельно с этим кто-то должен вызвать скорую.
- Ингаляция. Люди, которые вдыхали этот газ, должны быть помещены в другое место со свежим воздухом. А также нужно немедленно обратиться за медицинской помощью. Если трудно дышать, следует незамедлительно вводить кислород. Если пострадавший не в состоянии дышать самостоятельно, необходимо сделать искусственное дыхание.
- Это соединение может оказывать ядовитое воздействие на человека. В случае попадания в организм чрезмерного его количества триоксид мышьяка может даже привести к смерти. Защитные очки и перчатки всегда должны использоваться во время работы с As2O3. Работа всегда должна выполняться в хорошо проветриваемом помещении.

Побочные эффекты
Общие побочные эффекты этого вещества включают в себя такие симптомы, как:
- плохой аппетит;
- рвота;
- тошнота;
- боль в животе;
- запор;
- головная боль;
- усталость;
- головокружение;
- лихорадка;
- проблемы с дыханием;
- высокий уровень лейкоцитов;
- высокий уровень сахара в крови;
- кожная сыпь.
Менее распространенные побочные эффекты включают в себя:
- сухость во рту;
- сбивчивое дыхание;
- боль в груди;
- низкий уровень лейкоцитов;
- мышечную и костную боль;
- опухание лица и глаз;
- понос;
- тремор;
- низкий уровень сахара в крови;
- низкий уровень кислорода в крови.
Редкие побочные эффекты As2O3:
- нерегулярное сердцебиение (это может даже привести к смерти);
- увеличение веса;
- обморок;
- рассеянность;
- кома;
- распухший живот;
- потемнение кожи.
Опасные для жизни симптомы воздействия триоксида мышьяка – это увеличение веса, лихорадка, сложность дыхания, одышка, грудная боль, кашель.
Триоксид мышьяка является высокотоксичным веществом, которое может даже привести к гибели человека. Тем не менее, он имеет свою полезность в медицинской области. Всегда должны приниматься меры предосторожности.
Химические реакции
Триоксид мышьяка представляет собой амфотерный высший оксид мышьяка, и его водные растворы являются слабокислотными. Таким образом, он легко растворяется в щелочных растворах для получения арсенатов. Он менее растворим в кислотах, за исключением соляной.
Только с сильными окислителями, такими как озон, перекись водорода и азотная кислота, из него образуется пента-оксид мышьяка с +5 степенью кислотности As2O5. Что касается устойчивости к окислению, триоксид мышьяка отличается от триоксида фосфора, который легко сгорает до пятиокиси фосфора. Редукция дает элементный мышьяк или арсин (AsH3).

Пентаоксид мышьяка
Химической формулой пентаоксида является As2O5. Его молярная масса составляет 229,8402 г/моль. Это белый гигроскопичный порошок с плотностью 4,32 г/см3. Температура плавления достигает 315°C, при которой он начинает разлагаться. Вещество имеет хорошую растворимость в воде и спирте. Свойства оксида мышьяка делают его очень токсичным и опасным для окружающей среды. Это неорганическое соединение, которое является менее распространенным, высокотоксичными и, следовательно, находит лишь ограниченное коммерческое применение, в отличие от высшего оксида мышьяка (формула As2O3).
Мышьяк известен в первую очередь как яд и канцероген. Его триоксид – это водорастворимый порошок, который производит бесцветный, безвкусный и без запаха раствор. Это был популярный способ убийства в средние века. Его использование продолжается и сегодня, но уже в мирных целях и в небольшом количестве.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 февраля 2020;
проверки требует 1 правка.
Оксид мышьяка(III) — неорганическое соединение с химической формулой As2O3, являющееся ценным химическим сырьём для получения других производных мышьяка, в том числе мышьяксодержащих органических соединений. Валовой объём производства в мире — 50 000 тонн в год[1]. Однако безопасность применения во многих областях подвергается сомнению из-за чрезвычайно высокой токсичности данного вещества.
Получение и свойства[править | править код]
Оксид мышьяка(III) может быть получен многими способами, включая окисление (горение) мышьяка и его производных на воздухе. Показательна реакция разложения аурипигмента, сульфида мышьяка:
Большая часть, однако, является побочным продуктом других производств — золотодобычи и получения меди, где он выделяется при прокаливании на воздухе, что приводило к многочисленным массовым отравлениям[2]. В настоящее время интенсивная добыча мышьяковых руд ведётся только в Китае[1].
Оксид мышьяка(III) является амфотерным оксидом, его раствор обладает слабокислой реакцией. В щелочных растворах образует арсениты, в концентрированной соляной кислоте даёт хлорид мышьяка(III).
Только сильнейшие окислители — озон, пероксид водорода, азотная кислота — способны превратить его в оксид мышьяка(V) As2O5 или — при понижении концентрации — арсин (AsH3) в зависимости от условий реакции.
Структура[править | править код]
В жидком и газообразном (до 800 °C) состояниях имеет формулу As4O6 (в форме димера) и изоструктурен P4O6). При нагреве свыше 800 °C As4O6 распадается на молекулы As2O3, схожий по строению с N2O3. В твёрдом состоянии сосуществуют три полиморфных формы: кубический молекулярный As4O6 и две полимерные формы. Полимеры, образующие при остывании монокристаллы, напоминают пирамидальную структуру AsO3 с общими атомами кислорода.[3]
Использование[править | править код]
Оксид мышьяка(III) используется для изготовления цветного стекла, также применяется в лесохимии и электротехнике полупроводников[1], получения чистого мышьяка и его соединений, таких как какодилат натрия и арсенид натрия.
В соединении с ацетатом меди(II)[1] триоксид образует красящее вещество — парижскую зелень, ныне из-за чрезвычайной токсичности неиспользуемую.
Применение в медицине[править | править код]
Используется с древнейших времён в китайской медицине[4], а также (с XIX века) в гомеопатии. В конвенциональной медицине триоксид мышьяка используется для лечения злокачественных опухолей, таких как лейкемия, однако ввиду высоких рисков его применения предпочтение отдаётся другим препаратам[5][6][7].
Также триоксид успешно лечит аутоиммунные заболевания[8], взаимодействует с ферментом тиоредоксиновая редуктаза[9].
Обнаружение в природе[править | править код]
As2O3 содержится в арсенолите и клаудетите.
Токсикология[править | править код]
Оксид мышьяка (III) очень ядовит. Токсичность триоксида стала легендарной и широко описана в литературе[10][11][11][12].
В Австрии жили «мышьякоеды», получавшие дозы во много раз больше смертельной без особого вреда для здоровья. Считается, что мышьяк повышает работоспособность, особенно при работе на больших высотах[13][14][15].
ПДК для неорганических соединений мышьяка, включая As2O3, составляет 0.010 мг/м³.
Полулетальная доза — 19,1 мг/кг.[источник не указан 1526 дней]
Примечания[править | править код]
- ↑ 1 2 3 4 Sabina C. Grund, Kunibert Hanusch, Hans Uwe Wolf «Arsenic and Arsenic Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry, VCH-Wiley, 2008, Weinheim. (англ.)
- ↑ Giant Mine – Northwest Territories Region – Indian and Northern Affairs Canada (недоступная ссылка). Дата обращения 28 августа 2007. Архивировано 2 апреля 2012 года. (англ.)
- ↑ Holleman, A. F.; Wiberg, E. «Inorganic Chemistry» Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Marcel Gielen, Edward R. T. Tiekink. Metallotherapeutic Drugs and Metal-Based Diagnostic Agents (англ.). — Wiley, 2005. — P. 298.
- ↑ Steven L. Soignet et al. United States Multicenter Study of Arsenic Trioxide in Relapsed Acute Promyelocytic Leukemia (англ.) // Journal of Clinical Oncology (англ.)русск. : journal. — 2001. — Vol. 19, no. 18. — P. 3852—3860.
- ↑ Antman, K. H. Introduction: The history of arsenic trioxide in cancer therapy (англ.) // Oncologist : journal. — 2001. — Vol. 6(Suppl. 2), no. 1—2. — P. 2006.
- ↑ Jun Zhu, Zhu Chen,Valérie Lallemand-Breitenbach, Hugues de Thé “How Acute Promyelocytic Leukaemia Revived Arsenic, ” Nature Reviews Cancer 2002, volume 2, 1-9.
- ↑ Bobé Pierre, Bonardelle Danielle, Benihoud Karim, Opolon Paule, Chelbi-Alix Mounira. Arsenic trioxide: A promising novel therapeutic agent for lymphoproliferative and autoimmune syndromes in MRL/lpr mice (англ.) // Blood (англ.)русск. : journal. — American Society of Hematology (англ.)русск., 2006. — Vol. 108, no. 13. — P. 3967—3975..
- ↑ Lu J., Chew E. H., Holmgren A. Targeting thioredoxin reductase is a basis for cancer therapy by arsenic trioxide (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2007. — Vol. 104, no. 30. — P. 12288—12293. — doi:10.1073/pnas.0701549104. — PMID 17640917.
- ↑ Stanton v Benzler 9716830. U.S. 9th Circuit Court of Appeals (17 июня 1998). — «(…) convicted by a jury of first degree murder for poisoning her ex-husband. Her ex-husband’s body was found with traces of arsenic trioxide in it.». Дата обращения 9 июня 2008. Архивировано 2 апреля 2012 года.
- ↑ 1 2 Emsley, John. Arsenic // The Elements of Murder: A History of Poison (англ.). — Oxford University Press, 2006. — P. 93 —197. — ISBN 9780192806000.
- ↑ Madame Bovary by Flaubert
- ↑ Arsenic Eaters — New York Times July 26, 1885
- ↑ Richard M. Allesch. Arsenik. Seine Geschichte in Österreich. 54. Band. Klagenfurt: Kleinmayr 1959.
- ↑ G. Przygoda, J. Feldmann, W. R. Cullen. The arsenic eaters of Styria: a different picture of people who were chronically exposed to arsenic (англ.) // Applied Organometallic Chemistry (англ.)русск. : journal. — 2001. — Vol. 15, no. 6. — P. 457—462. — doi:10.1002/aoc.126.
Ссылки[править | править код]
На английском языке
- Solubility of As2O3 in water as function of temperature
- Case Studies in Environmental Medicine: Arsenic Toxicity
- IARC Monograph — Arsenic and Arsenic Compounds
- International Chemical Safety Card 0378
- NIOSH Pocket Guide to Chemical Hazards
- NTP Report on Carcinogens — Inorganic Arsenic Compounds
- Use of Arsenic Trioxide in Multiple Myeloma Treatment
- The use of Arsenic trioxide in medicine.
- Institute of Chemistry Austria, speciallised on arsenic and various arsenic compounds
Источник
