Какие свойства проявляет метан основные или кислотные

| Метан | |
|---|---|
| Систематическое наименование | метан |
| Традиционные названия | метан, рудничный газ |
| Хим. формула | CH4 |
| Рац. формула | CH4 |
| Молярная масса | 16,04 г/моль |
| Плотность | газ (0 °C) 0,7168 кг/м³; 0,6682 кг/м³ в стандартных условиях по ГОСТ 2939—63; жидкость (−164,6 °C) 415 кг/м³[1] |
| Температура | |
| • плавления | -182,49 °C |
| • кипения | -161,58 °C |
| • самовоспламенения | 537,8 °C |
| Пределы взрываемости | 4,4-17,0 % |
| Энтальпия | |
| • образования | −74 520 Дж/моль[2] |
| • сгорания | −890,3 кДж/моль[3] |
| Удельная теплота испарения | 460,6 Дж/моль (при 760 мм. рт. ст.)[4] |
| Растворимость | |
| • в воде | 0,02 г/кг[5] |
| Рег. номер CAS | 74-82-8 |
| PubChem | 297 |
| Рег. номер EINECS | 200-812-7 |
| SMILES | C |
| InChI | InChI=1S/CH4/h1H4 VNWKTOKETHGBQD-UHFFFAOYSA-N |
| RTECS | PA1490000 |
| ChEBI | 16183 |
| Номер ООН | 1971 |
| ChemSpider | 291 |
| Предельная концентрация | 7000 мг/м³ |
| ЛД50 | 13450-36780 мг/кг |
| Токсичность | Класс опасности IV |
| Пиктограммы ECB | |
| NFPA 704 | 4 2 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
У этого термина существуют и другие значения, см. Метан (значения).
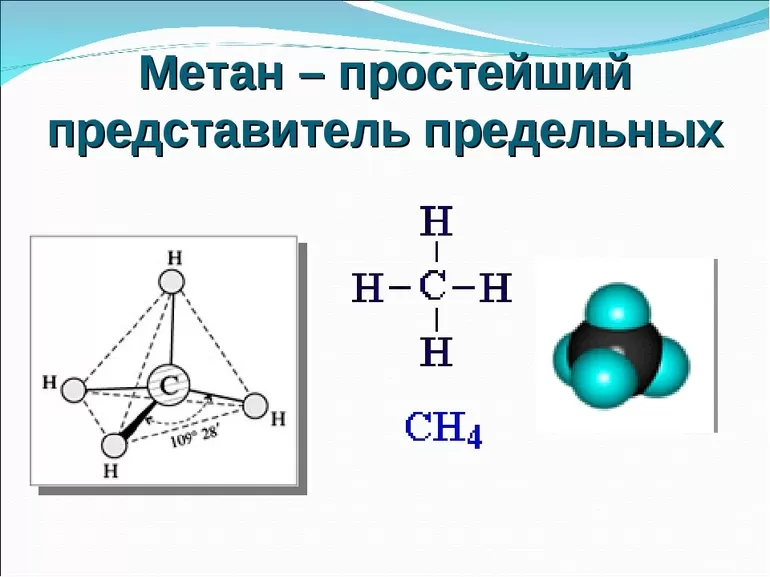
Мета́н (лат. methanum; болотный газ), CH4 — простейший по составу предельный углеводород, при нормальных условиях бесцветный газ без вкуса и запаха[6].
Малорастворим в воде, почти в два раза легче воздуха.
Метан нетоксичен, но при высокой концентрации в воздухе обладает слабым наркотическим действием (ПДК 7000 мг/м3)[7]. Имеются данные, что метан при хроническом воздействии малых концентраций в воздухе неблагоприятно влияет на центральную нервную систему[8]. Наркотическое действие метана CH4 ослабляется его малой растворимостью в воде и крови и химической инертностью. Класс токсичности — четвёртый[9].
При использовании в быту в метан (природный газ) обычно добавляют одоранты (обычно тиолы) — летучие вещества со специфическим «запахом газа», чтобы человек вовремя заметил аварийную утечку газа по запаху. На промышленных производствах утечки фиксируют датчики и во многих случаях метан для лабораторий и промышленных производств поставляется без добавления одорантов.
Накапливаясь в закрытом помещении в смеси с воздухом метан становится взрывоопасен при концентрации его от 4,4 % до 17 %[10]. Наиболее взрывоопасная концентрация в смеси с воздухом 9,5 об.%.
Метан — третий по значимости парниковый газ в атмосфере Земли (после водяного пара и углекислого газа, его вклад в парниковый эффект оценивается 4—9 %)[11][12].
История[править | править код]
В ноябре 1776 года итальянский физик Алессандро Вольта обнаружил метан в болотах озера Лаго-Маджоре на границе Италии и Швейцарии. На изучение болотного газа его вдохновила статья Бенджамина Франклина о «горючем воздухе». Вольта собирал газ, выделяемый со дна болота, и в 1778 году выделил чистый метан. Также он продемонстрировал зажигание газа от электрической искры.
Сэр Гемфри Дэви в 1813 г. изучал рудничный газ и показал, что он является смесью метана с небольшими количествами азота N2 и углекислого газа CO2 — то есть, что он качественно тождествен по составу болотному газу.
Современное название «метан» в 1866 г. газу дал немецкий химик Август Вильгельм фон Гофман[13][14], оно образовано от слова «метанол».
Нахождение в природе[править | править код]
Основной компонент природного газа (77—99 %), попутных нефтяных газов (31—90 %), рудничного и болотного газов (отсюда произошли другие названия метана — болотный или рудничный газ). В анаэробных условиях (в болотах, переувлажнённых почвах, кишечнике жвачных животных) образуется биогенно в результате жизнедеятельности некоторых микроорганизмов.
Большие запасы метана сосредоточены в метаногидратах на дне морей и в зоне вечной мерзлоты[11][12].
Метан также был обнаружен на других планетах, включая Марс, что имеет значение для исследований в области астробиологии[15]. По современным данным, в атмосферах планет-гигантов солнечной системы в заметных концентрациях содержится метан[16].
Предположительно, на поверхности Титана в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано-этановой смеси[17]. Велика доля метановых льдов и на поверхности Седны.
В промышленности[править | править код]
Образуется при коксовании каменного угля, гидрировании угля, гидрогенолизе углеводородов в реакциях каталитического риформинга.
Классификация по происхождению[править | править код]
- абиогенный — образован в результате химических реакций неорганических соединений, например, при взаимодействии карбидов металлов с водой;
- биогенный — образован как результат химических превращений органических веществ;
- бактериальный (микробный) — образован в результате жизнедеятельности бактерий (микроорганизмов);
- термогенный — образован в ходе термохимических процессов.
Получение[править | править код]
В лаборатории получают нагреванием натронной извести (смесь гидроксидов натрия и кальция) или безводного гидроксида натрия с ледяной уксусной кислотой.
Для этой реакции важно отсутствие воды, поэтому и используется гидроксид натрия, так как он менее гигроскопичен.
Возможно получение метана сплавлением ацетата натрия с гидроксидом натрия[18]:
Также для лабораторного получения метана используют гидролиз карбида алюминия или некоторых металлорганических соединений (например, метилмагнийбромида).
Также возможно биологическое получение метана, см. Биогаз.
Химические свойства[править | править код]
Метан — первый член гомологического ряда насыщенных углеводородов (алканов), наиболее устойчив к химическим воздействиям. Подобно другим алканам вступает в реакции радикального замещения — галогенирования, сульфохлорирования, сульфоокисления, нитрования и других, но обладает меньшей реакционной способностью по сравнению с другими алканами.
Для метана специфична реакция с парами воды, в которой в промышленности применяется в качестве катализатора никель, нанесённый на оксиде алюминия (Ni/Al2O3) при 800—900 °C или без катализатора при 1400—1600 °C. Образующийся в результате реакции синтез-газ может быть использован для последующих синтезов метанола, углеводородов, уксусной кислоты, ацетальдегида и других продуктов.
Горит в воздухе голубоватым пламенем, при этом выделяется энергия около 33,066 МДж на 1 м³, взятый при нормальных условиях. Реакция горения метана в кислороде или воздухе:
.
При комнатной температуре и стандартном давлении метан является бесцветным газом без запаха[19]. Знакомый запах природного газа, который используется дома, обычно достигается добавлением смеси одоранта, содержащей трет-бутилтиол, в качестве меры безопасности. Метан имеет температуру кипения −164 ° C при давлении в одну атмосферу[20]. Как газ, он легко воспламеняется при объёмных концентрациях в воздухе от 4,4 % до 17 % при стандартном давлении.
Твёрдый метан существует в нескольких модификациях. В настоящее время известно девять[21].
Вступает с галогенами в реакции замещения, которые проходят по свободно-радикальному механизму:
,
,
,
.
Выше 1400 °C разлагается по реакции:
.
Окисляется до муравьиной кислоты при 150—200 °C и давлении 30—90 атм. по цепному радикальному механизму:
.
Соединения включения[править | править код]
Метан образует соединения включения — газовые гидраты, широко распространённые в природе.
Применение метана[править | править код]
Метан используется в качестве топлива для печей, водонагревателей, автомобилей[22][23], турбин и др. Для хранения метана может использоваться активированный уголь.
Как основной компонент природного газа, метан важен для производства электроэнергии, сжигая его в качестве топлива в газовой турбине или парогенераторе. По сравнению с другими видами углеводородного топлива метан производит меньше углекислого газа на каждую единицу выделенного тепла. При температуре около 891 кДж/моль теплота сгорания метана ниже, чем у любого другого углеводорода. Тем не менее, он производит больше тепла на массу (55,7 кДж/г), чем любая другая органическая молекула из-за его относительно большого содержания водорода, что составляет 55 % теплоты сгорания[24], но отдаёт только 25 % молекулярной массы метана. Во многих городах метан подаётся в дома для отопления и приготовления пищи. В этом контексте его обычно называют природным газом, содержание энергии в котором составляет 39 мегаджоулей на кубический метр. Сжиженный природный газ (СПГ) представляет собой преимущественно метан (CH4), превращаемый в жидкую форму для удобства хранения или транспортировки.
Рафинированный жидкий метан, в сочетании с жидким кислородом, рассматривается в качестве перспективного ракетного топлива[25][26] и используется в таких двигателях, как РД-0162, BE-4[27] и Raptor. Метан имеет преимущества перед керосином в том, что он:
- даёт бо́льший удельный импульс[28];
- оставляет меньше продуктов сгорания на внутренних частях ракетных двигателей[27];
- позволяет легче освободить полости двигателя от остатков топлива[29].
Это уменьшает сложность повторного использования ракет[27][30].
Метан используется в качестве сырья в органическом синтезе, в том числе для изготовления метанола.
Физиологическое действие[править | править код]
Метан является самым физиологически безвредным газом в гомологическом ряду парафиновых углеводородов. Физиологическое действие метан не оказывает и не ядовит (из-за малой растворимости метана в воде и плазме крови и присущей парафинам химической инертности). Погибнуть человеку в воздухе с высокой концентрацией метана можно только от недостатка кислорода в воздухе. Так, при содержании в воздухе 25—30 % метана появляются первые признаки удушья (учащение пульса, увеличение объёма дыхания, нарушение координации тонких мышечных движений и т. д.). Более высокие концентрации метана в воздухе вызывают у человека кислородное голодание — головную боль, одышку, — симптомы, характерные для горной болезни.
Так как метан легче воздуха, он не скапливается в проветриваемых подземных сооружениях. Поэтому случаи гибели людей от удушья при вдыхания смеси метана с воздухом весьма редки.
Первая помощь при тяжёлом удушье: удаление пострадавшего из вредной атмосферы. При отсутствии дыхания немедленно (до прихода врача) искусственное дыхание изо рта в рот. При отсутствии пульса — непрямой массаж сердца.
Хроническое действие метана[править | править код]
У людей, работающих в шахтах или на производствах, где в воздухе присутствуют в незначительных количествах метан и другие газообразные парафиновые углеводороды, описаны заметные сдвиги со стороны вегетативной нервной системы (положительный глазосердечный рефлекс, резко выраженная атропиновая проба, гипотония) из-за очень слабого наркотического действия этих веществ, сходного с наркотическим действием диэтилового эфира.
ПДК метана в воздухе рабочей зоны составляет 7000 мг/м³[7].
Биологическая роль[править | править код]
Показано, что эндогенный метан способен вырабатываться не только метаногенной микрофлорой кишечника, но и клетками эукариот, и что его образование значительно возрастает при экспериментальном вызывании клеточной гипоксии, например, при нарушении работы митохондрий при помощи отравления организма экспериментального животного азидом натрия, известным митохондриальным ядом. Высказывается предположение, что образование метана клетками эукариот, в частности животных, может быть внутриклеточным или межклеточным сигналом испытываемой клетками гипоксии[31].
Также показано увеличение образования метана клетками животных и растений под влиянием различных стрессовых факторов, например, бактериальной эндотоксемии или её имитации введением бактериального липополисахарида, хотя, возможно, этот эффект наблюдается не у всех видов животных (в эксперименте исследователи получили его у мышей, но не получили у крыс)[32]. Возможно, что образование метана клетками животных в подобных стрессовых условиях играет роль одного из стрессовых сигналов.
Предполагается также, что метан, выделяемый кишечной микрофлорой человека и не усваиваемый организмом человека (он не метаболизируется и частично удаляется вместе с кишечными газами, частично всасывается и удаляется при дыхании через лёгкие), не является «нейтральным» побочным продуктом метаболизма бактерий, а принимает участие в регуляции перистальтики кишечника, а его избыток может вызывать не только вздутие живота, отрыжку, повышенное газообразование и боли в животе, но и функциональные запоры[33].
Метан и экология[править | править код]
Спектр поглощения метана в ближней и средней ИК-областях. По вертикальной оси отложено сечение поглощения на 1 молекулу[34].
Является парниковым газом, более сильным в этом отношении, чем углекислый газ, из-за наличия глубоких колебательно-вращательных полос поглощения его молекул в инфракрасном спектре. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность того же молярного объёма метана составит 21—25 единиц[35][36].
С 1750 года концентрация метана в атмосфере Земли увеличилась примерно на 150 %, и на её долю приходится 20 % от общего радиационного воздействия всех долгоживущих и глобально смешанных парниковых газов[37].
Примечания[править | править код]
- ↑ Справочник химика / Редкол.: Никольский Б. П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- ↑ Smith J. M., H.C. Van Ness, M.M. Abbott Introduction to Chemical Engineering Thermodynamics (англ.) // J. Chem. Educ. — American Chemical Society, 1950. — Vol. 27, Iss. 10. — P. 789. — ISSN 0021-9584; 1938-1328 — doi:10.1021/ED027P584.3
- ↑ https://sites.google.com/site/ellesmerealevelchemistry/module-3-periodic-table-energy/3-2-physical-chemistry-1/3-2-1-enthalpy-changes/3-2-1-d-enthalpy-change-definitions
- ↑ Физико-химические свойства индивидуальных углеводородов. Справочник. (рус.) / Под ред. М. Д. Таличева. — Выпуск 4-й. — М.-Л.: ГОСУДАРСТВЕННОЕ НАУЧНО-ТЕХНИЧЕСКОЕ ИЗДАТЕЛЬСТВО НЕФТЯНОЙ И ГОРНО-ТОПЛИВНОЙ ЛИТЕРАТУРЫ, 1953.
- ↑ Обзор: Растворимость некоторых газов в воде
- ↑ [www.xumuk.ru/encyklopedia/2551.html Статья «Метан» на сайте «Химик»]
- ↑ 1 2 Гигиенические нормативы ГН 2.2.5.1313-03 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны»
- ↑ Куценко С. А. Основы токсикологии / С. А. Куценко. — СПб.: Фолиант, 2004.
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, н-бутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (Утв. главным государственным санитарным врачом РФ 30.03.2003) (недоступная ссылка)
- ↑ ГОСТ Р 52136-2003
- ↑ 1 2 Наталья Ржевская Тепло мерзлоты // В мире науки. — 2016. — № 12. — С. 67—73.
- ↑ 1 2 Леонид Юрганов. Метан над Арктикой (рус.) // Наука и жизнь. — 2017. — № 11. — С. 24.
- ↑ A. W. Hofmann (1866) “On the action of trichloride of phosphorus on the salts of the aromatic monoamines, ” Proceedings of the Royal Society of London, 15 : 55—62; see footnote on pp. 57—58.
- ↑ James Michael McBride (1999) «Development of systematic names for the simple alkanes». Available online at Chemistry Department, Yale University (New Haven, Connecticut). Архивная копия от 16 марта 2012 на Wayback Machine
- ↑ Etiope, Giuseppe; Lollar, Barbara Sherwood. Abiotic Methane on Earth (англ.) // Reviews of Geophysics (англ.)русск. : journal. — 2013. — Vol. 51, no. 2. — P. 276—299. — ISSN 1944-9208. — doi:10.1002/rog.20011. — Bibcode: 2013RvGeo..51..276E.
- ↑ Atreya, S.K.; Mahaffy, P.R.; Niemann, H.B. et al. Composition and origin of the atmosphere of Jupiter—an update, and implications for the extrasolar giant planets (англ.) // Planetary and Space Sciences : journal. — 2003. — Vol. 51. — P. 105—112. — doi:10.1016/S0032-0633(02)00144-7.
- ↑ Tidal effects of disconnected hydrocarbon seas on Titan
- ↑ Б. А. Павлов, А. П. Терентьев. Курс органической химии. — Издание шестое, стереотипное. — M.: Химия, 1967. — С. 58.
- ↑ Hensher, David A.; Button, Kenneth J. Handbook of transport and the environment (англ.). — Emerald Group Publishing (англ.)русск., 2003. — P. 168. — ISBN 978-0-08-044103-0.
- ↑ Methane Phase change data // NIST Chemistry Webbook.
- ↑ Bini, R.; Pratesi, G. High-pressure infrared study of solid methane: Phase diagram up to 30 GPa (англ.) // Physical Review B : journal. — 1997. — Vol. 55, no. 22. — P. 14800—14809. — doi:10.1103/physrevb.55.14800. — Bibcode: 1997PhRvB..5514800B.
- ↑
Lumber Company Locates Kilns at Landfill to Use Methane – Energy Manager Today (англ.). Energy Manager Today. Дата обращения: 11 марта 2016. - ↑
Cornell, Clayton B.. Natural Gas Cars: CNG Fuel Almost Free in Some Parts of the Country (англ.) (29 April 2008). Архивировано 20 января 2019 года. «Compressed natural gas is touted as the ‘cleanest burning’ alternative fuel available, since the simplicity of the methane molecule reduces tailpipe emissions of different pollutants by 35 to 97%. Not quite as dramatic is the reduction in net greenhouse-gas emissions, which is about the same as corn-grain ethanol at about a 20% reduction over gasoline». - ↑
Schmidt-Rohr, Klaus. Why Combustions Are Always Exothermic, Yielding About 418 kJ per Mole of O2 (англ.) // Journal of Chemical Education (англ.)русск. : journal. — 2015. — Vol. 92, no. 12. — P. 2094—2099. — doi:10.1021/acs.jchemed.5b00333. — Bibcode: 2015JChEd..92.2094S. - ↑
Thunnissen, Daniel P.; Guernsey, C. S.; Baker, R. S.; Miyake, R. N. Advanced Space Storable Propellants for Outer Planet Exploration (англ.) // Американский институт аэронавтики и астронавтики[en] : journal. — 2004. — No. 4—0799. — P. 28. - ↑
Чеберко, Иван В России предлагают создать «метановую ракету». Известия (16 мая 2014). Дата обращения: 18 июля 2020. - ↑ 1 2 3
Blue Origin BE-4 Engine (англ.). — «We chose LNG because it is highly efficient, low cost and widely available. Unlike kerosene, LNG can be used to self-pressurize its tank. Known as autogenous repressurization, this eliminates the need for costly and complex systems that draw on Earth’s scarce helium reserves. LNG also possesses clean combustion characteristics even at low throttle, simplifying engine reuse compared to kerosene fuels.». Дата обращения: 14 июня 2019. - ↑ Известия, 2014: «Удельный импульс у двигателя на СПГ высокий».
- ↑ Известия, 2014: «Чтобы освободить полости двигателя, нужно только пройти цикл испарения — то есть двигатель легче освобождается от остатков продуктов.».
- ↑ Известия, 2014: «За счет этого метановое топливо более приемлемо с точки зрения создания двигателя многоразового использования и летательного аппарата многоразового применения.».
- ↑ Tuboly E. et al. Methane biogenesis during sodium azide-induced chemical hypoxia in rats (англ.) // American Physiological Society (англ.)русск.. — 15 January 2013. — Vol. 304, no. 2. — P. 207—214. — doi:10.1152/ajpcell.00300.2012. — PMID 23174561.
- ↑ Tuboly E, Szabó A, Erős G, Mohácsi A, Szabó G, Tengölics R, Rákhely G, Boros M. Determination of endogenous methane formation by photoacoustic spectroscopy // J Breath Res.. — Dec 2013. — Т. 7, вып. 7(4), № 4. — doi:10.1088/1752-7155/7/4/046004. — PMID 24185326.
- ↑ Sahakian AB, Jee SR, Pimentel M. Methane and the gastrointestinal tract // Dig Dis Sci. — Aug 2010. — Т. 55, вып. 55(8), № 8. — С. 2135—2143. — doi:10.1007/s10620-009-1012-0. — PMID 19830557.
- ↑ Вовна А. В., Хламов М. Г. Применение оптико-абсорбционного метода для измерения объёмной концентрации метана в условиях угольных шахт.
- ↑ EBRD Methodology for Assessment of Greenhouse Gas Emissions, Version 7, 6 July 2010 Архивная копия от 13 мая 2015 на Wayback Machine (англ.)
- ↑ Non-CO2 Greenhouse Gases: Scientific Understanding, Control and Implementation (ed. J. van Ham, Springer 2000, ISBN 978-0-7923-6199-2): 4. Impact of methane on climate, page 30 «On a molar basis, an additional mole of methane in the current atmosphere is about 24 times more effective at absorbing infrared radiation and affecting climate than an additional mole of carbon dioxide (WMO, 1999)»
- ↑ Technical summary. Climate Change 2001. United Nations Environment Programme. Архивировано 4 июня 2011 года.
Литература[править | править код]
- Львов М. Д. Болотный газ или метан // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Ссылки[править | править код]
- [www.xumuk.ru/spravochnik/648.html Термодинамические свойства метана.]
- Метан
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных доменов |
Источник

Краткая характеристика
Природный метан образуется при гниении останков живых организмов. В переводе с английского «methane» означает «болотный газ», так как чаще всего его обнаруживают в болотах и каменноугольных шахтах.
Почти 95% реагента появляется в результате биологических процессов. Пятая часть годовых выбросов газа в атмосферу приходится на коз и коров, в желудках которых живут бактерии, вырабатывающие метан. В атмосферу он попадает, когда рогатый скот выводит из организма продукты своей жизнедеятельности.
Другими источниками вещества являются:
- термиты;
- рис-сырец;
- болотистые водоёмы;
- фильтрация природного газа;
- фотосинтез растений;
- вулканы;
- давно погибшие организмы.
Поскольку вещество обычно связано с живыми организмами, то учёные полагают, что его присутствие на планете указывает на наличие жизни. Так, когда этот газ был обнаружен в атмосферах Марса, специалисты начали тщательное изучение планеты именно на предмет существования живых организмов. Но дальнейшие исследования показали, что на удалённых планетах Солнечной системы метана значительно больше, хотя там он появился в результате химических реакций.
На Земле вещество просачивается через трещины в земной коре, находящиеся на океанском дне, в больших количествах выделяется во время горных разработок и при лесных пожарах. Кроме того, недавно учёными был обнаружен новый источник газа, который никогда ранее в таком ключе не рассматривался.
Физические качества
Метан представляет собой самый простой углеводород. Считается, что он имеет специфический запах, но это распространённое заблуждение. Чистый газ не имеет запаха, характерный аромат он приобретает благодаря специальным добавкам, которые добавляют в вещество для предупреждения о его утечке, ведь цвета химическое соединение также не имеет.
Кроме того, к физическим свойствам метана относятся:

- Горение голубым пламенем.
- Сгорание без выделения вредных продуктов.
- Плохая растворимость в воде.
- Он легче воздуха.
- Основная составляющая природных, попутных нефтяных, рудничного и болотного газов.
- Кипение при температуре -161 °C.
- Замерзание при температуре -183 °C.
- Молярная масса составляет 16,044 г/моль.
- Плотность — 0,656 кг/м³.
- При соединении с воздухом образуются взрывоопасные смеси.
- В жидком виде представляет собой бесцветную жидкость без запаха.
Наиболее опасен метан, который выделяется во время подземных разработок полезных ископаемых, а также на фабриках, занимающихся переработкой и обогащением угля. Когда количество газа в воздухе достигает 5−6%, то он начинает гореть рядом с источниками тепла.

Если уровень вещества поднимается до 14−16%, то может произойти взрыв. При увеличении концентрации вещество горит при постоянном поступлении кислорода. Если же в этот момент количество метана начнёт снижаться, то результатом также может стать взрыв. При взрыве огонь, подпитываемый газом, движется со скоростью от 500 до 700 м/сек. Давление же вещества в этот момент в замкнутом пространстве составляет 1 Мн/м2.
При соприкосновении с источником тепла метан воспламеняется с небольшой задержкой. Это свойство вещества применяется при изготовлении предохранительных взрывчатых веществ и электрооборудования, безопасного при взрывах. На всех объектах, где существует опасность выброса метана, действуют правила техники безопасности «газовый режим».
Химические свойства
В химии формула метана — CH4. Соединение плохо вступает в химические связи.
В обычных условиях оно не реагирует со следующими веществами:
- концентрированные кислоты;
- расплавленные и концентрированные щелочи;
- щелочные металлические реагенты;
- галогены;
- перманганат калия;
- дихромат калия в кислой среде.

При температуре около 200 °C и давлении от 30 до 90 атмосфер болотный газ окисляется, преобразуясь в муравьиную кислоту. Вещество образует соединения, называемые газовыми гидратами, которые часто встречаются в природе.
По своим химическим свойствам метан схож с другими реагентами, относящимися к алканам. А потому он вступает в такие химические реакции, как:

- Конверсия в синтез-газ. Синтез-газ, который образуется в результате указанной реакции, используется для получения метанола, углеводородов и так далее.
- Галогенирование. Такая реакция является цепной. При ней молекула брома или йода подвергается воздействию света и распадается на радикалы, которое затем атакуют молекулы метана. В результате от соединения отрывается атом водорода, а газ становится свободным метилом CH3. Получившееся вещество сталкивается с молекулами брома или йода, которые разрушаются, образуя новые радикалы этих реагентов.
- Нитрование.
- Окисление или горение. Эта реакция происходит при избытке кислорода и описывается следующим уравнением: CH4 + 2O2 → CO2 + 2H2O. В этом случае пламя имеет голубой цвет. Если кислорода недостаточно, то результатом реакции становится выработка не углекислого газа, а оксида углерода. Если же кислорода ещё меньше, то взаимодействие веществ приведёт к выделению мелкодисперсного углерода.
- Сульфохлорирование.
- Сульфоокисление.
- Разложение.
- Дегидрирование.
- Каталитическое окисление. В подобных реакциях из болотного газа образуются карбоновые кислоты, спирты, альдегиды.
Получение в промышленности и лаборатории
В промышленных условиях вещество получают посредством нагревания углерода и водорода или синтеза водяного газа. Для того чтобы реакция протекала успешно, используют катализатор, обычно в этом качестве применяется никель. В США для добычи простейшего углеводорода используется специальная система, способная извлекать соединение из природного угля. Но также метан выделяется в виде подобного продукта при термической переработке нефти и нефтепродуктов, коксовании и гидрировании каменного угля.
В лаборатории для получения вещества применяются следующие методы:
- Реакция гидроксида натрия с ацетатом натрия.
- Взаимодействие карбида алюминия.
- Нагревание натристой извести с уксусной кислотой. Для этой реакции необходима безводная среда, а потому в ней применяется гидроксид натрия, который является наименее гигроскопичным.
Болотный газ самый термически устойчивый углеводород, а потому он широко применяется и в быту, и в промышленности. Хлорирование вещества даёт возможность получения метилхлорида, метиленхлорида, хлороформа, четырёххлористого углерода. Результатом его неполного сгорания является сажа, Если метан каталитически окисляется, то получается формальдегид. А его реакция с серой приводит к образованию сероуглерода.
К важным методам получения ацетилена из простейшего углеводорода относятся:
- термоокислительный крекинг,
- электрокрекинг.
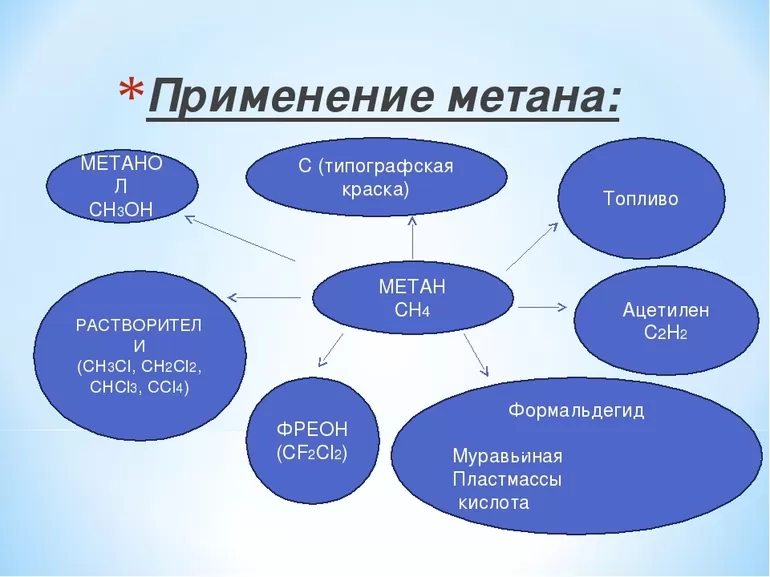
Газ также применяется для производства синильной кислоты. Кроме того, он даёт водород, необходимый для выработки водяного газа, который, в свою очередь, применяется для создания углеводородов, альдегидов и тому подобного. Кроме того, метан необходим при производстве нитрометана.
В настоящее время газ стал часто использоваться в качестве автомобильного топлива. Но его плотность в 1000 раз меньше плотности бензина, а потому, чтобы заправить автомобиль метаном на тот же объём, что и бензином, при равном давлении необходим соответствующий бак. В таком случае для обычной поездки потребовалось бы возить прицеп с топливом.
Учёные решили эту проблему, увеличив плотность газа до 200−250 атмосфер. Сжатое вещество закачивается в специальные баллоны, установленные на автомобилях особой конструкции.
Парниковый эффект

Метан является одним из газов, создающих на планете парниковый эффект. Чтобы измерить уровень его парниковой активности, необходимо принять за единицу меру воздействия на климат нашей планеты диоксида углерода. При таком соотношении влияние метана будет равно 23. Специалисты в области изучения парникового эффекта отмечают, что количество указанного газа в земной атмосфере значительно выросло за последние два столетия.
Объём метана в современной атмосфере в среднем составляет 1,8 части на миллион. Это количество в 200 раз меньше того же показателя углекислого газа. Необходимо отметить, что молекулы соединения рассеивают и удерживают теплоту, которую излучает нагретая солнцем планета, гораздо лучше, чем молекулы углекислого газа. И также необходимо отметить, что углеводород поглощает земное излучение в тех спектральных областях, которые свободно проходят через другие газовые соединения, создающие эффект парника.
Но тем не менее такие газы планете необходимы. Без двуокиси углерода, водяных паров, метана и других составляющих атмосферы температура на поверхности Земли была бы значительно ниже средних 15 градусов тепла.
Влияние на организм человека

Человек может отравиться, надышавшись метаном при аварии на производстве или из-за неправильного обращения с приборами, работающими на этом газе. Возможна такая ситуация и при длительном нахождении на болоте, в шахте. Если концентрация вещества в воздухе составляет 20 и более процентов, то отравление может быть очень тяжёлым, вплоть до летального исхода.
Работники химических производств, рудников и шахт подвержены другому способу отравления углеводородом. Зачастую эти люди на протяжении длительного времени регулярно вдыхают небольшие дозы вещества.
Кроме того, хроническая интоксикация может наступить из-за заболеваний кишечника, например, дисбактериоза. В таких случаях в организме больного метан образуется в повышенном количестве. Этот газ не станет причиной серьёзной интоксикации, но всё же он может вызвать в организме разные нарушения, привести к желудочно-кишечному дискомфорту и общему ухудшению самочувствия.
Отличить острое отравление метаном можно по следующим признакам:


- головокружение;
- шум в ушах;
- сонливость;
- общая слабость;
- потеря координации;
- нарушение речи;
- резь в глазах;
- слезотечение;
- удушье;
- усиленное сердцебиение;
- понижение артериального давления;
- тошнота;
- приступы рвоты;
- синюшность кожных покровов и слизистых оболочек.
Если отравление тяжёлое, то человек теряет сознание, у него начинаются судороги, за которыми следует кома. А также возможна остановка дыхания и сердцебиения.
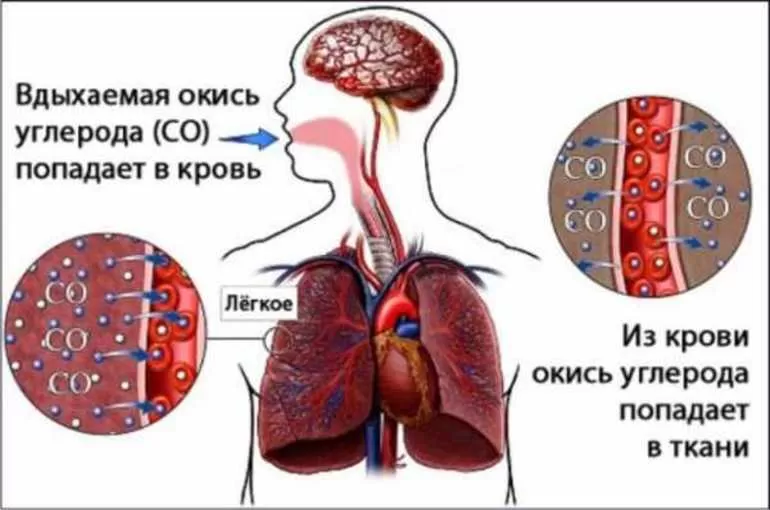
Если отравление метаном является хроническим, то пострадавший страдает от частых головных болей, общего недомогания, низкого артериального давления и снижения работоспособности. Человек становится бледным и вялым, испытывает упадок сил. Гипотония может вызывать обмороки. И также возможно истощение нервной системы, которое выражается в повышенной раздражительности, нервозности и тому подобном.
Метан известен, как один из самых опасных газов. Он токсичен, горюч и взрывоопасен. Вещество не имеет ни цвета, ни запаха, а потому обнаружить его в воздухе крайне сложно. Чтобы не подвергать своё здоровье и жизнь опасности, следует внимательно относится к технике безопасности и соблюдать осторожность при работе или бытовом использовании метана.
Источник
