Какие свойства проявляет kno2
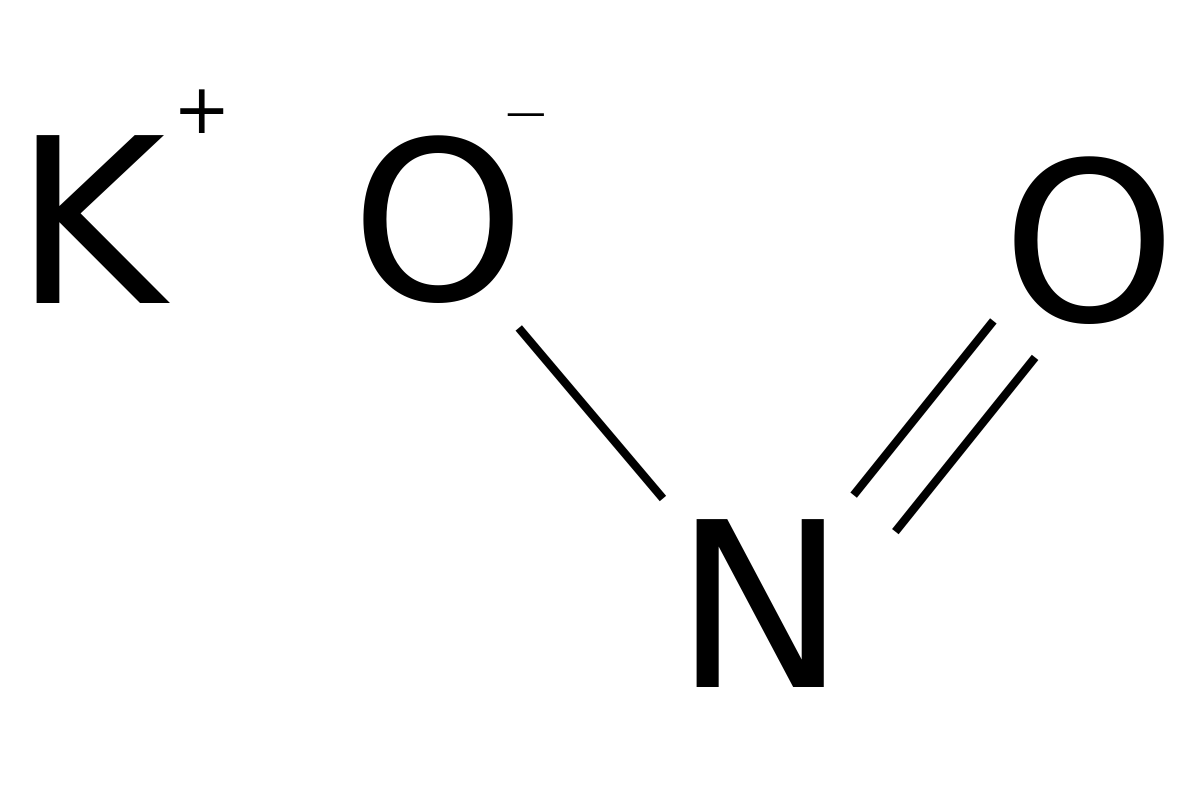
Нитри́т ка́лия (азотистокислый калий) — калиевая соль азотистой кислоты с формулой KNO2.
Представляет собой белый или слегка желтоватый кристаллический гигроскопический порошок.
Очень хорошо растворим в воде. На воздухе медленно окисляется до нитрата калия КNO3.
Пищевая добавка E249.
Используется как улучшитель окраски и консервант в пищевой промышленности в изделиях из мяса и рыбы.
Свойства[править | править код]
Нитрит калия образует бесцветные или слегка желтоватые высоко гигроскопичные кристаллы,
моноклинной сингонии,
пространственная группа I m,
параметры ячейки a = 0,677 нм, b = 0,499 нм, c = 0,445 нм, β = 101,75°, Z = 2.
Очень хорошо растворим в воде,
растворение сопровождается понижением температуры.
Раствор имеет слабо щелочную реакцию из-за гидролиза по аниону.
Кристаллы разрушаются при 360 °C (до достижения точки плавления которая равна 440 °C или 441 °C, при 100 КПа по данным польской и английской Википедии и 438 °C при давлении в 101325 Па
[1], энтальпия плавления — 17 кДж/моль[1]).
Выше этой температуры разлагается по схеме:
Как и нитрит натрия является окислителем особенно при повышенных температурах и реагирует с металлами такими как алюминий (особенно в порошкообразной форме), обезвоженными соединениями аммония такими как сульфат аммония, цианидами и многими органическими соединениями.
На воздухе медленно доокисляется до нитрата калия :
Нитриты можно выявить по характеристической реакции с сульфатом железа (II) в присутствии концентрированной серной кислоты (по образованию коричневого окрашивания).
Нахождение в природе и способы получения[править | править код]
В природе, нитриты появляются на промежуточных этапах азотного цикла — как при нитрификации (присоединении азота к соединениям) так и при денитрификации (отсоединении азота от соединений). В промышленности нитрит калия получают при реакции оксидов азота с гидроксидом калия.
Получается при окислении свинца нитратом калия:
или в процессе термического разложения:
Применение[править | править код]
- Нитрит калия как пищевая добавка Е249 (консервант) используется аналогично другим нитритам и солям (хлоридом натрия и нитритом натрия) — предотвращает образование ботулотоксина (образуется при жизнедеятельности палочки Clostridium botulinum). При добавлении к мясу образует нитрозомиоглобин, имеющий характерный красный цвет, который можно наблюдать в большинстве продуктов питания (колбасы, сосиски, и др.). Употребление продуктов, содержащих нитрит калия, вызывает жажду.
- В Европейском союзе продажа нитрита калия для пищевых целей разрешена только в виде смеси с пищевой солью, с содержанием нитрита около 0,6 %[2]. C 2013 года сходные правила действуют в России.
- Нитрит калия применяется для диазотирования при производстве азо-красителей.
- Нитрит калия применяется в аналитической химии для распознавания аминов.
- Нитрит калия применяется в фотографии как сенсибилизатор.
Биологическое действие[править | править код]
Токсичен при проглатывании, при получении больших доз вызывает раздражение, цианоз, конвульсии, смерть (образует метгемоглобин). Раздражает кожу и глаза. Летальная доза LD50 для кроликов 200 мг/кг[3][4].
Поступление нитритов с пищей оценивается в 31-185 или 40-100 мг в день[5].
В питьевой воде, согласно требованиям ВОЗ 1970 и 2004 гг[6][7], допускается содержание нитритов не более 44-50 мг на литр[8].
Приемлемые уровни потребления нитритов для людей 3,7 — 7 мг / кг.[8]
Примечания[править | править код]
- ↑ 1 2 Физические величины: Справочник/А. П. Бабичев, Н. А. Бабушкина, А. М. Братковский и др.; Под ред. И. С. Григорьева, Е. З. Мейлихова. — М.; Энергоатомиздат, 1991 −1232 с — ISBN 5-283-04013-5
- ↑ OPINIONS OF THE SCIENTIFIC COMMITTEE FOR FOOD ON: Nitrates and Nitrite / REPORTS OF THE SCIENTIFIC COMMITTEE FOR FOOD; European Commission, 1997
- ↑ Material Safety Data Sheet Potassium nitrite MSDS# 19480 Архивная копия от 8 августа 2016 на Wayback Machine. Fisher Scientific. 2005
- ↑ https://www.cdc.gov/niosh/ipcsneng/neng1069.html POTASSIUM NITRITE — The National Institute for Occupational Safety and Health (NIOSH), CDC
- ↑ Food sources of nitrates and nitrites: the physiologic context for potential health benefits Am J Clin Nutr July 2009 vol. 90 no. 1 1-10, doi:10.3945/ajcn.2008.27131. «DIETARY NITRATE AND NITRITE INTAKE ESTIMATES»
- ↑ World Health Organization. Recommendations; nitrate and nitrite. In: Guidelines for drinking water quality. 3rd ed. Geneva, Switzerland: WHO, 2004:417-20.
- ↑ Nitrate and nitrite in drinking-water (WHO/SDE/WSH/07.01/16/Rev/1), 2011
- ↑ 1 2 Food sources of nitrates and nitrites: the physiologic context for potential health benefits Am J Clin Nutr July 2009 vol. 90 no. 1 1-10, doi:10.3945/ajcn.2008.27131. POTENTIAL HEALTH RISKS OF EXCESSIVE NITRATE AND NITRITE EXPOSURE
Литература[править | править код]
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- IARC Monographs on the Evaluation of Carcinogenic Risks to Humans VOLUME 94 “Ingested Nitrate and Nitrite, and Cyanobacterial Peptide Toxins”, IARC, 2010 ISBN 978-92-832-1294-2, ISSN 1017-1606 (англ.)
Источник
нитрит калия Это кристаллическое твердое вещество желтовато-белого цвета. Его химическая формула КНО2 и Он имеет ионную связь между калием и одним из нитритов кислорода. Нитриты в целом присутствуют в почве, воде, тканях животных и растений, а также в удобрениях..
Нитрат калия был впервые получен шведским химиком Карлом Вильгельмом Шееле, когда он работал в лаборатории своей аптеки в деревне Кёпин. Он нагревал нитрат калия до красного цвета в течение получаса, пока не получил то, что он признал новой солью.
Эти две соли, нитрат и нитрит, были охарактеризованы французским химиком Эженом-Мельхиором Пелиго, и реакция была установлена следующим образом:
Этот процесс до сих пор используется для его производства. Нитрит калия получают восстановлением нитрата калия. Производство нитритов осуществляется путем абсорбции оксидов азота в растворах гидроксида калия или карбоната калия..
Однако это не делается в больших масштабах из-за высокой стоимости этих основ, кроме того, что высокая растворимость нитрита калия в воде затрудняет восстановление. (Нитрит калия, с.ф.)
индекс
- 1 Физико-химические свойства
- 2 Реактивность и опасности
- 2.1 Возможные взрывы
- 2.2 Опасно для кожи
- 2.3 Респираторные риски
- 2.4 Сердечно-сосудистые заболевания
- 2.5 Другое
- 3 Обработка и хранение
- 4 Медицинское использование
- 5 Другое использование
- 6 Биохимия
- 7 ссылок
Физико-химические свойства
Нитрит калия представляет собой кристаллическое твердое вещество при комнатной температуре, желтовато-белое. Его молярная масса составляет 85,1 г / моль, а его плотность составляет 1,915 г / мл..
Он имеет температуру плавления 441 градусов по Цельсию и начинает разлагаться при температуре 350 градусов по Цельсию. Его точка кипения составляет 537 градусов по Цельсию, в которой он взрывается.
Нитрит калия хорошо растворяется в воде. Он может растворить 281 г в 100 мл воды при 0 ° С, 413 г в 100 мл воды при 100 ° С.
Его растворимость при комнатной температуре составляет 312 г в 100 мл воды. Он также очень хорошо растворим в аммиаке и растворим в горячем спирте..
Реактивность и опасности
Возможные взрывы
Нитрит калия является сильным окислителем, который может ускорить горение других людей при пожаре. Может вступать в взрывную реакцию при контакте с фосфором, хлоридом олова (II) или другими сильными восстановителями.
Загрязнение соединениями аммония может вызвать самопроизвольное разложение. Полученное тепло может воспламенить горючий материал, который присутствует.
Реагирует с кислотами с образованием токсичных газов диоксида азота. При смешивании с жидким аммиаком он образует нитрит калия, который очень реактивный и взрывоопасный. При расплавлении с солями аммония приводит к сильным взрывам.
Может смешиваться с цианидом калия. При добавлении небольших количеств сульфата аммония к расплавленному нитрату калия происходит бурная реакция, сопровождаемая пламенем (нитрит калия, 2016 г.).
Опасно для кожи
Нитрат калия чрезвычайно опасен при попадании на кожу, в глаза, при проглатывании или вдыхании. Серьезность повреждения будет зависеть от продолжительности контакта.
Контакт с кожей может вызвать раздражение, воспаление и истирание. (паспорт безопасности материала нитрат калия, 2013).
Респираторные риски
Нитрат калия может повлиять на дыхание. Вдыхание пыли может вызвать раздражение горла, носа и легких, вызывая кашель с мокротой.
Более высокие воздействия могут вызвать отек легких, который в конечном итоге может привести к смерти (Pohanish, 2012).
Сердечно-сосудистые заболевания
Высокие уровни нитрата калия могут влиять на сосудистую систему и влиять на способность крови переносить кислород (метгемоглобинемию), вызывая головные боли, слабость, головокружение и изменение цвета кожи и слизистых оболочек, известные как цианоз..
Более высокие дозы могут вызвать проблемы с дыханием, коллапс и даже смерть (Food Additives in Europe 2000, 2002).
другие
Длительный контакт может вызвать трещины на коже, сухость и дерматит. Это может вызвать раздражение легких, что может привести к бронхиту. Есть также доказательства того, что нитрит калия может повредить развивающиеся плоды.
Токсичность нитрата калия составляет 235 мг на кг массы тела (Королевское общество химии, 2015 г.), и исследования на крысах показали, что нет никаких эффектов в дозах ниже 10 мг KNO2 на килограмм, потребляемых в день (H.P. Til, 1988).
Обработка и хранение
Нитрит калия обычно хранится вместе с другими окислителями и отделяется от горючих или легковоспламеняющихся веществ, восстановителей, кислот, цианидов, соединений аммония, амидов и других солей азота в сухом, теплом, хорошо проветриваемом месте..
Не следует глотать или дышать. В случае недостаточной вентиляции следует использовать соответствующее дыхательное оборудование, такое как маска с противогазовым и парофильтром. Избегать контакта с кожей и глазами.
В случае проглатывания, немедленно обратитесь за медицинской помощью. В этих случаях рекомендуется показывать бутылку контейнера или этикетку продукта..
Во избежание несчастных случаев всегда следует надевать лабораторный халат, защитные очки и латексные перчатки. (паспорт безопасности материала нитрат калия, 2013)
Медицинское использование
Медицинский интерес к неорганическим нитритам начал расти, когда наблюдалась его эффективность в лечении ангина. Ранее лечение зла было сделано путем венесекции.
Имея ошибочное мнение о том, что боль возникла из-за высокого кровяного давления, вены были перерезаны, и пациенту позволили кровоточить. Излишне говорить, что указанное лечение было неудобным.
Примерно в 1860-х годах Томас Лаудер Брунтон, доктор медицины, решил попробовать ингаляцию амилнитрита у пациентов со стенокардией, соединение, которое недавно было синтезировано одним из его коллег и показало, что кровяное давление было снижено. у животных.
Результаты у их пациентов были плодотворными. Боль, связанная с этим недугом, быстро уменьшилась, и эффект продолжался в течение нескольких минут, достаточно времени, чтобы пациент выздоровел и отдохнул.
В течение долгого времени амилнитрит был выбран для лечения стенокардии, но из-за его летучести он был заменен солями, такими как нитрит калия, которые имели такой же эффект (Butler & Feelisch, 2008).
У здоровых добровольцев наблюдалось влияние нитрита калия на нервную систему, спинной мозг, мозг, пульс, артериальное давление и дыхание, а также его вариабельность у разных людей..
Наиболее важным наблюдением было то, что даже в небольших дозах приблизительно 30 мг, вводимых перорально, первоначально это вызывает повышение кровяного давления; с последующим умеренным снижением его. При более высоких дозах возникала выраженная гипотензия.
Они также отметили, что нитрит калия, независимо от того, как его вводили, оказал глубокое влияние на внешний вид и способность кислорода переносить кровь..
Они сравнили биологическое действие нитрита калия с действием амил- и этилнитритов и пришли к выводу, что сходство действия зависит от превращения органических нитритов в азотистую кислоту..
В условиях гипоксии нитрит может выделять оксид азота, что вызывает сильное расширение сосудов. Было описано несколько механизмов превращения нитрита в NO, включая ферментативное восстановление ксантиноксидоредуктазой, нитритредуктазой и NO синтазой (NOS), а также неферментативные реакции дисмутации. (Альберт Л. Ленингер, 2005).
Как правило, в фармакологии соли калия используются вместо солей натрия для лечения пациентов с гипертонией.
Другое использование
Среди других применений, которые даны нитрату калия, а также нитрату натрия, является сохранение продуктов питания, в особенности консервированного мяса, такого как бекон и чоризо. Нитрит натрия и калия используются в качестве антимикробных консервантов, предотвращающих разложение таких продуктов бактериями.
Детальный механизм этих химических соединений идет от ингибирования роста бактерий до ингибирования специфических ферментов.
Нитрит натрия используется для сушки мяса не только потому, что он предотвращает рост бактерий, но и потому, что он является окислителем; В реакции с миоглобином мяса, это дает продукт желаемый розово-красный “розовый” цвет.
Такое использование нитритов восходит к средневековью, а в Соединенных Штатах оно официально использовалось с 1925 года. Из-за относительно высокой токсичности нитритов концентрация нитритов в мясных продуктах составляет 200 частей на миллион, что является максимально допустимой концентрацией.
На этих уровнях от 80 до 90% нитритов в среднем рационе питания в Соединенных Штатах происходит не из консервированных мясных продуктов, а из естественного производства нитритов за счет потребления растительных нитратов..
При определенных условиях (особенно во время приготовления) нитриты в мясе могут реагировать с продуктами разложения аминокислот, образуя нитрозамины, которые являются известными канцерогенами..
Однако роль нитритов (и в некоторой степени нитратов) в профилактике ботулизма путем предотвращения прорастания эндоспор C. botulinum помешала полной ликвидации нитритов из консервированного мяса в США. UU.
Мясо нельзя считать вяленым без добавления нитритов. Они считаются незаменимыми в предотвращении отравления ботулинический потребления сушеных вяленых колбас, таких как колбаса или колбаса, предотвращая прорастание споры.
У мышей продукты, богатые нитритами наряду с ненасыщенными жирами, могут предотвратить гипертонию, что объясняет очевидное влияние средиземноморской диеты на здоровье (Nathan S. Bryan, 2011).
Другие области применения нитрита калия используются в производстве солей для теплообмена, ингибитора коррозии и противообрастающего агента, в качестве реагента для восстановления оксидных реакций, в качестве добавки в лакокрасочные материалы и для обработки воды (калий). Нитрита, сф).
биохимия
Нитраты и нитриты, вводимые перорально, всасываются и переносятся в кровь в верхней части желудочно-кишечного тракта. Продукты, богатые пектином, могут задерживать всасывание, которое может происходить ниже в кишечнике, с возможным повышенным риском микробного превращения нитрата в нитрит..
Независимо от пути воздействия, нитраты и нитриты быстро переносятся в кровь. Нитрит постепенно окисляется до нитрата, который легко распределяется в большинстве жидкостей организма (моча, слюна, желудочный сок, пот, илеостомическая жидкость). Нитраты не накапливаются в организме.
Основным механизмом токсичности нитритов является окисление двухвалентного железа (Fe2 +) в дезоксигемоглобине до состояния валентности железа (Fe3 +) с образованием метгемоглобина. Метгемоглобин не может связывать или транспортировать обратимо циркулирующий кислород.
В зависимости от процентного содержания общего метгемоглобина в окисленной форме клинической картиной является дефицит кислорода с цианозом, нарушениями сердечного ритма и недостаточностью кровообращения и прогрессирующим воздействием на центральную нервную систему (ЦНС). Воздействие на ЦНС может варьироваться от легкого головокружения и летаргии до комы и судорог (калий нитрит, s.f.).
Основная проблема возможных долговременных последствий воздействия нитратов и нитритов связана с образованием закисных соединений, многие из которых являются канцерогенными..
Это образование может иметь место там, где присутствуют нитриты и нитрозасыщенные соединения, но этому способствуют кислотные условия или присутствие некоторых бактерий..
Желудочно-кишечный тракт и особенно желудок считаются основным местом образования, но реакции нитрозирования также могут происходить в инфицированном мочевом пузыре
Выведение нитритов с мочой и калом очень низкое, так как большая часть нитритов, поступающих в кровоток или проходящих через желудочно-кишечный тракт (GI), быстро становится нитратом, связывается с содержанием GI или снижается кишечными бактериями..
Быстрое снижение концентрации нитритов в крови объясняется реакционной способностью нитритов с гемоглобином и другими эндогенными соединениями, гипотеза, основанная на увеличении концентрации нитратов после внутривенного введения нитритов крысам..
ссылки
- Альберт Л. Ленингер, Д. Л. (2005). Lehninger Принципы биохимии. У. Х. Фриман.
- Батлер А. & Фелиш М. (2008). Терапевтическое использование неорганического нитрита и нитрата. Журнал Американской кардиологической ассоциации, 2151-2159. Извлечено из circ.ahajournals.org.
- Пищевые добавки в Европе 2000. (2002). copenaghen: тема норд.
- H.P. Til, H.F. (1988). Оценка пероральной токсичности нитрита калия в 13-недельном исследовании питьевой воды на крысах. Пищевая и химическая токсикология, том 26, выпуск 10, 851-859. sciencedirect.com.
- паспорт безопасности материала нитрат калия. (2013, 21 мая). Получено из научной лаборатории: sciencelab.com.
- Натан С. Брайан, Дж. Л. (2011). Нитриты и нитраты в здоровье и заболевание человека. человеческая пресса.
- Поханиш, Р. П. (2012). Руководство Ситтига по токсичным и опасным химическим веществам и канцерогенам, том 1, шестое издание. Elsevier.
- нитрит калия. (2016). Извлечено из химии камеи: cameochemicals.noaa.gov.
- Нитрит калия. (Н.Д.). Получено из открытой химической базы данных Pub Chem: pubchem.ncbi.nlm.nih.gov.
- Королевское общество химии. (2015). нитрит калия. Получено от хим паука: chemspider.com.
Источник
Что мы делаем. Каждая страница проходит через несколько сотен совершенствующих техник. Совершенно та же Википедия. Только лучше.
Из Википедии — свободной энциклопедии
Нитри́т ка́лия (азотистокислый калий) — калиевая соль азотистой кислоты с формулой KNO2.
Представляет собой белый или слегка желтоватый кристаллический гигроскопический порошок.
Очень хорошо растворим в воде. На воздухе медленно окисляется до нитрата калия КNO3.
Пищевая добавка E249.
Используется как улучшитель окраски и консервант в пищевой промышленности в изделиях из мяса и рыбы.
Свойства
Нитрит калия образует бесцветные или слегка желтоватые высоко гигроскопичные кристаллы,
моноклинной сингонии,
пространственная группа I m,
параметры ячейки a = 0,677 нм, b = 0,499 нм, c = 0,445 нм, β = 101,75°, Z = 2.
Очень хорошо растворим в воде,
растворение сопровождается понижением температуры.
Раствор имеет слабо щелочную реакцию из-за гидролиза по аниону.
Кристаллы разрушаются при 360 °C (до достижения точки плавления которая равна 440 °C или 441 °C, при 100 КПа по данным польской и английской Википедии и 438 °C при давлении в 101325 Па
[1], энтальпия плавления — 17 кДж/моль[1]).
Выше этой температуры разлагается по схеме:
Как и нитрит натрия является окислителем особенно при повышенных температурах и реагирует с металлами такими как алюминий (особенно в порошкообразной форме), обезвоженными соединениями аммония такими как сульфат аммония, цианидами и многими органическими соединениями.
На воздухе медленно доокисляется до нитрата калия :
Нитриты можно выявить по характеристической реакции с сульфатом железа (II) в присутствии концентрированной серной кислоты (по образованию коричневого окрашивания).
Нахождение в природе и способы получения
В природе, нитриты появляются на промежуточных этапах азотного цикла — как при нитрификации (присоединении азота к соединениям) так и при денитрификации (отсоединении азота от соединений). В промышленности нитрит калия получают при реакции оксидов азота с гидроксидом калия.
Получается при окислении свинца нитратом калия:
или в процессе термического разложения:
Применение
- Нитрит калия как пищевая добавка Е249 (консервант) используется аналогично другим нитритам и солям (хлоридом натрия и нитритом натрия) — предотвращает образование ботулотоксина (образуется при жизнедеятельности палочки Clostridium botulinum). При добавлении к мясу образует нитрозомиоглобин, имеющий характерный красный цвет, который можно наблюдать в большинстве продуктов питания (колбасы, сосиски, и др.). Употребление продуктов, содержащих нитрит калия, вызывает жажду.
- В Европейском союзе продажа нитрита калия для пищевых целей разрешена только в виде смеси с пищевой солью, с содержанием нитрита около 0,6 %[2]. C 2013 года сходные правила действуют в России.
- Нитрит калия применяется для диазотирования при производстве азо-красителей.
- Нитрит калия применяется в аналитической химии для распознавания аминов.
- Нитрит калия применяется в фотографии как сенсибилизатор.
Биологическое действие
Токсичен при проглатывании, при получении больших доз вызывает раздражение, цианоз, конвульсии, смерть (образует метгемоглобин). Раздражает кожу и глаза. Летальная доза LD50 для кроликов 200 мг/кг[3][4].
Поступление нитритов с пищей оценивается в 31-185 или 40-100 мг в день[5].
В питьевой воде, согласно требованиям ВОЗ 1970 и 2004 гг[6][7], допускается содержание нитритов не более 44-50 мг на литр[8].
Приемлемые уровни потребления нитритов для людей 3,7 — 7 мг / кг.[8]
Примечания
- ↑ 1 2 Физические величины: Справочник/А. П. Бабичев, Н. А. Бабушкина, А. М. Братковский и др.; Под ред. И. С. Григорьева, Е. З. Мейлихова. — М.; Энергоатомиздат, 1991 −1232 с — ISBN 5-283-04013-5
- ↑ OPINIONS OF THE SCIENTIFIC COMMITTEE FOR FOOD ON: Nitrates and Nitrite / REPORTS OF THE SCIENTIFIC COMMITTEE FOR FOOD; European Commission, 1997
- ↑ Material Safety Data Sheet Potassium nitrite MSDS# 19480 . Fisher Scientific. 2005
- ↑ https://www.cdc.gov/niosh/ipcsneng/neng1069.html POTASSIUM NITRITE — The National Institute for Occupational Safety and Health (NIOSH), CDC
- ↑ Food sources of nitrates and nitrites: the physiologic context for potential health benefits Am J Clin Nutr July 2009 vol. 90 no. 1 1-10, doi:10.3945/ajcn.2008.27131. «DIETARY NITRATE AND NITRITE INTAKE ESTIMATES»
- ↑ World Health Organization. Recommendations; nitrate and nitrite. In: Guidelines for drinking water quality. 3rd ed. Geneva, Switzerland: WHO, 2004:417-20.
- ↑ Nitrate and nitrite in drinking-water (WHO/SDE/WSH/07.01/16/Rev/1), 2011
- ↑ 1 2 Food sources of nitrates and nitrites: the physiologic context for potential health benefits Am J Clin Nutr July 2009 vol. 90 no. 1 1-10, doi:10.3945/ajcn.2008.27131. POTENTIAL HEALTH RISKS OF EXCESSIVE NITRATE AND NITRITE EXPOSURE
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- IARC Monographs on the Evaluation of Carcinogenic Risks to Humans VOLUME 94 “Ingested Nitrate and Nitrite, and Cyanobacterial Peptide Toxins”, IARC, 2010 ISBN 978-92-832-1294-2, ISSN 1017-1606 (англ.)
Источник
