Какие свойства проявляет hno3

Строение молекулы азотной кислоты:
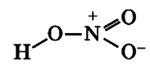
Связь N+-O- образуются по донорно-акцепторному механизму: атом азота отдает электрон, играя роль донора и приобретая положительный заряд, атом кислорода присоединяет электрон, выступая в роли акцептора и приобретая отрицательный заряд. Атомы азота проявляют степень окисления +5 (валентность 4).
Физические свойства азотной кислоты:
- бесцветная маслянистая жидкость с резким запахом;
- температура кипения 83°C
- плотность 1,4 г/см3 (63% HNO3);
- с водой смешивается в любых пропорциях, проявляя в водных растворах свойства сильной кислоты;
- легко разлагается на свету при длительном хранении, приобретая при этом желтый оттенок, в который ее окрашивает газ NO2, выделяющийся при разложении:
4HNO3 ↔ 2H2O+4NO2↑+O2↑
Химические свойства азотной кислоты
HNO3 является одной из самых сильных кислот – в водных растворах полностью диссоциирует на катионы водорода и нитрат-ионы:
HNO3 ↔ H++NO3-
Азотная кислота вступает в реакции:
- с оксидами металлов:
MgO+2H+NO3 = Mg2+(NO3)2+H2O - с основаниями:
Mg(OH)2+2H+NO3 = Mg2+(NO3)2+2H2O - с солями более слабых кислот:
Na2CO32-+2H+NO3 = 2NaNO3+CO2↑+H2O
Следует обратить внимание, что азотная кислота в обменных реакциях может взаимодействовать далеко не со всеми солями, а лишь только с теми, при реагировании с которыми образуются нерастворимые, слабодиссоциирующие и газообразные вещества, которые, по мере их образования, более не участвуют в реакции обмена. В обменных реакциях солями, при взаимодействии с которыми образуются растворимые в воде соли азотной кислоты, азотная кислота не участвует.
В окислительно-восстановительных реакциях азотная кислота выступает в роли сильного окислителя. Высокие окислительные свойства HNO3 объясняются тем, что в молекуле азотной кислоты атом азота в составе кислотного остатка NO3- имеет максимально возможную степень окисления +5. По этой причине окислительные свойства NO3- значительно превосходят “возможности” катионов водорода H+, из-за чего азотная кислота реагирует практически со всеми металлами за исключением золота,платины, родия, рутения, иридия и тантала, стоящими в конце ряда напряжений.

Характерной особенностью взаимодействия азотной кислоты с металлами является отсутствие выделения водорода, поскольку окислителями являются не катионы водорода, а нитрат-ионы NO3-, которые, при взаимодействии азотной кислоты с металлами восстанавливается тем полнее, чем более активным является металл и чем более разбавленной является HNO3.
По этой причине образование тех или иных продуктов реакции азотной кислоты и металла зависит от концентрации кислоты и активности металла.
Атом азота в молекуле азотной кислоты имеет степень окисления +5, и может принимать 1, 2, 3, 4, 5 или 8 электронов:
HN+5O3+1e- → N+4O2
HN+5O3+2e- → HN+3O2
HN+5O3+3e- → N+2O
HN+5O3+4e- → N2+1O
HN+5O3+5e- → N20
HN+5O3+8e- → N-3H3
HN+5O3+8e- → N-3H4NO3
Чем более концентрированной является азотная кислота, тем меньшей окислительной способностью по отношению к металлам она обладает.
С другой стороны, чем более активным является металл, тем в большей степени он восстанавливает азотную кислоту.
Примеры реакций азотной кислоты:
- концентрированная HN+5O3 с активными металлами (до алюминия в ряду напряжений) восстанавливается до N2O
10HN+5O3+4Ca0 = 4Ca+2(NO3)2+N2+1O↑+5H2O - концентрированная HN+5O3 с неактивными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2
4HN+5O3+Ni0 = Ni+2(NO3)2+2N+4O2↑+2H2O - концентрированная HN+5O3 с неметаллами (Ni, Cu, Ag, Hg) восстанавливается до NO2
4HN+5O3+P0 = HP+5O3+5N+4O2↑+2H2O - разбавленная HN+5O3 с активными металлами (до алюминия в ряду напряжений) образует аммиак или нитрат аммония
10HN+5O3+4Mg0 = 4Mg+2(NO3)2+N-3H4N+5O3+3H2O - разбавленная HN+5O3 с неактивными металлами образует оксид азота (II)
8HN+5O3+3Cu0 = 3Cu+2(NO3)2+2N+2O↑+4H2O - разбавленная HN+5O3 с неметаллами образует оксид азота (II)
2HN+5O3+S0 = H2S+6O4+2N+2O↑
Уравнения окислительно-восстановительных реакций азотной кислоты…
Концентрированная азотная кислота пассивирует алюминий, железо и хром, образуя на их поверхности очень прочную нерастворимую оксидную пленку:
2Al+6HNO3 = Al2O3+6NO2+3H2O
“Царская водка” (смесь концентрированной азотной кислоты с соляной в соотношении 1:3) окисляет золото и платину:
Au+3HNO3+3HCl = AuCl3+3NO2+3H2O
Получение и применение азотной кислоты
Промышленный способ получения азотной кислоты:
- окислением аммиака на платиновом катализаторе до оксида азота (II):
4N-3H3+5O20 = 4N+2O-2+6H2O - окислением оксида азота (II) до оксида азота (IV):
2N+2O-2+O20 = 2N+4O2-2 - растворением оксида азота (IV) в воде в присутствии кислорода (автор способа И.И.Андреев, 1916 г.):
4N+4O2+2H2O+O20 = 4HN+5O3-2
Лабораторный способ получения азотной кислоты:
- взаимодействием безводных нитратов с концентрированной серной кислотой:
NaNO3+H2SO4 = NaHSO4+HNO3
Применение азотной кислоты:
- производство азотных удобрений;
- в фармакологии для производства лекарственных препаратов;
- в производстве взрывчатых веществ.
Соли азотной кислоты
О солях азотной кислоты, наверняка, слышали многие, ведь в последнее время так много говорят о вреде нитратов в овощах и фруктах.
Нитраты калия, натрия, аммония и кальция называются селитрами (калийная селитра, натриевая селитра, аммонийная селитра, известковая селитра). Селитры нашли широкое применение в сельском хозяйстве в качестве минеральных азотных удобрений, что вполне логично, ибо азот является одним из основных элементов растений.
Нитраты хорошо растворяются в воде, при этом такие растворы не обладают окислительными свойствами, а вот расплавы нитратов являются хорошими окислителями.
Те нитраты, которые были образованы слабыми основаниями, гидролизуются, их водные растворы являются кислыми:
Cu2+(NO3)2+H2O ↔ CuOH+NO3+H+NO3
Соли азотной кислоты являются сильными окислителями.
Все нитраты, за исключением нитрата аммония разлагаются с выделением кислорода, при этом образующиеся продукты разложения зависят от электроотрицательности металла (см. таблицу выше):
- соли металлов, расположенных в ряду напряжений левее магния, при разложении образуют кроме кислорода еще и нитриты:
MeN+5O3 → MeN+3O2+O20↑
2KNO3 = 2KNO2+O2 - соли металлов, расположенных от магния до меди – образуют оксиды металла и азота (IV):
MeN+5O3 → MeO+N+4O2↑+O20↑
2Pb(NO3)2 = 2PbO+4NO2+O2 - соли металлов, расположенных правее меди – образуют свободный металл и оксид азота (IV):
MeN+5O3 → Me+N+4O2↑+O20↑
2AgNO3 = 2Ag+2NO2+O2 - нитрат аммония разлагается с образованием оксида азота (I) и воды:
NH4NO3 = N2O+2H2O
Нитраты вступают в реакции, типичные для всех солей:
- с металлами:
Hg(NO3)2+Zn = Zn(NO3)2+Hg - с щелочами:
Pb(NO3)2+2NaOH = Pb(OH)2↓+2NaNO3 - с кислотами:
Ba(NO3)2+H2SO4 = BaSO4↓+2HNO3 - с другими солями:
AgNO3+NaCl = AgCl↓+NaNO3
Получение и применение нитратов
Нитраты получают реакцией азотной кислоты:
- на металлы:
10HNO3(разб)+4Zn = 4Zn(NO3)2+NH4NO3+3H2O - на оксиды металлов:
2HNO3+CuO = Cu(NO3)2+H2O - на основания:
3HNO3+Al(OH)3 = Al(NO3)3+3H2O
Применение нитратов:
- Селитры используются в качестве минеральных удобрений:
- KNO3 – калийная или индийская селитра;
- NaNO3 – натриевая или чилийская селитра;
- NH4NO3 – аммонийная селитра;
- Ca(NO3)2 – известковая или норвежская селитра.
- Калийная селитра используется для изготовления “черного пороха”.
- Аммонийная селитра используют для изготовления взрывчатого вещества – аммонала.
Другие соединения азота:
- Аммиак
- Оксиды азота
Источник
Определение и формула
Азотная кислота
Неорганическая сильная одноосновная кислота.
Формула
HNO3HNO_3HNO3
Свойства азотной кислоты
Физические свойства
Представляет собой бесцветную жидкость, дымящую на воздухе. С водой смешивается в любых соотношениях. Концентрированной азотной кислотой называют растворы с концентрацией HNO3, равной 60-70%, «дымящей азотной кислотой» 95-98%-ные растворы азотной кислоты.
| Свойство | Описание |
|---|---|
| плотность | 1,51 г/см3 |
| молярная масса | 63,01 г/моль |
| температура кипения | +82,6°C |
| температура плавления | -41,59 ᵒС |
Химические свойства
В химических реакциях азотная кислота может выступать в роли сильной одноосновной кислоты, либо окислителя. Азотная кислота высокой концентрации обычно окрашена в бурый цвет за счет присутствия в ней оксида азота (IV), образующегося по уравнению:
4HNO3⟶4NO2↑+2H2O+O24HNO_3 longrightarrow 4NO_2↑+ 2H_2O + O_24HNO3⟶4NO2↑+2H2O+O2↑
Такое же превращение азотная кислота претерпевает при нагревании.
Кислотные свойства
- Диссоциация в воде
HNO3⟷H++NO3−HNO3 longleftrightarrow H^+ + NO_3^-HNO3⟷H++NO3−
- Взаимодействие с основными и амфотерными оксидами
MgO+2HNO3⟶Mg(NO3)2+H2OMgO + 2HNO_3 longrightarrow Mg(NO_3)_2 + H_2OMgO+2HNO3⟶Mg(NO3)2+H2O
ZnO+2HNO3⟶Zn(NO3)2+H2OZnO + 2HNO_3 longrightarrow Zn(NO_3)_2 + H_2OZnO+2HNO3⟶Zn(NO3)2+H2O
- Взаимодействие с основаниями и амфотерными гидроксидами
NaOH+HNO3⟶NaNO3+H2ONaOH + HNO_3 longrightarrow NaNO_3 + H_2ONaOH+HNO3⟶NaNO3+H2O
Zn(OH)2+2HNO3⟶Zn(NO3)2+2H2OZn(OH)_2 + 2HNO_3 longrightarrow Zn(NO_3)_2 + 2H_2OZn(OH)2+2HNO3⟶Zn(NO3)2+2H2O
- Взаимодействие с солями слабых кислот (карбонатами, силикатами)
BaCO3+2HNO3⟶Ba(NO3)2+CO2↑+H2OBaCO_3 + 2HNO_3 longrightarrow Ba(NO_3)_2 + CO_2↑ + H_2OBaCO3+2HNO3⟶Ba(NO3)2+CO2↑+H2O
Окислительные свойства
В азотной кислоте атом азота находится в высшей степени окисления +5, благодаря чему азотная кислота любой концентрации может выступать в роли окислителя. Азот может восстанавливаться до степеней окисления от +4 до -3. Возможные продукты восстановления азотной кислоты при взаимодействии с металлами представлены в таблице 1.
Таблица 1. Типичные продукты восстановления азотной кислоты
| Степень окисления азота | +4 | +2 | +1 | -3 | |
|---|---|---|---|---|---|
| Формула вещества | NO2 | NO | N2O | N2 | NH4NO3 |
Закономерность
Увеличение активности металла и разбавление кислоты способствуют более полному восстановлению азотной кислоты.
- Взаимодействие с металлами
Железо (Fe), алюминий (Al), хром (Cr) пассивируются холодной концентрированной азотной кислотой.
Азотная кислота не взаимодействует с золотом, металлами платиновой группы и танталом. В остальных случаях продукты (табл. 2) зависят от концентрации HNO3:
Таблица 2. Зависимость продуктов реакции взаимодействия азотной кислоты с металлами от концентрации кислоты и активности металла
| Формула кислоты | Концентрация | Активность металла | Продукты взаимодействия с кислотой |
| HNO3 | Концентрированная | Независимо от активности металла | Соль + NO2 + Н2О |
| Разбавленная | Активный металл Li-Zn | Соль + N2 + Н2О | |
| Металл средней активности Fe-Pb | Соль + N2O + Н2О | ||
| Неактивный металл (после Н2) | Соль + NO + Н2О | ||
| Очень разбавленная | Активный металл | Соль + NH4NO3 + Н2О |
- Взаимодействие с неметаллами
При взаимодействии с неметаллами азотная кислота восстанавливается до NONONO или NO2NO_2NO2:
S+6HNO3S + 6HNO_3S+6HNO3(конц.) ⟶H2SO4+6NO2↑+2H2Olongrightarrow H_2SO_4 + 6NO_2↑ + 2H_2O⟶H2SO4+6NO2↑+2H2O
S+2HNO3S + 2HNO_3S+2HNO3(разб.) ⟶H2SO4+2NO↑longrightarrow H_2SO_4 + 2NO↑⟶H2SO4+2NO↑
- Взаимодействие со сложными веществами-восстановителями
FeS+4HNO3FeS + 4HNO_3FeS+4HNO3(разб.) ⟶Fe(NO3)3+S+NO↑+2H2Olongrightarrow Fe(NO_3)_3 +S + NO↑ + 2H_2O⟶Fe(NO3)3+S+NO↑+2H2O
Взаимодействие с органическими соединениями
Взаимодействие углеводородов с азотной кислотой используется для введения в молекулу органического вещества нитрогруппы –NO2NO_2NO2. В результате нитрования углеводородов образуются нитросоединения.
- Реакция Коновалова (взаимодействие разбавленной азотной кислоты с алканами):
CH4+HNO3⟶CH3NO2+H2OCH_4 + HNO_3 longrightarrow CH_3NO_2 + H_2OCH4+HNO3⟶CH3NO2+H2O
- Нитрование аренов
C6H6+HNO3⟶C6H5NO2+H2OC_6H_6 + HNO_3 longrightarrow C_6H_5NO_2 + H_2OC6H6+HNO3⟶C6H5NO2+H2O
Источники получения
В природе не встречается.
Способом производства является каталитическое окисление синтетического аммиака на платиновом катализаторе до смеси оксидов азота с дальнейшим поглощением их водой:
4NH3+5O2⟶4NO+6H2O4NH_3 + 5O_2 longrightarrow 4NO + 6H_2O4NH3+5O2⟶4NO+6H2O
2NO+O2⟶2NO22NO + O_2 longrightarrow 2NO_22NO+O2⟶2NO2
4NO2+O2+2H2O⟶4HNO34NO_2 + O_2 + 2H_2O longrightarrow 4HNO_34NO2+O2+2H2O⟶4HNO3
Применение
- Производство минеральных удобрений (нитратов);
- органический синтез (получение нитроалканов, анилиза, нитроцеллюлоз, тринитротолуола);
- производство лекарственных средств (нитроглицерин);
- военная промышленность (производство взрывчатых веществ, в качестве окислителя ракетного топлива, синтез отравляющих веществ);
- травление печатных форм в станковой графике;
- ювелирное дело (определение золота в сплаве).
Тест по теме «Азотная кислота»
Источник
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары
желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной
кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.

Получение
В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
NH3 + O2 → (кат. Pt) NO + H2O
NO + O2 → NO2
NO2 + H2O + O2 → HNO3
Чистая азотная кислота впервые была получена действием на селитру концентрированной серной кислоты:
KNO3 + H2SO4(конц.) → KHSO4 + HNO3↑
Химические свойства
- Кислотные свойства
- Термическое разложение
- Реакции с неметаллами
- Реакции с металлами
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии
выпадения осадка, выделения газа или образования слабого электролита.
CaO + HNO3 → Ca(NO3)2 + H2O
HNO3 + NaOH → NaNO3 + H2O
Na2CO3 + HNO3 → NaNO3 + H2O + CO2↑

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в
темном месте.
HNO3 → (hv) NO2 + H2O + O2
Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2,
если разбавленная – до NO.
HNO3(конц.) + C → CO2 + H2O + NO2
HNO3(конц.) + S → H2SO4 + NO2 + H2O
HNO3(разб.) + S → H2SO4 + NO + H2O
HNO3(конц.) + P → H3PO4 + NO2 + H2O

В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой
именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием
нитрата и преимущественно NO2.
Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2,
NO, N2O, атмосферный газ N2, NH4NO3.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка
с азотной кислотой в различных концентрациях.
Zn + HNO3(70% – конц.) → Zn(NO3)2 + NO2 + H2O
Zn + HNO3(35% – ср. конц.) → Zn(NO3)2 + NO + H2O
Zn + HNO3(20% – разб.) → Zn(NO3)2 + N2O + H2O

Zn + HNO3(10% – оч. разб.) → Zn(NO3)2 + N2 + H2O
Zn + HNO3(3% – оч. разб.) → Zn(NO3)2 + NH4NO3 + H2O
Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.

Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит
за счет оксидной пленки, которой покрыты данные металлы.
Al + HNO3(конц.) ⇸ (реакция не идет)
При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так
как оксидная пленка на поверхности металлов разрушается.
Al + HNO3 → (t) Al2O3 + NO2 + H2O
Соли азотной кислоты – нитраты NO3-
Получение
Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
Fe + HNO3(разб.) → Fe(NO3)2 + NH4NO3 + H2O
В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
MgO + HNO3 → Mg(NO3)2 + H2O
Cr(OH)3 + HNO3 → Cr(NO3)3 + H2O

Нитрат аммония получают реакция аммиака с азотной кислотой.
NH3 + HNO3 → NH4NO3
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная
кислота – до +2.
Fe + HNO3(разб.) → Fe(NO3)2 + NH4NO3 + H2O
Fe + HNO3(конц.) → Fe(NO3)3 + NO + H2O
Химические свойства
- Реакции с металлами, основаниями и кислотами
- Разложение нитратов
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате
реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
Hg(NO3)2 + Mg → Mg(NO3)2 + Hg
Pb(NO3)2 + LiOH → Pb(OH)2 + LiNO3
AgNO3 + KCl → AgCl↓ + KNO3

Ba(NO3)2 + Na2SO4 → BaSO4 + NaNO3
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.

Pb(NO3)2 → (t) PbO + NO2 + O2
NaNO3 → (t) NaNO2 + O2
Cu(NO3)2 → (t) CuO + NO2 + O2
PtNO3 → (t) Pt + NO2 + O2

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
СПЕЦИФИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Азотная
кислота – сильный окислитель
N+5
→ N+4→ N+2→ N+1→ No →N-3
N+5
+ 8e–→N-3
окислитель, восстанавливается
1.
Разлагается на свету и при нагревании
4HNO3 t˚C→ 2H2O + 4NO2
+ O2
Образуется бурый газ
2.
Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук –
“ксантопротеиновая реакция”)
3.
Реагирует с металлами.
В зависимости от концентрации кислоты и
положения металла в электрохимическом ряду напряжений Н. Бекетова могут
образовываться разные азотсодержащие продукты.

При взаимодействии с металлами никогда
не выделяется водород
HNO3 + Me = соль + H2O + Х
Щелочные и щелочноземельные | Fe, Cr, Al, | Металлы до водорода | Металлы после водорода (Cu и др) | Благородные Au, Pt, Os, Ir, Ta | |
HNO3 | N2O | пассивация (при обычных условиях); NO2 (при нагревании) | NO2 | NO2 | Нет реакции |
HNO3 | NH3, | Основной NO, но в зависимости от | NO | ||
Таблица. Продукты реакции взаимодействия азотной
кислоты с металлами
Взаимодействие меди с азотной
кислотой

Упрощенная
схема
«Продукты реакции взаимодействия азотной
кислоты с металлами»
Царская водка: V(HNO3)
: V(HCl) = 1 : 3 растворяет
благородные металлы.
HNO3 + 4HCl + Au
= H[AuCl4]
+ NO + 2H2O
4HNO3 + 18HCl + 3Pt = 3H2[PtCl6] + 4NO
+ 8H2O
4.
Реагирует с неметаллами.
Азотная кислота превращается в NO (или в
NO2); неметаллы окисляются до соответствующих кислот:
Видео “Взаимодействие азотной кислоты с углем”
S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
B0 + 3HNO3 → H3B+3O3
+ 3NO2
3P0 + 5HNO3 + 2H2O → 5NO + 3H3P+5O4
HNO3 (конц.)
+ неметалл = окисление неметалла до кислоты в высшей степени окисления + NO2 +
вода
HNO3(разбав.) + неметалл +
вода = окисление неметалла до кислоты в высшей степени окисления + NO
ВИДЕО – ЭКСПЕРИМЕНТЫ
Видео – Эксперимент ” Индикаторы в
азотной кислоте”
Видео – Эксперимент “Действие
азотной кислоты на белки”
Видео – Эксперимент “Действие
азотной кислоты на бумагу и солому”
Видео – Эксперимент “Взаимодействие
меди с азотной кислотой”
Видео – Эксперимент “Свойства
азотной кислоты”
Видео – Эксперимент “Взаимодействие
азотной кислоты с металлами”
Видео – Эксперимент “Взаимодействие
безводной азотной кислоты с белым фосфором”
Видео – Эксперимент “Взаимодействие
безводной азотной кислоты с углем”
Видео – Эксперимент “Взаимодействие
безводной азотной кислоты со скипидаром”
Видео – Эксперимент “Окислительные
свойства азотной кислоты”
Тренажёр “Взаимодействие азотной
кислоты с металлами”
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществите
превращения по схеме, назовите вещества, для УХР со * составить ОВ баланс, а
для** разбор РИО:
NH4Cl**→ NH3* → N2 → NO → NO2
→ HNO3 → NO2
№2. Осуществить превращения по схеме
(внимательно посмотрите, куда направлены стрелки):
Соль аммония←Аммиак←Нитрид Лития ←Азот →
Оксид азота (II)←Азотная кислота
Для ОВР составить е-баланс, для РИО
полные, ионные уравнения.
№3. Напишите уравнения реакций взаимодействия
азотной кислоты со следующими веществами в молекулярном и ионном виде:
a) Al2O3
б) Ba(OH)2
в) Na2S
№4. Запишите уравнения, составьте
электронный баланс, укажите процессы окисления и восстановления, окислитель и
восстановитель:
А) Сa + HNO3 (конц.)
Б) Сa + HNO3 (paзбавл.)
№5. Осуществите переход по ссылке,
изучите информацию на странице и посмотрите видео , нажмите “посмотреть
опыт”.
Напишите в молекулярном и ионном виде уравнения реакций, с помощью которых
можно различить азотную, серную и соляную кислоту.
Это интересно:
“Фотохимический смог”
Источник
