Какие свойства проявляет хлор в соединении kclo3

Кислородсодержащие
соединения хлора
HClO – хлорноватистая кислота. Ей
соответствует кислотный оксид Cl2O. Соли называются
гипохлоритами.
HClO2 – хлористая кислота.
Кислотный оксид Cl2O3 не получен. Соли – хлориты.
HClO3 – хлорноватая кислота. Кислотный
оксид Cl2O5 не получен. Соли – хлораты.
HClO4– хлорная кислота. Кислотный оксид –
Cl2O7. Соли – перхлораты.
1) HClO – желтоватая жидкость.
Существует только в растворах. Получается при взаимодействии хлора с водой (без
нагревания):
Cl2 + H2O
= HCl + HClO
Соли этой кислоты получаются при
действии на щелочь хлора:
2KOH + Cl2 =холод=
KClO + KCl + H2O
используется как отбеливатель в
текстильной промышленности.
2) HClO2, HClO3 –
не имеют ангидридов (кислотных оксидов). Соли этих кислот применяют в
пиротехнике и взрывных работах. Наибольшее значение имеет KClO3 – хлорат
калия (бертолетова соль), получаемая насыщением горячей щелочи хлором:
3Cl2 +
6KOH =t= KClO3 + 5KCl + 3H2O
Хлораты – сильнейшие окислители.
При ударе или нагревании взрываются.
3) Известен оксид ClO2,
который можно получить по реакции:
2KClO3 +
H2C2O4 = K2CO3 +
CO2
+ H2O + 2ClO2
ClO2 –
зелено-желтый газ, при растворении в воде дает смесь кислот:
2ClO2 + H2O
= HClO2 + HClO3
4) Осторожным нагреванием хлораты
можно перевести в перхлораты, из которых можно получить хлорную кислоту:
KClO4 + H2SO4 =
HClO4 + KHSO4
Хлорная кислота HClO4 – подвижная
жидкость, очень взрывоопасная, самая сильная из всех известных кислот. Почти
все ее соли хорошо растворимы в воде.
5) В ряду: HClO → HClO2 →
HClO3 → HClO4 сила кислот растет, а
окислительная способность падает.
Кислородные
соединения галогенов
Галогены с кислородом
непосредственно не реагируют. Но кислородсодержащие кислоты галогенов (кроме
фтора) могут быть получены как продукты реакций диспропорционирования хлора,
брома и йода с водой и щелочами. При
взаимодействии хлора с водой часть растворенного хлора переходит в кислоту НСlO, называемую хлорноватистой
кислотой. В этой молекуле хлор в степени окисления + 1 связан с
кислородом:

Хлорноватистая кислота известна
только в водном растворе. Это неустойчивое вещество претерпевает различные
превращения. На свету кислород отщепляется от хлора:
HClO
-hν→ HCl + O
В момент образования кислород в
виде отдельных атомов очень активен, вследствие чего раствор проявляет сильное
окислительное действие. При отнятии воды, например, действием безводного
хлорида кальция, из сильно охлажденного раствора выделяется оксид хлора (I), Сl2O, в виде красно-бурой жидкости с
температурой кипения +3,8°С. Это тоже неустойчивое вещество, способное
взрываться. Растворяясь в воде, он снова образует хлорноватистую кислоту. При
нагревании раствора НСlO
происходит более глубокое диспропорционирование хлора с переходом в степень
окисления +5:
3HClO = 2HCl + HClO3
Образующееся кислородсодержащее
соединение называется хлорноватой кислотой. Это более
устойчивое соединение, сильная кислота, образующая растворы с массовой долей до
40%. Под действием серной кислоты хлорноватая кислота диспропорционирует,
образуя еще два новых соединения хлора:
3HCl+5O3
= HCl+7O4 + 2Cl+4O2 + H2O
Хлорная кислота НСlO4 содержит хлор в высшей
степени окисления +7. Второй продукт реакции оксид хлора (IV) содержит хлор в необычной для
него степени окисления +4. Хлор в этом состоянии имеет неспаренный электрон.
Это также неустойчивое, взрывчатое соединение хлора. В водном растворе СlO2 диспропорционирует на две
кислоты — хлорноватую и хлористую. В последней степень
окисления хлора +3:
2ClO2+H2O = HClO3 + HClO2
Таким образом, в рассмотренных
реакциях показано образование четырех кислородсодержащих кислот хлора,
образующих ряд с возрастающими нечетными степенями окисления и валентностями
хлора от +1 до +7 (табл.). В этом ряду наблюдается последовательное и резкое
возрастание силы кислот от очень слабой хлорноватистой до одной из самых
сильных хлорной. Усиление кислот в этом ряду связано с увеличением числа атомов
кислорода, соединенных с хлором двойными связями. Это способствует
делокализации заряда аниона, что затрудняет присоединение к нему иона водорода
с образованием молекулы кислоты.
Таблица.
Кислородсодержащие
кислоты хлора
Свойство | Формула | |||
HClO | НСlO2 | НСlO3 | НСlO4 | |
| ||||
Степень окисления хлора | + 1 | +3 | +5 | +7 |
Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
Название солей | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Все четыре кислоты являются
сильными окислителями, по силе превосходящими хлор. Вместе с тем, как очевидно
из протекания многочисленных реакций, окислительная активность резко падает в
ряду от HClO
к НСlO4. Например, хлорноватистая кислота
моментально выделяет йод из раствора йодида калия, а разбавленная хлорная
кислота с раствором КI
практически не реагирует. Хлорноватистая кислота и ее соли обесцвечивают
органические красители, в то время как хлорная кислота окисляющего действия на
них не оказывает. Таким образом, увеличение числа атомов кислорода, окружающих
атом хлора, способствует стабилизации как молекул кислот, так и анионов их
солей. Повышение устойчивости проявляется и в том, что из четырех кислот только
хлорная может быть получена в безводном состоянии.
Находящие практическое применение
соли хлорноватистой и хлорноватой кислот получаются взаимодействием хлора с
растворами щелочей. Гипохлорит калия КСlO служит отбеливающим средством. Он
получается пропусканием хлора в раствор гидроксида калия. Одновременно
образуется хлорид калия:
Cl2+2KOH
=холод=KClO+KCl+H2O
Этот раствор называется жавелевой
водой (Javel — местечко около Парижа, где впервые стали
изготовлять эту воду в 1792 году — раствор солей калия
хлорноватистой и соляной кислот KOCl + KCl). Кислота НСlO настолько слабая, что вытесняется
из соли под действием углекислого газа:
KClO
+ CO2 + H2O = KHCO3 + HClO
Эта кислота и обесцвечивает
красители.
Как активные окислители гипохлориты
нашли применение в медицине. Они проявляют дезинфицирующее, антисептическое,
противомикробное действие. Гипохлорит натрия NаСlO применяется в растворе с массовой
долей 0,06% для промывания ран, при операциях па грудной клетке, брюшной или
плевральной полостях. Выпускается раствор гипохлорита натрия и для инъекций.
Взаимодействием хлора с другой
щелочью — гидроксидом кальция в отсутствие воды получается практически важный
продукт хлорная известь. Это белый порошок, иногда серый или
желтоватый от присутствия примесей, пахнущий хлором. В составе хлорной извести
имеются СаС2, Са(СlO)2,
Са(ОН)2 и вода. Часто хлорную известь представляют, как
смешанную соль с двумя разными анионами: СаСl(СlO). Хлорная известь реагирует даже
со слабыми кислотами с выделением хлора:
СаСl(СlO) + CO2
=H2O= CaCO3 + Cl2↑
Выделяющийся хлор реагирует с
органическими веществами, в результате чего, в частности, гибнут
микроорганизмы. Поэтому хлорная известь широко применяется в санитарных целях.
Она применяется также для отбеливания бумаги и тканей и для лабораторного
получения хлора.
Пропусканием хлора в горячий
раствор гидроксида калия получают смесь двух солей — хлорида калия КCl и хлората калия КСlO3.
3Cl2 +
6KOH =t= KClO3 + 5KCl + 3H2O
При охлаждении раствора хлорат
калия начинает кристаллизоваться. При 20°С его растворимость составляет 7,4 г
на 100 г воды, в то время как растворимость хлорида калия равна 34 г. Хлорат
калия называют бертолетовой солью, так как он был впервые получен
К. Бертолле. Бертолетову соль предполагалось использовать в составе пороха
взамен селитры, но при испытаниях быстрая детонация такого пороха приводила к
разрыву пушечных стволов. Вместо этого бертолетова соль нашла широкое
применение в качестве окислителя в составах для фейерверков. Она является также
окисляющей составной частью спичечной головки. Кислород, отщепляющийся от хлора
в хлорате калия, в твердых смесях окисляет уголь, серу, фосфор, органические
вещества. Реакции сопровождаются яркими вспышками. Напишем реакцию сгорания
сахарозы:
C12H22O11+8KClO3
= 12CO2 +11H2O + 8KCl + 5647 кДж/моль
При нагревании хлорат калия и
другие соли кислородсодержащих кислот хлора разлагаются с выделением кислорода.
Разложение хлората калия ускоряется в присутствии оксида марганца(IV):
2KClO3
=MnO2= 3O2 + 2KCl
При нагревании бертолетовой соли
без катализатора происходит диспропорционирование хлора с образованием
перхлората калия:
4KClO3
=t=400C= 3KClO4 + KCl
При еще более сильном нагревании до
~520°С перхлорат калия тоже разлагается, выделяя кислород. Относительно высокая
термическая устойчивость перхлоратов и устойчивость их в растворах характерна и
для других солей с анионами, в которых центральный атом окружен четырьмя
атомами кислорода. Такие анионы имеют тетраэдрическое строение, а π-связи в них
полностью делокализованы.

Рисунок. Строение анионов кислородсодержащих кислот хлора
Кислородные соединения брома менее
устойчивы по сравнению с кислородными соединениями хлора. Оксид брома Вг2O разлагается уже при температуре
плавления -17°С. Свободный бром реагирует со щелочью при нагревании аналогично
хлору:
3Br2 +
6KOH =t= KBrO3 + 5KBr + 3H2O
Бромат натрия NaВrO3 применяется как окислитель в
аналитической химии. Например, по реакции с броматом калия определяют оксид
мышьяка (III):
3As2O3
+ 2KBrO3 + 9H2O = 6H3AsO4 +
2KBr
Бром трудно окислить до степени
окисления +7. До 1970 г. соли бромной кислоты НВrO4 не были получены, и в
учебниках иногда давались объяснения, почему они не существуют. Впервые
пербромат натрия был получен по реакции
NaBrO3
+ F2 + 2NaOH = NaBrO4 + 2NaF + H2O
Кислородные соединения йода более
устойчивы по сравнению с другими галогенами. В щелочном растворе йод диспропорционирует
аналогично брому. При пропускании хлора в водную суспензию йода образуется
йодноватая кислота:
I2
+ 5Cl2 + 6H2O = 2HIO3 + 10HCl
Из раствора йодноватая кислота
выделяется в виде устойчивого кристаллического вещества. При ее обезвоживании
получается оксид 12О5, устойчивый при обычных условиях. Он нашел применение для
анализа воздуха на присутствие оксида углерода(И). Анализ основан на реакции, сопровождающейся
выделением йода: 5СO
+ I2O5 = I2 + 5CO2
Известна также йодная кислота НIO4, которая может быть получена
действием хлорной кислоты на йод:
2HClO4 + I2 = 2HIO4 + Cl2
После испарения воды из раствора
йодной кислоты получаются бесцветные кристаллы НIO4*2Н2O. Из химических свойств этого
вещества следует, что все атомы кислорода связаны непосредственно с йодом, и
вещество представляет собой ортойодную кислоту Н5IO6.
Как известно, в группах (главных
подгруппах) усиливается металличность при переходе в группе сверху вниз. В
группе галогенов находятся элементы, наиболее далекие по свойствам от металлов.
И все же у тяжелого элемента йода проявляются признаки металличности. Черные
кристаллы йода имеют слабый металлический блеск, а электрическое сопротивление
значительно ниже, чем у такого типичного неметалла, как сера. Йод, подобно
металлам, может входить в состав вещества в качестве катиона. Неустойчивый
катион I+ может быть стабилизирован
образованием комплексного иона с органическими молекулами. При реакции йода с
нитратом серебра в присутствии пиридина С5Н5N образуется комплексный ион такого
типа:
I2+AgNO3+2С5Н5N
= [I(С5Н5N)2]NO3
+ AgI↓
Кислородные соединения фтора
интересны тем, что фтор является единственным элементом, по
электроотрицательности превосходящим кислород. Поэтому простейшее из этих
соединений ОF2 следует называть не оксидом
фтора, а фторидом кислорода. Это газообразное вещество получается при действии
фтора на 2%-ный раствор гидроксида натрия:
2F2 + 2NaOH = 2NaF + OF2↑+H2O
Своим угловым строением молекула
фторида кислорода напоминает молекулу воды, но их дипольные моменты µ направлены противоположно:

Фторид кислорода термодинамически
неустойчив, при t
> 200°С распадается
на кислород и фтор. Есть и более сложные по составу фториды кислорода.
Фтор, так же, как и кислород, не
проявляет высокой валентности, соответствующей номеру группы, так как не имеет
энергетически доступных свободных орбиталей для перехода в возбужденное
состояние.
Источник
Основаны на процессе окисления анионов Cl-
2Cl– 2e- = Cl20
Электролиз водных растворов хлоридов, чаще – NaCl:
2NaCl + 2Н2O = Cl2↑ + 2NaOH + H2↑
Окисление конц. HCI различными окислителями:
4HCI + MnO2 = Cl2↑ + МпCl2 + 2Н2O
16НСl + 2КМпО4 = 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2O
6HCl + КСlO3 = ЗCl2↑ + KCl + 3Н2O
14HCl + К2Сr2O7 = 3Cl2↑ + 2CrCl3 + 2KCl + 7Н2O
Хлор – очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl-:
Cl20+ 2e- = 2Cl-
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Примеры:
Cl2+ 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Примеры:
Cl2 + Сu = CuCl2
3Cl2 + 2Аu = 2AuCl3
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Примеры:
Cl2 + Н2 =2НС1
Cl2 + 2S (расплав) = S2Cl2
ЗCl2 + 2Р = 2РCl3 (или РCl5 — в избытке Cl2)
2Cl2 + Si = SiCl4
3Cl2 + I2 = 2ICl3
Примеры:
Cl2 + 2KBr = Br2 + 2KCl
Cl2 + 2KI = I2 + 2KCl
Cl2 + 2HI = I2 + 2HCl
Cl2 + H2S = S + 2HCl
ЗСl2 + 2NH3 = N2 + 6HCl
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl-, а другие в положительной степени окисления входят в состав анионов ClO- или ClO3-.
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Cl2 + 2КОН =KCl + KClO + Н2O
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2O
3Cl2 + 2Са(ОН)2 = CaCl2 + Са(ClO)2+ 2Н2O
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 – гипохлориты; КClO3 – хлорат калия (бертолетова соль).
а) замещение атомов водорода в молекулах ОВ
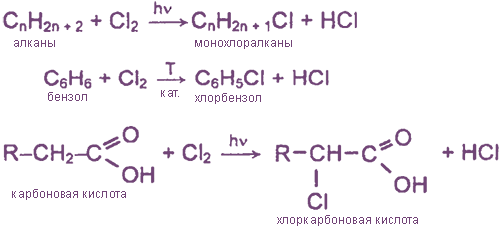
б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
H2C=CH2 + Cl2 → ClH2C-CH2Cl 1,2-дихлорэтан
HC≡CH + 2Cl2 → Cl2HC-CHCl2 1,1,2,2-тетрахлорэтан
Хлороводород и соляная кислота
HCl – хлорид водорода. При об. Т – бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F2 = Сl2 + 2HF
4HCl + O2 = 2Сl2 + 2Н2O
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
1. Синтез из простых веществ:
Н2 + Cl2 = 2HCl
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется ~ 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н+
HCl → H+ + Cl-
Взаимодействие:
а) с металлами (до Н):
2HCl2 + Zn = ZnCl2 + H2
б) с основными и амфотерными оксидами:
2HCl + CuO = CuCl2 + Н2O
6HCl + Аl2O3 = 2АlCl3 + ЗН2O
в) с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН)2 = CaCl2 + 2Н2О
3HCl + Аl(ОН)3 = АlСl3 + ЗН2O
г) с солями более слабых кислот:
2HCl + СаСО3 = CaCl2 + СO2 + Н3O
HCl + C6H5ONa = С6Н5ОН + NaCl
д) с аммиаком:
HCl + NH3 = NH4Cl
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl-окисляется до свободного галогена:
2Cl– 2e- = Cl20
Уравнения реакция см. “Получение хлора”. Особое значение имеет ОВР между соляной и азотной кислотами:
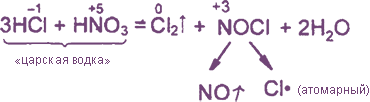
Взаимодействие:
а) с аминами (как органическими основаниями)
R-NH2 + HCl → [RNH3]+Cl-
б) с аминокислотами (как амфотерными соедимнеиями)

Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора – чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.


гипохлориты | хлориты | хлораты | перхлораты |
NaClOKClOCa(ClO)2 | Ca(ClO2)2 | KClO3 бертолетова сольMg(ClO3)2 | KClO4NaClO4NH4ClO4 |
1. Все оксокислоты хлора и их соли являются сильными окислителями.
2. Почти все соединения при нагревании разлагаются за счет внутримолекулярного окисления-восстановления или диспропорционирования.
Примеры:

Хлорная известь
Хлорная (белильная) известь – смесь гипохлорита и хлорида кальция, обладает отбеливающим и дезинфицирующим действием. Иногда рассматривается как пример смешанной соли, имеющей в своем составе одновременно анионы двух кислот:

Жавелевая вода
Водный раствор хлорида и гапохлорита калия KCl + KClO + H2O
Источник
Продолжение. Cм. в № 22/2005;
1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006;
3, 4, 7, 10, 11, 21/2007;
2, 7, 11, 18, 19, 21/2008;
1, 3/2009
ЗАНЯТИЕ 29
10-й класс (первый год обучения)
Галогены и их важнейшие соединения
П л а н
 1.
1.
Положение в таблице Д.И.Менделеева, строение
атома.
2. Происхождение названий.
3. Физические свойства.
4. Химические свойства (на примере хлора).
5. Нахождение в природе.
6. Основные методы получения (на примере хлора).
7. Хлороводород и хлориды.
8. Kислородсодержащие кислоты хлора и их соли.
Галогены («солероды») расположены в VIIа
подгруппе периодической системы. K ним относятся
фтор, хлор, бром, йод и астат. Все галогены
относятся к р-элементам, имеют конфигурацию
внешнего энергетического уровня ns2p5.
Поскольку на внешнем уровне атомов галогенов
находится 1 неспаренный р-электрон,
характерная валентность равна I. Kроме фтора, у
атомов всех галогенов в возбужденном состоянии
может увеличиваться число неспаренных
электронов, поэтому возможны валентности III, V и
VII.

Cl: 1s22s22p63s23p53d
(валентность I),
Cl*: 1s22s22p63s23p43d1
(валентность III),
Cl**: 1s22s22p63s23p33d2
(валентность V),
Cl***: 1s22s22p63s13p33d3
(валентность VII).
Галогены являются типичными неметаллами,
проявляют окислительные свойства. Степень
окисления галогенов в соединениях с металлами и
водородом –1; во всех кислородсодержащих
соединениях галогены (кроме фтора) проявляют
степени окисления +1, +3, +5, +7, например:
![]()
Вниз по подгруппе изменяется агрегатное
состояние галогенов, уменьшается растворимость
в воде, увеличивается радиус атома, уменьшаются
электроотрицательность, неметаллические
свойства и окислительная способность (фтор –
самый сильный окислитель). Для соединений
галогенов: от Cl– к I– увеличивается
восстановительная способность галогенид-ионов.
В ряду бескислородных и кислородсодержащих
кислот происходит усиление кислотных свойств:

Название фтора произошло от греческого слова ![]() – разрушающий,
– разрушающий,
поскольку плавиковая кислота, из которой
пытались получить фтор, разъедает стекло. Хлор
получил свое название благодаря окраске от
греческого слова ![]() –
–
желто-зеленый – цвет увядающей листвы. Бром
назван по запаху жидкого брома от греческого
слова ![]() –
–
зловонный. Название йода произошло от греческого
слова ![]() –
–
фиолетовый – по цвету парообразного йода.
Радиоактивный астат назван от греческого слова ![]() – неустойчивый.
– неустойчивый.
По ф и з и ч е с к и м с в о й с т в а м
фтор – трудносжижаемый газ светло-зеленого
цвета, хлор – легко сжижающийся газ
желто-зеленого цвета, бром – тяжелая жидкость
красно-бурого цвета, йод – твердое
кристаллическое вещество темно-фиолетового
цвета с металлическим блеском, легко
подвергается возгонке (сублимации). Все галогены,
кроме йода, обладают резким удушливым запахом,
токсичны.
Х и м и ч е с к и е с в о й с т в а
Все галогены проявляют высокую химическую
активность, которая уменьшается при переходе от
фтора к йоду. Химические свойства галогенов
рассмотрим на примере хлора:
Н2 (+):
![]()
(F2 – со взрывом; Br2, I2 –
на свету и при повышенной температуре.)
О2 (–).
Металлы (+):
2Na + Cl2 = 2NaCl;
2Fe + 3Cl2 2FeCl3.
Неметаллы (+/–):*

N2 + Cl2 реакция не идет.
Н2О (+):

Основные оксиды (–).
Kислотные оксиды (–).
Основания (+/–):

Kислоты (+/–):
2HBr + Cl2 = 2HCl + Br2,
HCl + Br2
реакция не идет.
Соли (+/–):
2KBr + Cl2 = 2KCl + Br2,
KCl + Br2
реакция не идет.
В п р и р о д е в свободном виде галогены не
встречаются из-за высокой химической активности.
Среди наиболее распространенных соединений
хлора можно выделить каменную или поваренную
соль (NaCl), сильвинит (KCl•NaCl), карналлит (KCl•MgCl2).
Большое количество хлоридов содержится в
морской воде. Хлор входит в состав хлорофилла.
Природный хлор состоит из двух изотопов 35Cl
и 37Cl. Подчеркнем, что в случае хлора число
нейтронов в атоме возможно рассчитать только для
каждого изотопа в отдельности:
35Cl, p = 17, e = 17, n = 35 – 17 = 18;
37Cl, p = 17, e = 17, n = 37 – 17 = 20.
В п р о м ы ш л е н н о с т и хлор получают
электролизом водного раствора или расплава
хлорида:

Л а б о р а т о р н ы е м е т о д ы получения
(действие концентрированной соляной кислоты на
различные окислители):
MnO2 + 4HCl (конц.) = MnCl2 + Cl2 + 2H2O,
2KMnO4 + 16HCl (конц.) = 2MnCl2 + 5Cl2 + 2KCl + 8H2O,
KClO3 + 6HCl (конц.) = KCl + 3Cl2 + 3H2O,
K2Cr2O7 + 14HCl (конц.) = 2CrCl3
+ 3Cl2 + 2KCl + 7H2O,
Ca(ClO)2 + 4HCl (конц.) = CaCl2 + 2Cl2 + 2H2O.
Х л о р о в о д о р о д и х л о р и д ы
Хлороводород (HCl) – бесцветный газ с
резким запахом, тяжелее воздуха, хорошо
растворим в воде (в 1 объеме воды растворяется 450
объемов хлороводорода). Молекула образована по
типу ковалентной полярной связи. Водный раствор
хлороводорода называется соляной кислотой.
Kонцентрированная соляная кислота «дымит» на
воздухе, максимальная концентрация
хлороводорода в растворе составляет 35–36 %. Это
сильная кислота, проявляющая все характерные
свойства кислот:
HCl H+ + Cl–,
2HCl + Zn = ZnCl2 + H2,
HCl + Cu реакция
не идет,
2HCl + CaO = CaCl2 + H2O,
HCl + NaOH = NaCl + H2O,
2HCl + Na2CO3 = 2NaCl + H2O + CO2.
Kачественной реакцией на соляную кислоту и ее
соли (хлориды) является реакция с раствором
нитрата серебра:
Ag+ + Cl– —> AgCl,
AgNO3 + NaCl —> AgCl + NaNO3.
Хлороводород можно получить:
• прямым синтезом из водорода и хлора
(синтетический способ):
![]()
• действием концентрированной серной кислоты
на твердые хлориды – сульфатный способ
(аналогично можно получить HF, но нельзя получить
HBr и HI):
NaCl (тв.) + H2SO4 (конц.) = HCl + NaHSO4.
С ростом степени окисления хлора сила кислот
резко возрастает. Так, хлорноватистая кислота
очень слабая (слабее угольной), а хлорная
кислота – самая сильная из всех известных
кислот.
K и с л о р о д с о д е р ж а щ и е к и с л
о т ы х л о р а и и х с о л и
Хлорноватистая кислота (HClO) –
слабая, очень неустойчивая.

Соли этой кислоты (гипохлориты) являются очень
сильными окислителями. Наибольшее применение
находит смешанная соль соляной и хлорноватистой
кислот – хлорид-гипохлорит кальция (хлорная
известь):

Хлорноватая кислота (HClO3) –
существует только в разбавленных растворах. Сама
кислота и ее соли (хлораты) являются сильными
окислителями. Наиболее известной солью этой
кислоты является хлорат калия (бертолетова соль).
5KClO3 + 6P = 3P2O5 + 5KCl,
KClO3 + 3MnO2 + 6KOH = KCl + 3K2MnO4
+ 3H2O,
4KClO3 + 3K2S = 4KCl + 3K2SO4.
Многие соли кислородсодержащих кислот хлора
термически неустойчивы, например:
2KClO3![]() 2KCl + 3O2,
2KCl + 3O2,
4KClO3 3KClO4
+ KCl (без катализатора),
3KClO KClO3 +
2KCl,
KClO4 KCl + 2O2.
Тест по теме «Галогены и их
важнейшие соединения»
 1.
1.
Газ имеет плотность 3,485 г/л при давлении 1,2 атм и
температуре 25 °С. Установите формулу газа.
а) Фтор; б) хлор;
в) бромоводород;
г) хлороводород.
2. Явление перехода вещества из твердого
состояния в газообразное, минуя жидкое,
называется:
а) конденсация; б) сублимация;
в) возгонка; г) перегонка.
3. Природный хлор представляет собой смесь
изотопов с массовыми числами 35 и 37. Рассчитайте
изотопный состав хлора, приняв его относительную
атомную массу за 35,5.
а) 75 % и 25 %;
б) 24,4 % и 75,8 %;
в) 50 % и 50 %;
г) недостаточно данных для решения задачи.
4. Хлор можно получить, проводя электролиз:
а) расплава хлорида калия;
б) раствора хлорида калия;
в) расплава хлорида меди;
г) раствора хлорида меди.
5. Раствор фтороводорода в воде называют:
а) жавелевой водой;
б) плавиковой кислотой;
в) белильной известью;
г) фтороводородной кислотой.
6. Оксид хлора(V) является ангидридом
следующей кислоты:
а) хлорноватистой; б) хлорноватой;
в) хлористой; г) хлорной.
7. При прокаливании бертолетовой соли в
присутствии диоксида марганца в качестве
катализатора образуются:
а) хлорид калия и кислород;
б) перхлорат калия и хлорид калия;
в) перхлорат калия и озон;
г) гипохлорит калия и хлор.
8. K подкисленному раствору, содержащему 0,543
г некоторой соли, в состав которой входят литий,
хлор и кислород, добавили раствор йодида натрия
до прекращения выделения йода. Масса
выделившегося йода составила 4,57 г. Название
исходной соли:
а) гипохлорит лития; б) хлорит лития;
в) хлорат лития; г) перхлорат лития.
9. В молекулах галогенов химическая связь:
а) ковалентная полярная;
б) ковалентная неполярная;
в) ионная;
г) донорно-акцепторная.
10. Хлор, в отличие от фтора, при
определенных условиях может реагировать с:
а) водой; б) водородом;
в) медью; г) гидроксидом натрия.
Kлюч к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| б | б, в | а | а, б, в, г | б, г | б | а | в | б | г |
Задачи и упражнения на галогены и их
соединения
Ц е п о ч к и п р е в р а щ е н и й
 1.
1.
Хлорид калия —> хлор —> хлороводород —>
хлорид кальция —> хлороводород —> хлор —>
хлорат калия.
2. Хлор —> бертолетова соль —> хлорид
калия —> соляная кислота + диоксид марганца +
вода —> хлор —> хлорид меди(II) —> хлор.
3. Хлорид калия —> хлор —> хлорат калия
—> хлорид калия —> калий.
4. Хлорид калия —> хлор —> хлороводород
—> хлор —> гипохлорит калия.
5. Хлорид натрия —> хлороводород —> хлор
—> бертолетова соль —> хлорид калия —>
гидроксид калия —> гипохлорит калия.
6. Хлорат калия —> А —> В—> С —> А —>
нитрат калия (вещества А, В, С содержат хлор,
первые три превращения –
окислительно-восстановительные реакции).
7. Оксид кальция —> гидроксид кальция —>
белильная известь —> хлорид кальция —>
кальций.
8. Бромид натрия —> хлорид натрия —> хлор
—> хлорная известь —> карбонат кальция —>
гидрокарбонат кальция —> углекислый газ.
9. Йодид натрия —> йод —> йодид калия —>
йодид серебра.
10. Гипохлорит калия —> хлорат калия —>
перхлорат калия —> хлорид калия.
1. Сосуд с 200 г хлорной воды
выдержали на прямом солнечном свету и собрали
выделившийся газ, объем которого при н.у.
составил 0,18 л. Определите состав хлорной воды
(массовую долю хлора).
Ответ. 0,57 %.
2. Газ, полученный прокаливанием 9,8 г
бертолетовой соли, смешан с газом, полученным на
аноде в результате полного электролиза расплава
22,2 г хлорида кальция. Полученную смесь газов
пропустили через 400 г 2%-го горячего раствора
гидроксида натрия. Определите состав
полученного раствора.
Ответ. 2,38 % NaCl; 0,84 % NaClO3.
3. Рассчитать массу соли и объем газа (н.у.),
образовавшихся при разложении 17 г соли,
окрашивающей пламя горелки в желтый цвет и
содержащей 27,06 % металла, 16,47 % азота и 56,47 %
кислорода. Kакая масса бертолетовой соли
потребуется для получения такого же количества
газа?
Ответ. 13,8 г NaNO2; 2,24 л O2; 8,13
г KClO3.
4. Kакой объем хлора (н.у.) можно получить из 1
м3 раствора (плотность 1,23 г/см3),
содержащего 20,7 % хлорида натрия и 4,3 %
хлорида магния?
Ответ. 61,2 м3.
5. Газ, выделившийся на аноде при
электролизе 200 г 20%-го раствора хлорида натрия,
пропустили через 400 г 30%-го раствора бромида
калия. K полученному раствору добавили избыток
раствора нитрата серебра. Определите
количественный состав выпавшего осадка.
Ответ. 59,4 г AgBr; 98,154 г AgCl.
1. Через трубку с порошкообразной
смесью хлорида и йодида натрия массой 3 г
пропустили 1,3 л хлора при температуре 42 °С и
давлении 101,3 кПа. Полученное в трубке вещество
прокалили при 300 °С, при этом осталось 2 г
вещества. Определите массовые доли солей в
исходной смеси.
Ответ. 45,3 % NaCl; 54,6 % NaI.
2. Смесь йодида магния и йодида цинка
обработали избытком бромной воды, полученный
раствор выпарили. Масса сухого остатка оказалась
в 1,445 раза меньше массы исходной смеси. Во сколько
раз масса осадка, полученного после обработки
такой же смеси избытком карбоната натрия, будет
меньше массы исходной смеси?
Ответ. В 2,74 раза.
3. Для окисления 2,17 г сульфита
щелочно-земельного металла добавили хлорную
воду, содержащую 1,42 г хлора. K полученной смеси
добавили избыток бромида калия, при этом
выделилось 1,6 г брома. Определите состав осадка,
содержащегося в смеси, и рассчитайте его массу.
Решение
Уравнение реакции:
![]()
Далее с избытком KBr из полученной смеси (HCl, MSO4,
избыток Cl2 или избыток MSO3) с
выделением Br2 может реагировать только Cl2:
2KBr + Cl2 = 2KCl + Br2, (2)
(Br2)
= m(Br2)/M(Br2) = 1,6/160 = 0,01 моль.
По уравнению реакции (2):
(Cl2)
= (Br2) = 0,01
моль.
Суммарно в двух реакциях израсходовано хлора:
(Cl2)
= m(Cl2)/M(Cl2) = 1,42/71 = 0,02 моль.
Следовательно, в реакции (1) прореагировало:
0,02 – 0,01 = 0,01 моль Cl2.
По уравнению реакции (1):
(MSO3)
= n(Cl2) = 0,01 моль;
M(MSO3) = m(MSO3)/(MSO3) = 2,17/0,01 = 217 г/моль.
Таким образом, соль, участвующая в реакции, –
сульфит бария BaSO3.
Уравнение реакции (1):
BaSO3 + Cl2 + H2O = 2HCl + BaSO4.
(BaSO4)
= (BaSO3) = 0,01
моль,
m(BaSO4) = (BaSO4)•M(BaSO4) = 0,01•233 = 2,33 г.
Ответ. 2,33 г BaSO4.
4. Через 800 г 10%-го водного раствора хлорида
натрия пропустили ток. После окончания процесса
электролиза соли весь выделившийся на аноде газ
поглотили горячим раствором, получившимся в
результате электролиза. Определите состав
раствора, полученного после поглощения газа.
Ответ. В растворе 8,35 % NaCl и
3,03 % NaClO3.
5. Плотность смеси хлора с водородом при
давлении 0,2 атм и температуре 27 °С равна
0,0894 г/л. Хлороводород, полученный при взрыве 100
л (н.у.) такой смеси, растворили в 500 г 10%-й соляной
кислоты. Найдите массовую долю хлороводорода в
полученном растворе.
Ответ. 17 %.
K а ч е с т в е н н ы е з а д а ч и
1. Назовите вещества А, В и С, если известно,
что они вступают в реакции, описываемые
приведенными ниже схемами; напишите полные
уравнения реакций этих схем:
А + Н2 —> В,
А + Н2О В +
С,
А + Н2О + SО2 —> В + … ,
С —> В + … .
Ответ. Вещества: А – Сl2,
B – HCl; С – HClO.
2. Газ А под действием концентрированной
серной кислоты превращается в простое вещество
В, которое реагирует с сероводородной кислотой с
образованием простого вещества С и раствора
исходного вещества А. Идентифицируйте вещества,
напишите уравнения реакций.
Ответ. Вещества: А – HBr; B – Br2;
С – S.
3. При пропускании хлора через раствор
сильной кислоты А выделяется простое вещество В
и раствор приобретает темную окраску. При
дальнейшем пропускании хлора вещество В
превращается в кислоту С и раствор
обесцвечивается. Назовите вещества А, В и С,
напишите уравнения реакций.
Ответ. Вещества: А – HI; B – I2,
C – HIO3.
4. Приведите примеры реакций, в ходе которых
происходит полное восстановление свободного
брома: а) в кислом водном растворе; б) в щелочном
водном растворе; в) в газовой фазе.
Ответ. Уравнения реакций:


