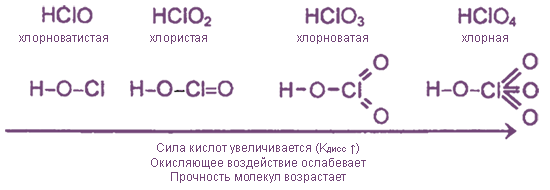
Какие свойства проявляет хлор

Основаны на процессе окисления анионов Cl-
2Cl– 2e- = Cl20
Электролиз водных растворов хлоридов, чаще – NaCl:
2NaCl + 2Н2O = Cl2↑ + 2NaOH + H2↑
Окисление конц. HCI различными окислителями:
4HCI + MnO2 = Cl2↑ + МпCl2 + 2Н2O
16НСl + 2КМпО4 = 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2O
6HCl + КСlO3 = ЗCl2↑ + KCl + 3Н2O
14HCl + К2Сr2O7 = 3Cl2↑ + 2CrCl3 + 2KCl + 7Н2O
Хлор – очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl-:
Cl20+ 2e- = 2Cl-
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Примеры:
Cl2+ 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Примеры:
Cl2 + Сu = CuCl2
3Cl2 + 2Аu = 2AuCl3
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Примеры:
Cl2 + Н2 =2НС1
Cl2 + 2S (расплав) = S2Cl2
ЗCl2 + 2Р = 2РCl3 (или РCl5 — в избытке Cl2)
2Cl2 + Si = SiCl4
3Cl2 + I2 = 2ICl3
Примеры:
Cl2 + 2KBr = Br2 + 2KCl
Cl2 + 2KI = I2 + 2KCl
Cl2 + 2HI = I2 + 2HCl
Cl2 + H2S = S + 2HCl
ЗСl2 + 2NH3 = N2 + 6HCl
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl-, а другие в положительной степени окисления входят в состав анионов ClO- или ClO3-.
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Cl2 + 2КОН =KCl + KClO + Н2O
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2O
3Cl2 + 2Са(ОН)2 = CaCl2 + Са(ClO)2+ 2Н2O
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 – гипохлориты; КClO3 – хлорат калия (бертолетова соль).
а) замещение атомов водорода в молекулах ОВ

б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
H2C=CH2 + Cl2 → ClH2C-CH2Cl 1,2-дихлорэтан
HC≡CH + 2Cl2 → Cl2HC-CHCl2 1,1,2,2-тетрахлорэтан
Хлороводород и соляная кислота
HCl – хлорид водорода. При об. Т – бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F2 = Сl2 + 2HF
4HCl + O2 = 2Сl2 + 2Н2O
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
1. Синтез из простых веществ:
Н2 + Cl2 = 2HCl
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется ~ 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н+
HCl → H+ + Cl-
Взаимодействие:
а) с металлами (до Н):
2HCl2 + Zn = ZnCl2 + H2
б) с основными и амфотерными оксидами:
2HCl + CuO = CuCl2 + Н2O
6HCl + Аl2O3 = 2АlCl3 + ЗН2O
в) с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН)2 = CaCl2 + 2Н2О
3HCl + Аl(ОН)3 = АlСl3 + ЗН2O
г) с солями более слабых кислот:
2HCl + СаСО3 = CaCl2 + СO2 + Н3O
HCl + C6H5ONa = С6Н5ОН + NaCl
д) с аммиаком:
HCl + NH3 = NH4Cl
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl-окисляется до свободного галогена:
2Cl– 2e- = Cl20
Уравнения реакция см. “Получение хлора”. Особое значение имеет ОВР между соляной и азотной кислотами:

Взаимодействие:
а) с аминами (как органическими основаниями)
R-NH2 + HCl → [RNH3]+Cl-
б) с аминокислотами (как амфотерными соедимнеиями)

Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора – чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.

гипохлориты | хлориты | хлораты | перхлораты |
NaClOKClOCa(ClO)2 | Ca(ClO2)2 | KClO3 бертолетова сольMg(ClO3)2 | KClO4NaClO4NH4ClO4 |
1. Все оксокислоты хлора и их соли являются сильными окислителями.
2. Почти все соединения при нагревании разлагаются за счет внутримолекулярного окисления-восстановления или диспропорционирования.
Примеры:
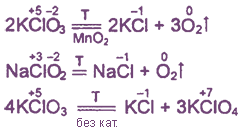
Хлорная известь
Хлорная (белильная) известь – смесь гипохлорита и хлорида кальция, обладает отбеливающим и дезинфицирующим действием. Иногда рассматривается как пример смешанной соли, имеющей в своем составе одновременно анионы двух кислот:

Жавелевая вода
Водный раствор хлорида и гапохлорита калия KCl + KClO + H2O
Источник
Хлор, свойства атома, химические и физические свойства.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Cl 17 Хлор
35,446-35,457* 1s2 2s2 2p6 3s2 3p5
Хлор — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 17. Расположен в 17-й группе (по старой классификации — главной подгруппе седьмой группы), третьем периоде периодической системы.
Атом и молекула хлора. Формула хлора. Строение атома хлора
Изотопы и модификации хлора
Свойства хлора (таблица): температура, плотность, давление и пр.
Физические свойства хлора
Химические свойства хлора. Взаимодействие хлора. Химические реакции с хлором
Получение хлора
Применение хлора
Таблица химических элементов Д.И. Менделеева
Атом и молекула хлора. Формула хлора. Строение атома хлора:
Хлор (лат. Chlorum, от греч. χλωρός – «жёлто-зелёный») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Cl и атомным номером 17. Расположен в 17-й группе (по старой классификации – главной подгруппе седьмой группы), третьем периоде периодической системы.
Хлор – неметалл. Относится к группе галогенов.
Как простое вещество хлор при нормальных условиях представляет собой ядовитый газ желтовато-зелёного цвета, тяжелее воздуха, с резким запахом и сладковатым, «металлическим» вкусом.
Молекула хлора двухатомна.
Химическая формула хлора Cl2.
Электронная конфигурация атома хлора 1s2 2s2 2p6 3s2 3p5. Потенциал ионизации атома хлора равен 13,01 эВ (1254,9 кДж/моль).
Строение атома хлора. Атом хлора состоит из положительно заряженного ядра (+17), вокруг которого по трем оболочкам движутся 17 электронов. При этом 10 электронов находятся на внутреннем уровне, а 7 электронов – на внешнем. Поскольку хлор расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома хлора на 3s-орбитали находятся два спаренных электрона, на 3p-орбитали – четыре спаренных и один неспаренный электрон. В свою очередь ядро атома хлора состоит из 17 протонов и 18 нейтронов. Хлор относится к элементам p-семейства.
Радиус атома хлора составляет 99 пм.
Атомная масса атома хлора составляет 35,446-35,457 а. е. м.
Хлор – химически активный неметалл.
Хлор – токсичный, ядовитый, удушающий газ.
Изотопы и модификации хлора:
Свойства хлора (таблица): температура, плотность, давление и пр.:
| Общие сведения | |
| Название | Хлор/ Chlorum |
| Символ | Cl |
| Номер в таблице | 17 |
| Тип | Неметалл |
| Открыт | Карл Вильгельм Шееле, Швеция, 1774 г. |
| Внешний вид и пр. | Ядовитый газ желтовато-зелёного цвета, тяжелее воздуха, с резким запахом и сладковатым, «металлическим» вкусом. |
| Содержание в земной коре | 0,017 % |
| Содержание в океане | 2,0 % |
| Свойства атома | |
| Атомная масса (молярная масса)* | 35,446-35,457 а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 2s2 2p6 3s2 3p5 |
| Радиус атома | 99 пм |
| Химические свойства | |
| Степени окисления | +7, +6, +5, +4, +, +1, 0, −1 |
| Валентность | -1, +1, (+2), +3, (+4), +5, +7 |
| Ковалентный радиус | 102±4 пм |
| Радиус Ван-дер-Ваальса | |
| Радиус иона | (+7e)27 (-1e)181 пм |
| Электроотрицательность | 2,58 (шкала Полинга) |
| Энергия ионизации (первый электрон) | 1254,9 кДж/моль (13,01 эВ) |
| Электродный потенциал | |
| Физические свойства | |
| Плотность (при нормальных условиях) | 0,00321 г/см3 |
| Температура плавления | -101,5 °C (171,6 К) |
| Температура кипения | -34,04 °C (239,11 К) |
| Уд. теплота плавления | 6,41 кДж/моль |
| Уд. теплота испарения | 20,41 кДж/моль |
| Молярная теплоёмкость | 21,838 Дж/(K·моль) |
| Молярный объём | 18,7 см³/моль |
| Теплопроводность (при 300 K) | 0,009 Вт/(м·К) |
| Электропроводность в твердой фазе | |
| Сверхпроводимость при температуре | |
| Твёрдость | |
| Структура решётки | орторомбическая |
| Параметры решётки | a = 6,29, b = 4,50 Å, c = 8,21 Å |
| Температура Дебая |
Примечание:
* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
Физические свойства хлора:
Химические свойства хлора. Взаимодействие хлора. Химические реакции с хлором:
Получение хлора:
Применение хлора:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
хлор атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле хлора
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
985
Источник
В природе хлор встречается в газообразном состоянии и только в виде соединений с другими газами. В условиях, приближенных к нормальным, это ядовитый едкий газ зеленоватого цвета. Имеет больший вес, чем воздух. Обладает сладким запахом. Молекула хлора содержит два атома. В спокойном состоянии не горит, но при высоких температурах входит во взаимодействие с водородом, после чего возможен взрыв. В результате выделяется газ фосген. Очень ядовит. Так, даже при малой концентрации в воздухе (0,001 мг на 1 дм3) может вызвать летальный исход. Основная характеристика неметалла хлора гласит, что он тяжелее воздуха, следовательно, всегда будет находиться у самого пола в виде желтовато-зеленой дымки.
Исторические факты
Впервые на практике это вещество было получено К. Шелее в 1774 г. путем соединения соляной кислоты и пиролюзита. Однако лишь в 1810 г. П. Дэви смог дать характеристику хлору и установить, что это отдельный химический элемент.

Стоит отметить, что в 1772 г. Джозеф Пристли смог получить хлороводород – соединение хлора с водородом, однако разделить эти два элемента химик не смог.
Химическая характеристика хлора
Хлор – химический элемент основной подгруппы VII группы таблицы Менделеева. Находится в третьем периоде и имеет атомный номер 17 (17 протонов в атомном ядре). Химически активный неметалл. Обозначается буквами Cl.
Является типичным представителем галогенов. Это газы, не имеющие цвета, но обладающие резким едким запахом. Как правило, токсичны. Все галогены хорошо разбавляются в воде. При контакте с влажным воздухом начинают дымиться.
Внешняя электронная конфигурация атома Cl 3s2Зр5. Следовательно, в соединениях химический элемент проявляет уровни окисления -1,+1, +3, +4, +5, +6 и +7. Ковалентный радиус атома 0,96Å, ионный радиус Cl- 1.83 Å, сродство атома к электрону 3,65 эв, уровень ионизации 12,87 эв.
Как указано выше, хлор представляет собой довольно активный неметалл, что позволяет создавать соединения практически с любыми металлами (в отдельных случаях при помощи нагревания или с помощью влаги, вытесняя при этом бром) и неметаллами. В порошкообразной форме реагирует с металлами только под действием высоких температур.
Максимальная температура горения – 2250 °С. С кислородом способен образовывать оксиды, гипохлориты, хлориты и хлораты. Все соединения, содержащие кислород, становятся взрывоопасными в условиях взаимодействия с окисляющимися веществами. Стоит отметить, что оксиды хлора могут произвольно взрываться, в то время как хлораты взрываются лишь при воздействии на них какими-либо инициаторами.
Характеристика хлора по положению в периодической системе:
• простое вещество;
• элемент семнадцатой группы периодической таблицы;
• третий период третьего ряда;
• седьмая группа главной подгруппы;
• атомный номер 17;
• обозначается символом Cl;
• химически активный неметалл;
• находится в группе галогенов;
• в условиях, приближенных к нормальным, это ядовитый газ желтовато-зелёного цвета с едким запахом;
• молекула хлора имеет 2 атома (формула Cl2).

Физические свойства хлора:
• температура кипения: -34,04 °С;
• температура плавления: -101,5 °С;
• плотность в газообразном состоянии – 3 ,214 г/л;
• плотность жидкого хлора (в период кипения) – 1,537 г/см3;
• плотность твердого хлора – 1,9 г/см3;
• удельный объем – 1,745 х 10-3 л/г.
Хлор: характеристика температурных изменений
В газообразном состоянии имеет свойство легко сжижаться. При давлении в 8 атмосфер и температуре 20 °С выглядит как зеленовато-желтая жидкость. Обладает очень высокими коррозионными свойствами. Как показывает практика, этот химический элемент может сохранять жидкое состояние вплоть до критической температуры (143 °С), при условии увеличения давления.
Если его охладить до температуры -32 °С, он изменит свое агрегатное состояние на жидкое вне зависимости от атмосферного давления. При дальнейшем понижении температуры происходит кристаллизация (при показателе -101 °С).

Хлор в природе
В земной коре хлора содержится всего 0,017 %. Основная масса находится в вулканических газах. Как указано выше, вещество имеет большую химическую активность, вследствие чего в природе встречается в соединениях с другими элементами. При этом множество минералов содержат хлор. Характеристика элемента позволяет образовывать порядка ста различных минералов. Как правило, это хлориды металлов.
Также большое его количество находится в Мировом океане – почти 2 %. Это обусловлено тем, что хлориды очень активно растворяются и разносятся с помощью рек и морей. Возможен и обратный процесс. Хлор вымывается обратно на берег, а далее ветер разносит его по окрестностям. Именно поэтому наибольшая его концентрация наблюдается в прибрежных зонах. В засушливых районах планеты рассматриваемый нами газ образуется при помощи испарения воды, вследствие чего появляются солончаки. Ежегодно в мире добывают порядка 100 млн тонн данного вещества. Что, впрочем, неудивительно, ведь существует много месторождений, содержащих хлор. Характеристика его, однако, во многом зависит именно от его географического положения.
Методы получения хлора
Сегодня существует ряд методов получения хлора, из которых наиболее распространены следующие:
1. Диафрагменный. Является самым простым и менее затратным. Соляной раствор в диафрагменном электролизе поступает в пространство анода. Далее по стальной катодной сетке перетекает в диафрагму. В ней находится небольшое количество полимерных волокон. Важной особенностью этого устройства является противоток. Он направлен из анодного пространства в катодное, что позволяет отдельно получить хлор и щелоки.
2. Мембранный. Наиболее энергоэффективен, но сложноосуществим в организации. Схож с диафрагменным. Различие состоит в том, что анодное и катодное пространства полностью разделены мембраной. Следовательно, на выходе получаются два отдельных потока.
Стоит отметить, что характеристика хим. элемента (хлора), полученного данными методами, будет иной. Более “чистым” принято считать мембранный метод.
3. Ртутный метод с жидким катодом. По сравнению с остальными технологиями, этот вариант позволяет получать наиболее чистый хлор.
Принципиальная схема установки состоит из электролизера и соединенных между собой насоса и разлагателя амальгамы. В качестве катода служит перекачиваемая насосом ртуть вместе с раствором поваренной соли, а в качестве анода – угольные или графитовые электроды. Принцип действия установки следующий: из электролита выделяется хлор, который отводится из электролизера вместе с анолитом. Из последнего удаляют примеси и остатки хлора, донасыщают галитом и снова возвращают на электролиз.
Требования промышленной безопасности и нерентабельность производства привели к замене жидкого катода твердым.

Применение хлора в промышленных целях
Свойства хлора позволяют активно применять его в промышленности. С помощью этого химического элемента получают различные хлорорганические соединения (винилхлорид, хлоро-каучук и др.), лекарственные препараты, дезинфицирующие средства. Но самая большая ниша, занятая в промышленности, это производство соляной кислоты и извести.
Широко применяются методы очищения питьевой воды. На сегодняшний день пытаются отойти от этого метода, заменив его озонированием, поскольку рассматриваемое нами вещество негативно влияет на организм человека, к тому же хлорированная вода разрушает трубопроводы. Вызвано это тем, что в свободном состоянии Cl пагубно влияет на трубы, изготовленные из полиолефинов. Тем не менее большинство стран отдает предпочтение именно методу хлорирования.

Также хлор применяется в металлургии. С его помощью получают ряд редких металлов (ниобий, тантал, титан). В химической промышленности активно используют различные хлорорганические соединения для борьбы против сорняков и для других сельскохозяйственных целей, используется элемент и в качестве отбеливателя.
Благодаря своей химической структуре хлор разрушает большинство органических и неорганических красителей. Достигается это путем полного их обесцвечивания. Такой результат возможен лишь при условии присутствия воды, ведь процесс обесцвечивания происходит благодаря атомарному кислороду, который образуется после распада хлора: Cl2 + H2O → HCl + HClO → 2HCl + O. Данный способ нашел применение пару веков назад и пользуется популярностью и по сей день.
Очень популярно применение этого вещества для получения хлорорганических инсектицидов. Эти сельскохозяйственные препараты убивают вредоносные организмы, оставляя нетронутыми растения. Значительная часть всего добываемого на планете хлора уходит на сельскохозяйственные нужды.

Также используется он при производстве пластикатов и каучука. С их помощью изготавливают изоляцию проводов, канцелярские товары, аппаратуру, оболочки бытовой техники и т. д. Бытует мнение, что каучуки, полученные таким образом, вредят человеку, но это не подтверждено наукой.
Стоит отметить, что хлор (характеристика вещества была подробно раскрыта нами ранее) и его производные, такие как иприт и фосген, применяются и в военных целях для получения боевых отравляющих средств.
Хлор как яркий представитель неметаллов
Неметаллы – простые вещества, которые включают в себя газы и жидкости. В большинстве случаев они хуже проводят электрический ток, чем металлы, и имеют существенные различия в физико-механических характеристиках. При помощи высокого уровня ионизации способны образовывать ковалентные химические соединения. Ниже будет дана характеристика неметалла на примере хлора.
Как уже было сказано выше, этот химический элемент представляет собой газ. В нормальных условиях у него полностью отсутствуют свойства, сходные с таковыми у металлов. Без сторонней помощи не может взаимодействовать с кислородом, азотом, углеродом и др. Свои окислительные свойства проявляет в связях с простыми веществами и некоторыми сложными. Относится к галогенам, что ярко отражается на его химических особенностях. В соединениях с остальными представителями галогенов (бром, астат, йод), вытесняет их. В газообразном состоянии хлор (характеристика его – прямое тому подтверждение) хорошо растворяется. Является отличным дезинфектором. Убивает только живые организмы, что делает его незаменимым в сельском хозяйстве и медицине.
Применение в качестве отравляющего вещества
Характеристика атома хлора позволяет применять его как отравляющее средство. Впервые газ был применен Германией 22.04.1915 г., в ходе Первой мировой войны, вследствие чего погибло порядка 15 тыс. человек. На данный момент как отравляющее вещество не применяется.
Дадим краткую характеристику химического элемента как удушающего средства. Влияет на организм человека посредством удушения. Сначала оказывает раздражение верхних дыхательных путей и слизистой оболочки глаз. Начинается сильный кашель с приступами удушья. Далее, проникая в легкие, газ разъедает легочную ткань, что приводит к отеку. Важно! Хлор является быстродействующим веществом.
В зависимости от концентрации в воздухе, симптоматика бывает разной. При малом содержании у человека наблюдается покраснение слизистой оболочки глаз, легкая одышка. Содержание в атмосфере 1,5-2 г/м3 вызывает тяжесть и острые ощущения в груди, резкую боль в верхних дыхательных путях. Также состояние может сопровождаться сильным слезотечением. После 10-15 минут нахождения в помещении с такой концентрацией хлора наступает сильный ожог легких и смерть. При более плотных концентрациях смерть возможна в течение минуты от паралича верхних дыхательных путей.

При работе с этим веществом рекомендуется использовать спецодежду, противогаз, перчатки.
Хлор в жизни организмов и растений
Хлор входит в состав практически всех живых организмов. Особенность состоит в том, что присутствует он не в чистом виде, а в виде соединений.
В организмах животных и человека ионы хлора поддерживают осмотическое равенство. Вызвано это тем, что они имеют наиболее подходящий радиус для проникновения в мембранные клетки. Наряду с ионами калия Cl регулирует водно-солевой баланс. В кишечнике ионы хлора создают благоприятную среду для действия протеолитических ферментов желудочного сока. Хлорные каналы предусмотрены во многих клетках нашего организма. Посредством их происходит межклеточный обмен жидкостями и поддерживается pH клетки. Порядка 85 % от общего объема этого элемента в организме пребывает в межклеточном пространстве. Выводится из организма по мочеиспускательным каналам. Вырабатывается женским организмом в процессе кормления грудью.
На данном этапе развития тяжело однозначно сказать, какие именно заболевания провоцирует хлор и его соединения. Связано это с недостатком исследований в этой области.
Также ионы хлора присутствуют в клетках растений. Он активно принимает участие в энергетическом обмене. Без этого элемента невозможен процесс фотосинтеза. С его помощью корни активно впитывают необходимые вещества. Но большая концентрация хлора в растениях способна оказывать пагубное влияние (замедление процесса фотосинтеза, остановка развития и роста).

Однако существуют такие представители флоры, которые смогли “подружиться” или хотя бы ужиться с данным элементом. Характеристика неметалла (хлора) содержит такой пункт, как способность вещества окислять почвы. В процессе эволюции упомянутые выше растения, называемые галофитами, заняли пустые солончаки, которые пустовали из-за переизбытка этого элемента. Они впитывают ионы хлора, а после избавляются от них при помощи листопада.
Транспортировка и хранение хлора
Существует несколько способов перемещать и хранить хлор. Характеристика элемента предполагает необходимость специальных баллонов с высоким давлением. Такие емкости имеют опознавательную маркировку – вертикальную зеленую линию. Ежемесячно баллоны необходимо тщательно промывать. При длительном хранении хлора в них образуется очень взрывоопасный осадок – трихлорид азота. При несоблюдении всех правил безопасности возможно самопроизвольное воспламенение и взрыв.

Изучение хлора
Будущим химикам должна быть известна характеристика хлора. По плану 9-классники могут даже ставить лабораторные опыты с этим веществом на основе базовых знаний по дисциплине. Естественно, преподаватель обязан провести инструктаж по технике безопасности.
Порядок работ следующий: необходимо взять колбу с хлором и насыпать в неё мелкую металлическую стружку. В полете стружка вспыхнет яркими светлыми искрами и одновременно образуется легкий белый дым SbCl3. При погружении в сосуд с хлором оловянной фольги она также самовоспламенится, а на дно колбы медленно опустятся огненные снежинки. Во время этой реакции образуется дымная жидкость – SnCl4. При помещении железной стружки в сосуде образуются красные «капли» и появится рыжий дым FeCl3.
Наряду с практическими работами повторяется теория. В частности, такой вопрос, как характеристика хлора по положению в периодической системе (описана в начале статьи).

В результате опытов выясняется, что элемент активно реагирует на органические соединения. Если поместить в банку с хлором вату, смоченную предварительно в скипидаре, то она мгновенно воспламенится, и из колбы резко повалит сажа. Эффектно тлеет желтоватым пламенем натрий, а на стенках химпосуды появляются кристаллы соли. Ученикам будет небезынтересно узнать, что, будучи ещё молодым химиком, Н. Н. Семенов (впоследствии лауреат Нобелевской премии), проведя такой опыт, собрал со стенок колбы соль и, посыпав ею хлеб, съел его. Химия оказалась права и не подвела ученого. В результате проведенного химиком опыта действительно получилась обычная поваренная соль!
Источник
