Какие свойства проявляет гидроксид бериллия

гидроксид бериллия представляет собой химическое соединение, состоящее из двух молекул гидроксида (ОН) и молекулы бериллия (Ве). Его химическая формула Be (OH)2 и он характеризуется как амфотерный вид. Как правило, он может быть получен в результате реакции между моноксидом бериллия и водой в соответствии со следующей химической реакцией: BeO + H2O → Be (OH)2
С другой стороны, это амфотерное вещество имеет молекулярную конфигурацию линейного типа. Однако могут быть получены различные структуры гидроксида бериллия: альфа и бета форма, как минеральная, так и в паровой фазе, в зависимости от используемого метода..
индекс
- 1 Химическая структура
- 1.1 Бериллий гидроксид альфа
- 1.2 Бета-бериллиевый гидроксид
- 1.3 Гидроксид бериллия в минералах
- 1.4 Пар бериллиевого гидроксида
- 2 свойства
- 2.1 Внешний вид
- 2.2 Термохимические свойства
- 2.3 Растворимость
- 2.4 Риски, связанные с воздействием
- 3 использования
- 4 Получение
- 4.1 Получение металлического бериллия
- 5 ссылок
Химическая структура
Это химическое соединение может быть найдено четырьмя различными способами:
Бериллий гидроокись альфа
При добавлении любого основного реагента, такого как гидроксид натрия (NaOH), к раствору соли бериллия, получается альфа (α) форма гидроксида бериллия. Пример показан ниже:
2NaOH (разбавленный) + BeCl2 → Be (OH)2↓ + 2NaCl
2NaOH (разбавленный) + BeSO4 → Be (OH)2↓ + Na2SW4
Бета-гидроксид бериллия
Вырождение этого альфа-продукта формирует метастабильную тетрагональную кристаллическую структуру, которая через длительный период времени превращается в ромбическую структуру, называемую бета-гидроксидом бериллия (β).
Эта бета-форма также получается в виде осадка из раствора бериллия натрия гидролизом в условиях, близких к температуре плавления..
Гидроксид бериллия в минералах
Хотя это не обычно, гидроксид бериллия встречается как кристаллический минерал, известный как бехоит (называемый таким образом в связи с его химическим составом).
Встречается в гранитных пегматитах, образующихся при превращении гадолинита (минералов группы силикатов) в вулканические фумаролы..
Этот относительно новый минерал был впервые обнаружен в 1964 году и в настоящее время обнаружен только в гранитных пегматитах, расположенных в штатах Техас и Юта в Соединенных Штатах..
Паровая гидроокись бериллия
При температуре выше 1200 ° C (2190 ° C) в паровой фазе существует гидроксид бериллия. Получается в результате реакции между водяным паром и оксидом бериллия (BeO).
Аналогично, полученный пар имеет парциальное давление 73 Па, измеренное при температуре 1500 ° С..
свойства
Гидроксид бериллия имеет молярную массу или приблизительную молекулярную массу 43,0268 г / моль и плотность 1,92 г / см.3. Его температура плавления находится при температуре 1000 ° С, при которой начинается его разложение..
В качестве минерала, Be (OH)2 (Behoita) имеет твердость 4, а его плотность составляет 1,91 г / см.3 и 1,93 г / см3.
внешний вид
Гидроксид бериллия представляет собой белое твердое вещество, которое в своей альфа-форме имеет желатиновый и аморфный вид. С другой стороны, бета-форма этого соединения имеет четко выраженную орторомбическую и стабильную кристаллическую структуру..
Можно сказать, что морфология минерала Be (OH)2 он разнообразен, потому что его можно найти в виде ретикулярных кристаллов, древесных или сферических агрегатов. Точно так же это прибывает в белый, розовый, голубоватый и даже бесцветный и с жирным стекловидным блеском.
Термохимические свойства
Энтальпия образования: -902,5 кДж / моль
Энергия Гиббса: -815,0 кДж / моль
Энтропия образования: 45,5 Дж / моль
Теплоемкость: 62,1 Дж / моль
Удельная теплоемкость: 1443 Дж / К
Стандартная энтальпия образования: -20,98 кДж / г
растворимость
Гидроксид бериллия по своей природе амфотерный, поэтому он способен отдавать или принимать протоны и растворять как кислые, так и щелочные среды в кислотно-щелочной реакции с образованием соли и воды..
В этом смысле растворимость Be (OH)2 в воде ограничен продуктом растворимости Kps(H 2 O), что равно 6,92 × 10-22.
Риски подверженности
Законно допустимый предел воздействия на человека (PEL или OSHA) вещества, содержащего гидроксид бериллия, установлен для максимальной концентрации от 0,002 мг / м.3 и 0,005 мг / м3 составляет 8 часов, а для концентрации 0,0225 мг / м3 максимум 30 минут.
Эти ограничения связаны с тем, что бериллий классифицируется как канцерогенный агент типа А1 (канцерогенный агент у людей, на основании количества данных эпидемиологических исследований).
приложений
Использование гидроксида бериллия в качестве сырья для обработки какого-либо продукта очень ограничено (и необычно). Однако это соединение используется в качестве основного реагента для синтеза других соединений и получения металлического бериллия..
получение
Оксид бериллия (BeO) – химическое соединение высокочистого бериллия, наиболее используемое в промышленности. Он характеризуется как бесцветное твердое вещество со свойствами электрической изоляции и высокой теплопроводностью..
В этом смысле процесс его синтеза (по техническому качеству) в первичной промышленности осуществляется следующим образом:
- Гидроксид бериллия растворяют в серной кислоте (Н2SW4).
- Когда реакцию проводят, раствор фильтруют, так что нерастворимые примеси оксида или сульфата удаляются таким образом..
- Фильтрат подвергают выпариванию для концентрирования продукта, который охлаждают до получения кристаллов сульфата бериллия BeSO4.
- БеСО4 кальцинируют при определенной температуре от 1100 ° C до 1400 ° C.
Конечный продукт (BeO) используется для изготовления специальных керамических изделий промышленного назначения..
Получение металлического бериллия
При добыче и переработке бериллиевых минералов образуются примеси, такие как оксид бериллия и гидроксид бериллия. Последний подвергается серии превращений до получения металлического бериллия.
Be (OH) реагирует2 с раствором бифторида аммония:
Бе (ОН)2 + 2 (NH4) HF2 → (NH4)2BeF4 + 2 ч2О
(NH4)2BeF4 он подвергается повышению температуры, подвергаясь термическому разложению:
(NH4)2BeF4 → 2NH3 + 2HF + BeF2
Наконец, восстановление фторида бериллия при температуре 1300 ° C магнием (Mg) приводит к металлическому бериллию:
BeF2 + Mg → Be + MgF2
Бериллий используется в металлических сплавах, производстве электронных компонентов, производстве радиационных экранов и окон, используемых в рентгеновских аппаратах..
ссылки
- Wikipedia. (Н.Д.). Гидроксид бериллия. Получено с en.wikipedia.org
- Холлеман, А. Ф .; Виберг Э. и Виберг Н. (2001). Гидроксид бериллия. Получено из books.google.co.ve
- Publishing, M.D. (s.f.). Behoite. Получено из handbookofmineralogy.org
- Все реакции. (Н.Д.). Гидроксид бериллия Be (OH)2. Получено с allreactions.com
- PubChem. (Н.Д.). Гидроксид бериллия. Получено из pubchem.ncbi.nlm.nih.gov
- Уолш, К. А. и Видал, Е. Э. (2009). Бериллий Химия и переработка. Получено из books.google.co.ve
Источник
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Источник
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются
легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств,
реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
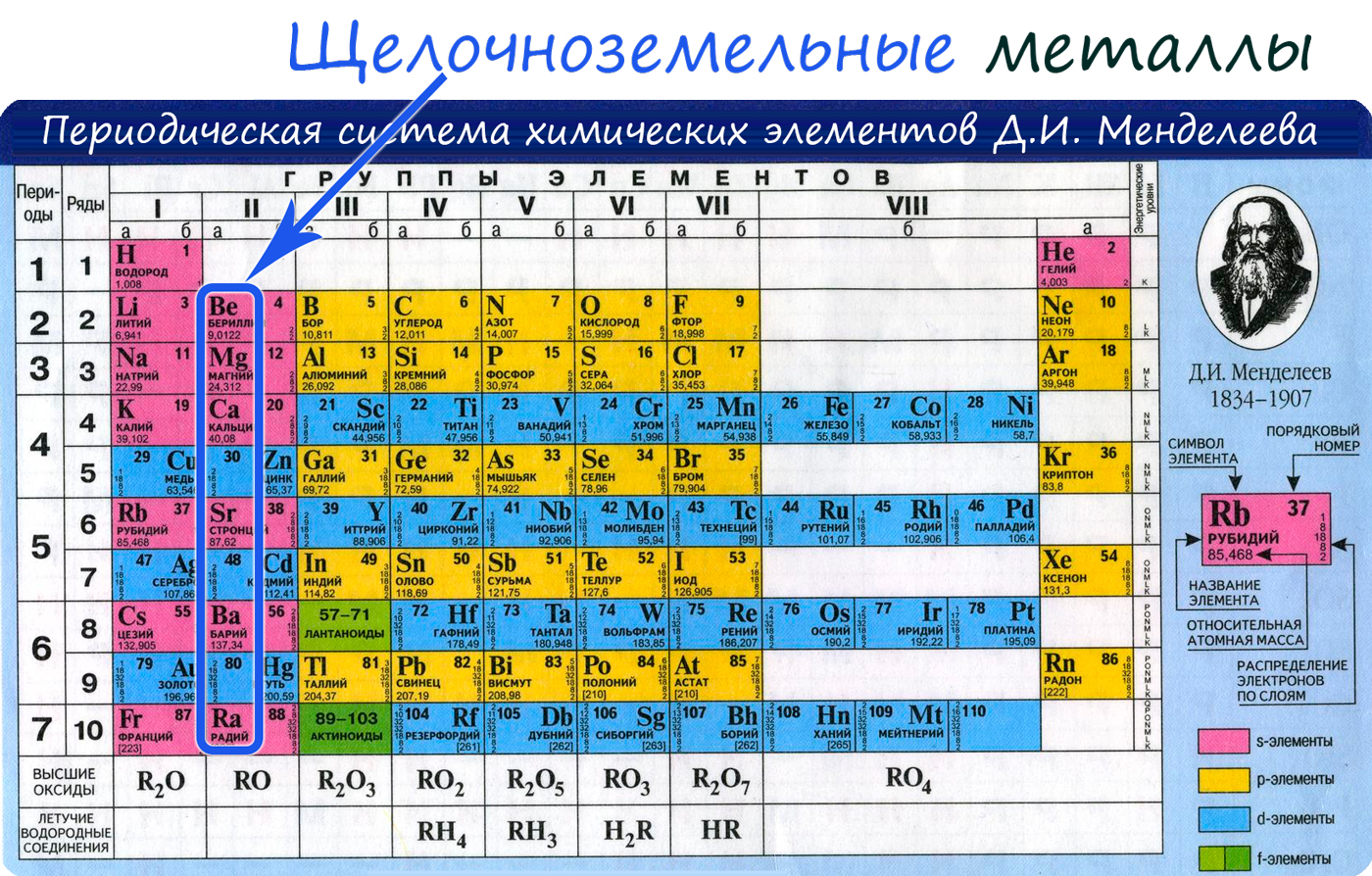
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2:
- Be – 2s2
- Mg – 3s2
- Ca – 4s2
- Sr – 5s2
- Ba – 6s2
- Ra – 7s2
Природные соединения
В природе щелочноземельные металлы встречаются в виде следующих соединений:
- Be – BeO*Al2O3*6SiO2 – берилл
- Mg – MgCO3 – магнезит, MgO*Al2O3 – шпинель, 2MgO*SiO2 – оливин
- Ca – CaCO3 – мел, мрамор, известняк, кальцит, CaSO4*2H2O – гипс, CaF2 – флюорит

Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов,
алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия – способ получения металлов путем восстановления их оксидов алюминием)
MgBr2 + Ca → CaBr2 + Mg

Химические свойства
- Реакции с водой
- Реакции с кислотами
- Реакции с неметаллами
- С оксидами других металлов
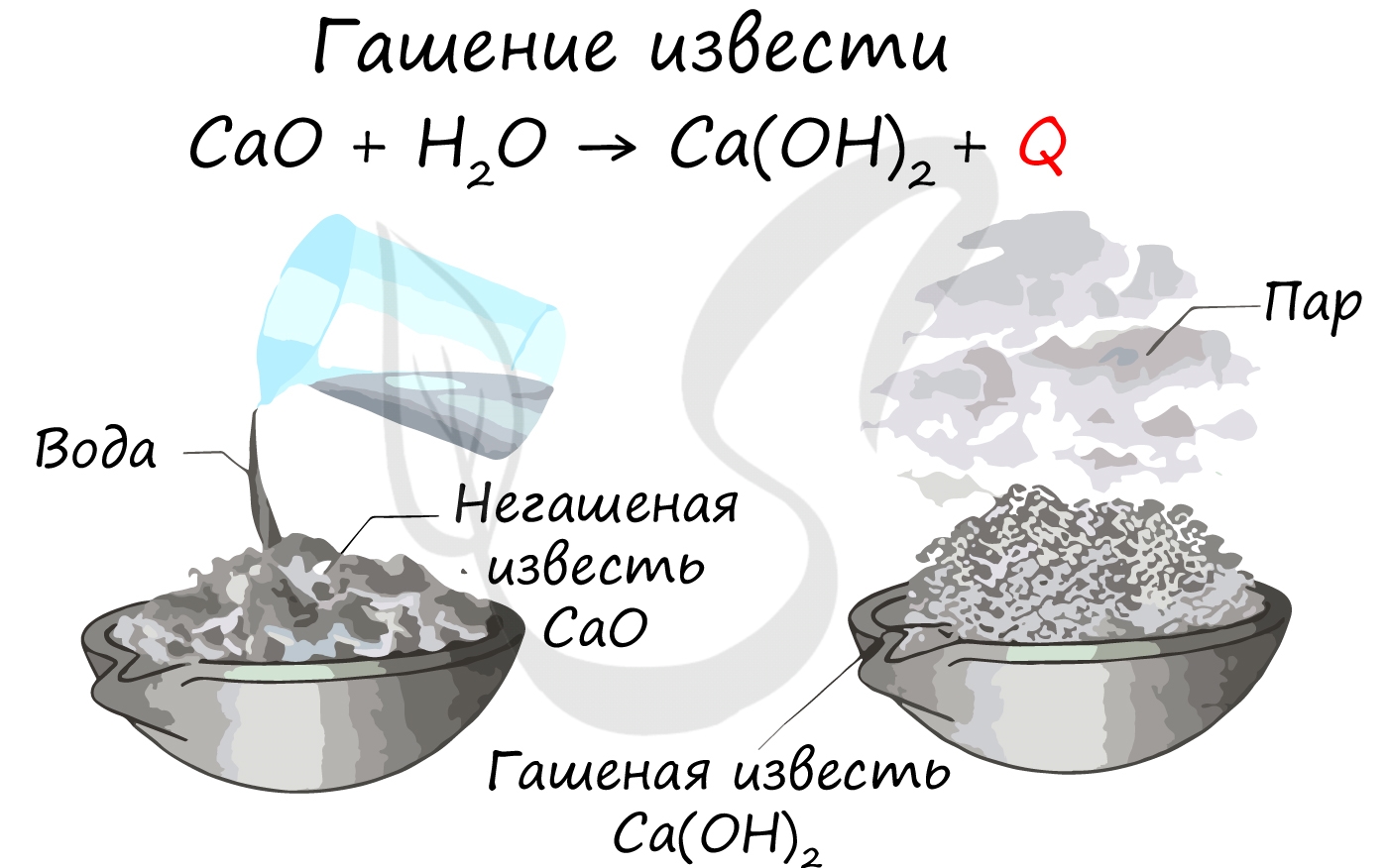
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов.
Магний реагирует с водой только при нагревании.
Ca + H2O → Ca(OH)2 + H2↑
Щелочноземельные металлы – активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород
из кислот:
Ba + HCl → BaCl2 + H2
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I), серой. Степень окисления у щелочноземельных
металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
Ca + I2 → CaI2 (йодид кальция)
Mg + S → MgS (сульфид магния)
При нагревании реагируют с азотом, водородом и углеродом.
Ca + N2 → (t) Ca3N2 (нитрид кальция)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Получение
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
MgCO3 → (t) MgO + CO2
Ca(NO3)2 → (t 2)2 + O2
Ca(NO3)2 → (t > 560°C) CaO + O2 + NO2
Рекомендую взять на вооружение общую схему разложения нитратов:

Химические свойства
Проявляют преимущественно основные свойства, все кроме BeO – амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
- Реакция с водой
- Амфотерный оксид бериллия
BaO + HCl → BaCl2 + H2O
CaO + H2SO4 → CaSO4 + H2O
MgO + SO3 → MgSO4
CaO + CO2 → CaCO3
CaO + SiO2 → CaSiO3
В нее вступают все, кроме оксида бериллия.
CaO + H2O → Ca(OH)2
MgO + H2O → Mg(OH)2
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей,
и с основаниями с образованием комплексных солей.
BeO + HCl → BeCl2 + H2O
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)
BeO + Na2O → Na2BeO2

Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия – амфотерного гидроксида.
Получение
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
CaO + H2O → Ca(OH)2
Химические свойства
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.
Ba(OH)2 + H2SO4 → BaSO4↓ + H2O
Ca(OH)2 + 2CO2 → Ca(HCO3)2
Ca(HCO3)2 + Ca(OH)2 → CaCO3 + H2O + CO2
Ca(OH)2 + CO2 → CaCO3↓ + H2O

Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется
слабый электролит (вода).
Ba(OH)2 + Na2SO4 → BaSO4↓ + NaOH
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
Be(OH)2 + HCl → BeCl2 + H2O
Be(OH)2 + NaOH → Na2[Be(OH)4]
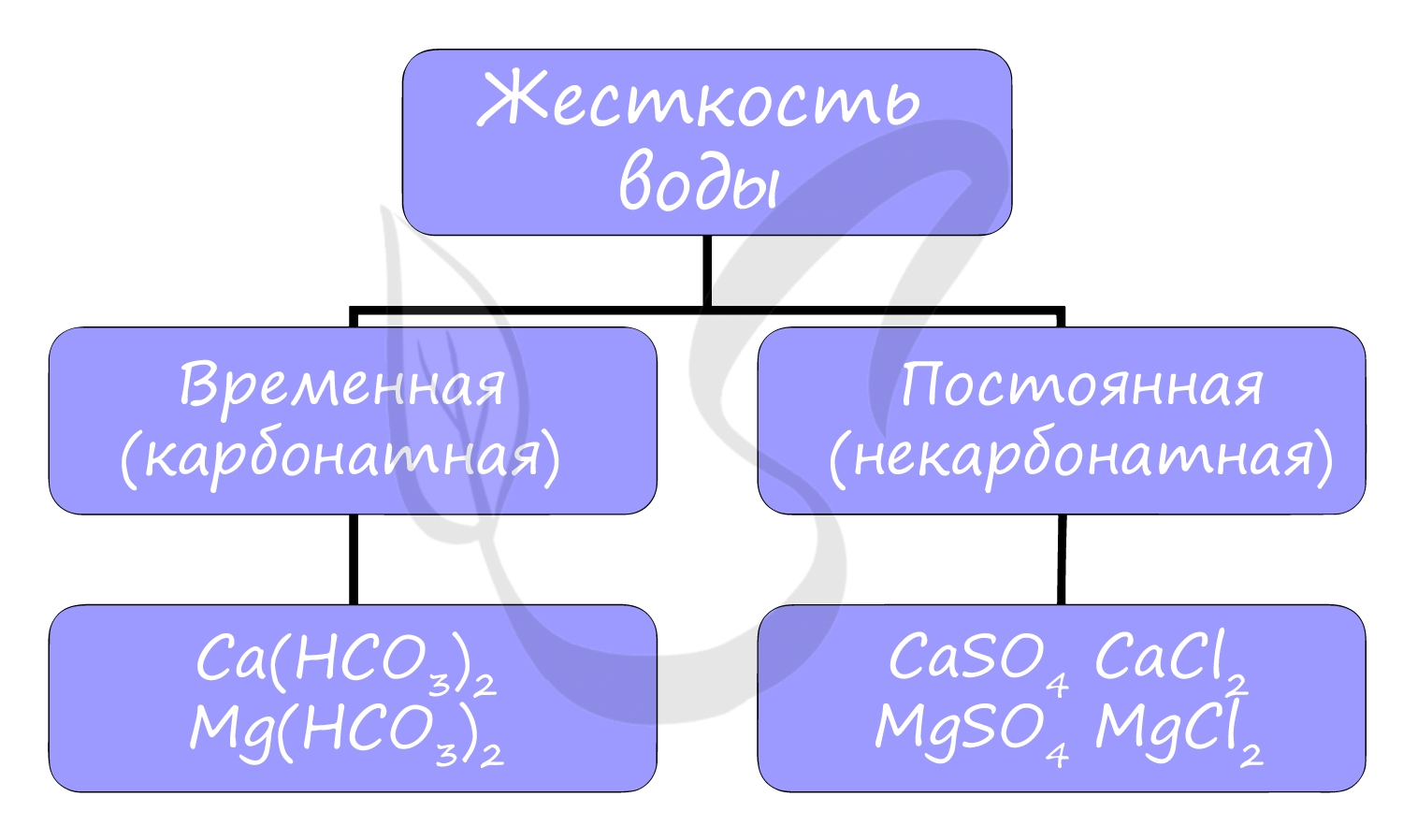
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов,
сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить – каждый день. Временная жесткость воды устраняется
обычным кипячением воды в чайнике, и известь на его стенках – CaCO3 – бесспорное доказательство устранения жесткости:
Ca(HCO3)2 → CaCO3↓ + CO2 + H2O
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
Ca(HCO3)2 + Na2CO3 → CaCO3↓ + NaHCO3
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную
жесткость воды устраняют добавлением в воду Na2CO3:
CaCl2 + Na2CO3 → CaCO3↓ + NaCl
MgSO4 + Na2CO3 + H2O → [Mg(OH)]2CO3↓ + CO2↑ + Na2SO4
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках
котлов, труб, чайника.

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
