Какие свойства проявляет германий


История происхождения
В 1869 году русский химик Д. И. Менделеев заявил, что в природе должно существовать несколько элементов, которые всё ещё не найдены людьми. Его идея была связана с Периодической таблицей, по которой между некоторыми веществами находились пробелы. Один из элементов он назвал экасилиций. Менделеев считал, что по свойствам это вещество похоже на кремний.

В 1886 году в Фрейбергской академии наук открыли новый минерал, который назвали аргиродит. Профессор К. Винклер тщательно изучил его и нашёл в его составе неизвестный элемент. Вскоре он раскрыл его свойства и несколько соединений. Винклер пришёл к выводу, что это и есть то самое вещество, названное Менделеевым экасилиций. Сначала химик хотел назвать его нептунием, но это наименование дали другому предполагаемому веществу, поэтому элемент получил название Germanium в честь родины Винклера.
До второй половины XX века германий почти не применялся в промышленности. Только во время Второй мировой войны элемент стали использовать в диодах и других электронных устройствах.
Местонахождение и получение
В чистом виде химический элемент не встречается в природе. Обычно его можно отыскать в качестве примесей в разных полезных ископаемых. Общий объём вещества по массе в земной коре планеты составляет около 1,5⋅10−4%. Редко металл встречается в собственных минералах (сульфосолях):
- германит;
- плюмбогерманит;
- конфильдит;
- рениерит;
- стоттит;
- аргиродит.

В основном германий добывают из горных пород и различных минералов таких, как железные руды, сульфидные руды цветных металлов, базальт, диабаз, магнетит, рутил, хромит, гранит. В больших объёмах вещество содержится в некоторых сфалеритах. Примеси германия присутствуют почти во всех силикатах и некоторых месторождениях каменного угля и нефти.
Химический элемент распространён практически по всей планете. Однако промышленных месторождений этого металла нет ни в одной стране. Небольшое количество элемента, содержащегося в его минералах, не может покрыть потребность современной промышленности в этом редком, но важном веществе.
Германий можно получить несколькими методами. Основной способ заключается в применении сульфида металла, который перерабатывают до получения оксида GeO2 и затем освобождают элемент с добавлением водорода. В промышленной области материал выходит в побочных продуктах после переработки руд цветных металлов или золы от сжигания угля.
Физические особенности

Германий относится к 14-й группе 4 периода в таблице Менделеева. Его порядковый номер — 32, обозначение — Ge. В виде простого вещества германий выглядит как хрупкий полуметалл стального или серебристого оттенка. Материал характеризуется металлическим блеском. Элемент относится к непрямозонным полупроводникам.
Валентность металла в разных соединениях может быть II или IV; электронная формула германия (конфигурация) — 1s22s22p63s23p63d104s24p2. Следует узнать и о строении атома элемента. Он включает 32 протона и 41 нейтрон. По четырём орбитам движутся 32 электрона.
В нормальном состоянии атом элемента характеризуется двумя s-парными и двумя p-парными отрицательно заряженными частицами, поэтому вещество может образовывать две химические связи. В возбуждённом состоянии один из s-электронов покидает свою орбиталь и переходит на свободное место на p-подуровне. Поскольку образуется 4 неспаренных электрона, германий способен образовывать 4 связи по обменному механизму.
Основные физические свойства элемента:
- температура плавления — 938,2 °C;
- температура кипения — 2850 °C;
- плотность — 5,33 г/см³;
- молярный объём — 13,6 см³/моль;
- атомная масса — 72,6 а. е. м.;
- молярная теплоёмкость — 23,32 Дж/К·моль.
При нормальных условиях кристаллическая решётка элемента алмазная, или кубическая. У полуметалла есть необычное физическое свойство: германий считается одним из редких аномальных веществ, у которых при плавлении увеличивается показатель плотности. Кроме того, при повышении температуры возрастает почти в 13 раз удельная проводимость германия, однако при достижении 1100 °C она падает.
Химическая природа
В соединениях металл проявляет степень окисления +4, +2 или -4. Если рассматривать химические свойства германия, вещество напоминает кремний. При нормальных условиях он устойчив к воздействию воздуха, воды, щелочей и кислот. Германий способен растворяться в царской водке и в щелочном растворе пероксида водорода.
На воздухе при 500−700 °C металл окисляется до оксидов. Производные кислоты элемента представлены твёрдыми веществами, которые характеризуются высокими температурами плавления. Их можно получить путём сплавления оксидов германия.

При реакции с галогенами металл образует тетрагалогениды. Легче процесс проходит с фтором и хлором. Тетрахлорид получают при хлорировании германия в твёрдом состоянии или при реакции его оксида (GeO2) с концентрированной соляной кислотой. При гидролизе дигалогенидов элемента получается гидроксид. Монооксид можно получить при нагревании металла с его диоксидом.
Взаимодействуя с серой при температуре 1000 °C, германий образует дисульфид, который представлен твёрдым веществом белого цвета. При нагревании до 1100 °C металл незначительно реагирует с водородом. В результате получается малоустойчивое соединение гермин. При воздействии на германий аммиака образуется нитрид. С углеродом элемент не взаимодействует. Также вещество способно образовывать металлорганические (например, тетраэтилгерман) и комплексные соединения с гидроксилсодержащими органическими молекулами (многоосновные кислоты, многоатомные спирты).
Сферы использования

Поскольку германий выступает полупроводником, он широко применяется в электронике и технике при создании микросхем и транзисторов. Сплавы металла необходимы при изготовлении датчиков и детекторов, а его диоксид применяется для производства стёкол, пропускающих инфракрасное излучение. Элемент используют в радарных установках в качестве сопротивления.
Германий используют при создании призм и линз инфракрасной оптики. Без материала не обходятся оптоволоконные системы и полупроводниковые диоды. Элемент применяется при измерении низких температур и обнаружении инфракрасного излучения. Диоды и триоды на основе вещества используются в телевизорах, радиоприёмниках и счётно-решающих средствах.
Влияние на здоровье человека
Германий в незначительном объёме обнаружен в организме человека. Пока учёные не смогли установить, в каком количестве должен присутствовать этот элемент в составе тканей и крови. Металл практически полностью усваивается человеческим организмом. Излишки микроэлемента выводятся через почки. Также не выявлено, какие вещества могут улучшить или ухудшить его поглощаемость.
Специалистам удалось открыть в металле некоторые лечебные свойства. Германий оказывает положительное воздействие на здоровье человека:
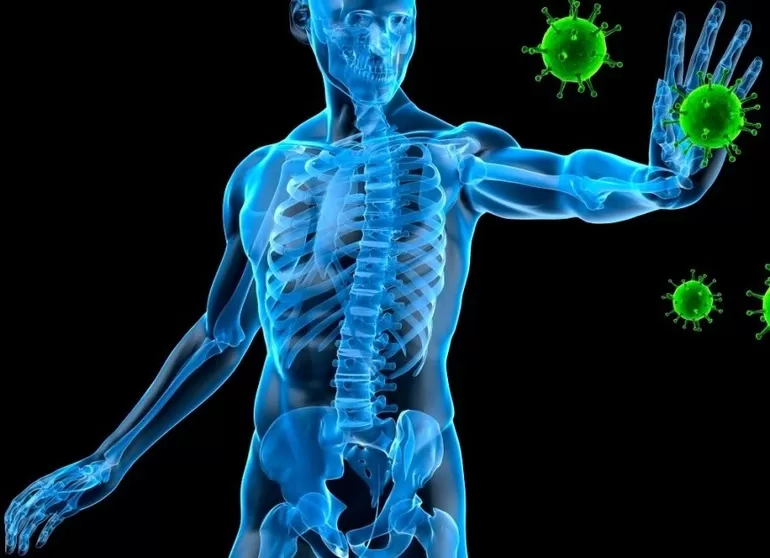
- Вещество транспортирует кислород к тканям.
- Элемент замещает свойства пониженного гемоглобина.
- Германий укрепляет иммунную систему, подавляет размножение вредных бактерий и стимулирует выработку противомикробных клеток.
- Металл выступает антиоксидантом, предотвращая образование опухолей.
- Вещество способно подавлять болезненные ощущения.
Но у германия есть не только плюсы. Среди минусов следует отметить, что большие дозировки этого вещества представляют опасность для организма человека и могут вызвать отравление.
Обычно такие последствия вызывает вдыхание паров чистого металла и его оксидов на производственных мероприятиях. После перорального приёма больших дозировок германия может наблюдаться раздражение кожного покрова или нарушение работы почек и печени. Очистить организм от избытка элемента необходимо с помощью симптоматического лечения с сорбентами. Из-за недостатка германия возможно развитие остеопороза.
Поддерживать необходимый уровень элемента в организме помогут следующие продукты:

- бобовые;
- молоко;
- грибы;
- лосось;
- чеснок;
- корень женьшеня;
- томатный сок.
В Японии производят добавки с германием для поддержания здоровья. Поскольку это вещество ещё недостаточно изучено, средство пока не получило массового распространения. В начале XXI века в России начали выпускать БАД «Гермавит». Добавку выписывают для укрепления иммунной и костной систем, а также для защиты от кислородного голодания.
Занимательные факты
Любой химический элемент отличается определёнными особенностями и свойствами, которые не характерны для других веществ. О германии имеется немало интересных фактов:
- Хотя элемент относится к группе металлов, по хрупкости его можно сравнить со стеклом. Если его уронить, он может разбиться.
- Германий может быть не только серебристого оттенка. Его цвет зависит от метода обработки. В некоторых случаях металл имеет стальной окрас, а иногда получается практически чёрным.
- Элемент обнаружен на поверхности солнца и в упавших с космоса метеоритах.
- Практически все свойства и характеристики вещества, которые предсказал Менделеев, оказались на удивление точными.
- Около 500 тонн элемента, что составляет половину разведанных запасов металла, скрыто в недрах США. Почти 400 тонн обнаружено в Китае.
- Элемент способен проводить ток не только в стандартном виде, но и в твёрдых растворах.
- Цена слитка германия и золота практически одинаковая.
- Плёнка из германия и ниобия, имеющая толщину несколько тысяч атомов, может сохранять сверхпроводимость даже при температуре 23,2 °К и ниже.
- Ни одно из полученных элементоорганических соединений этого металла не ядовито.

Ежегодно специалисты открывают новые свойства веществ, которые могут повлиять на дальнейшее развитие технологий. Возможно, что в скором будущем германию найдут широкое применение не только в промышленности, но и в области медицины.
Источник
| Германий | |
|---|---|
| Светло-серый полуметалл с металлическим блеском | |
 Кристалл германия | |
| Название, символ, номер | Германий / Germanium (Ge), 32 |
| Атомная масса (молярная масса) | 72,630(8) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d10 4s2 4p2 |
| Радиус атома | 122,5 пм |
| Ковалентный радиус | 122 пм |
| Радиус иона | (+4e) 53 (+2e) 73 пм |
| Электроотрицательность | 2,01 (шкала Полинга) |
| Электродный потенциал | |
| Степени окисления | 4, 2 |
| Энергия ионизации (первый электрон) | 760,0 (7,88) кДж/моль (эВ) |
| Плотность (при н. у.) | 5,323 г/см³ |
| Температура плавления | 1210,6 K |
| Температура кипения | 3103 K |
| Уд. теплота плавления | 36,8 кДж/моль |
| Уд. теплота испарения | 328 кДж/моль |
| Молярная теплоёмкость | 23,32 Дж/(K·моль) |
| Молярный объём | 13,6 см³/моль |
| Структура решётки | алмазная |
| Параметры решётки | 5,660 Å |
| Температура Дебая | 360 K |
| Теплопроводность | (300 K) 60,2 Вт/(м·К) |
| Номер CAS | 7440-56-4 |
Германий — химический элемент 14-й группы (по устаревшей классификации — главной подгруппы четвёртой группы) 4-го периода периодической системы химических элементов, с атомным номером 32. Обозначается символом Ge (нем. Germanium). Простое вещество германий — типичный полуметалл серо-белого цвета, с металлическим блеском. Подобно кремнию, является полупроводником.

История открытия и этимология

Клеменс Александр Винклер — первооткрыватель германия

В своём докладе о периодическом законе химических элементов в 1869 году русский химик Дмитрий Иванович Менделеев предсказал существование нескольких неизвестных на то время химических элементов, в частности и германия. В статье, датированной 11 декабря (29 ноября по старому стилю) 1870 года, Д. И. Менделеев назвал неоткрытый элемент экасилицием (из-за его местонахождения в Периодической таблице) и предсказал его атомную массу и другие свойства.
В 1885 году в Фрайберге (Саксония) в одной из шахт был обнаружен новый минерал аргиродит. При химическом анализе нового минерала немецкий химик Клеменс Винклер обнаружил новый химический элемент. Учёному удалось в 1886 году выделить этот элемент, также химиком была отмечена схожесть германия с сурьмой. Об открытии нового элемента Винклер сообщил в двухстраничной статье, датируемой 6 февраля 1886 года и предложил в ней имя для нового элемента Germanium и символ Ge. В последующих двух больших статьях 1886—1887 гг. Винклер подробно описал свойства германия.
Первоначально Винклер хотел назвать новый элемент «нептунием», но это название было дано одному из предполагаемых элементов, поэтому элемент получил название в честь родины учёного — Германии.
Путём анализа тетрахлорида германия GeCl4 Винклер определил атомный вес германия, а также открыл несколько новых соединений этого металла.
До конца 1930-х годов германий не использовался в промышленности. Во время Второй мировой войны германий использовался в некоторых электронных устройствах, главным образом в диодах.
Нахождение в природе
Общее содержание германия в земной коре 1,5⋅10−4% по массе, то есть больше, чем, например, сурьмы, серебра, висмута. Германий вследствие незначительного содержания в земной коре и геохимического сродства с некоторыми широко распространёнными элементами обнаруживает ограниченную способность к образованию собственных минералов, внедряясь в кристаллические решётки других минералов. Поэтому собственные минералы германия встречаются исключительно редко. Почти все они представляют собой сульфосоли: германит Cu2(Cu, Fe, Ge, Zn)2 (S, As)4 (6—10 % Ge), аргиродит Ag8GeS6 (3,6—7 % Ge), конфильдит Ag8(Sn, Ge) S6 (до 2 % Ge) и др. редкие минералы (ультрабазит, ранерит, франкеит). Основная масса германия рассеяна в земной коре в большом числе горных пород и минералов. Так, например, в некоторых сфалеритах содержание германия достигает килограммов на тонну, в энаргитах до 5 кг/т, в пираргирите до 10 кг/т, в сульваните и франкеите 1 кг/т, в других сульфидах и силикатах — сотни и десятки г/т. Германий концентрируется в месторождениях многих металлов — в сульфидных рудах цветных металлов, в железных рудах, в некоторых окисных минералах (хромите, магнетите, рутиле и др.), в гранитах, диабазах и базальтах. Кроме того, германий присутствует почти во всех силикатах, в некоторых месторождениях каменного угля и нефти. Концентрация германия в морской воде 6⋅10−5 мг/л.
Получение
Германий встречается в виде примеси к полиметаллическим, никелевым, вольфрамовым рудам, а также в силикатах. В результате сложных и трудоёмких операций по обогащению руды и её концентрированию германий выделяют в виде оксида GeO2, который восстанавливают водородом при 600 °C до простого вещества:
GeO2 + 2H2 → Ge + 2H2O
Получение чистого германия происходит методом зонной плавки, что делает его одним из самых химически чистых материалов.
Промышленное производство германия в России

А. А. Бурба — создатель металлургии германия в России
Производство германия в промышленных масштабах в России началось в 1959 году, когда на Медногорском медно-серном комбинате (ММСК) был введён в действие цех переработки пыли. Специалисты комбината под руководством А. А. Бурбы в сотрудничестве с проектным институтом «Унипромедь» разработали и внедрили в производство уникальную химико-металлургическую технологию получения германиевого концентрата путём комплексной переработки пылей шахтных металлургических печей медеплавильного производства и золы от сжигания энергетических углей, служивших топливом для электростанции. После этого СССР смог полностью отказаться от импорта германия. Впервые в мировой практике было выполнено извлечение германия из медноколчеданных руд. Пуск промышленного цеха переработки пыли на ММСК относят к крупнейшим внедрениям в цветной металлургии XX века.
В 1962 году по инициативе и при участии А. А. Бурбы аналогичное производство было создано также на Ангренском химико-металлургическом заводе (АХМЗ) в городе Ангрен в Узбекистане (ныне предприятие «Ангренэнергоцветмет»). Практически весь объём производства концентрата германия в СССР приходился на ММСК и АХМЗ. Создание крупномасштабного производства германия внесло значительный вклад в обеспечение экономической и оборонной безопасности страны. Уже в 1960-е годы Советский Союз смог отказаться от импорта германия, а в 1970-е начать его экспорт и стать мировым лидером по производству германия.
Для переработки выпускавшегося на ММСК и АХМЗ германиевого концентрата в конечные продукты (чистый германий и его соединения) в 1961—1962 гг. на Красноярском аффинажном заводе (с 1967 г. — Красноярский завод цветных металлов, затем — ОАО «Красцветмет») был создан цех по производству германия (с 1991 г. — ОАО «Германий»). В 1962—1963 гг. цех производил 600 кг монокристаллического германия в год. В 1968—1969 гг., когда внутренние потребности в германии были обеспечены, СССР впервые начал экспортировать диоксид германия, а в 1970 г. начался также экспорт поликристаллического зонноочищенного германия. СССР удерживал мировое лидерство по производству германия, увеличив выпуск металла настолько, что до 40 % производства уходило на экспорт. После распада СССР, вплоть до 2010 г., ММСК оставался единственным производителем германиевого концентрата в России. С 2010 г. производство германия в концентрате на ММСК приостановлено, а оборудование законсервировано. Одновременно с этим начато производство германия в концентрате на ООО «Германий и приложения» в г. Новомосковске Тульской области.
В 2000-х годах для получения германия в России используются германиеносные угли следующих месторождений: Павловское (Михайловский район Приморского края), Новиковское (Корсаковский городской округ Сахалинской области), Тарбагатайское (Петровск-Забайкальский район Забайкальского края). Германиеносные угли этих месторождений в среднем содержат 200 граммов германия на тонну.
Физические свойства
![]()
Элементарная кристаллическая ячейка германия типа алмаза.

Аномальный пик на кривой теплоёмкости германия: 1 — экспериментальная кривая; 2 — дебаевская (колебательная) составляющая; 3 — аномальный остаток (разность кривой 1 и 2); 4,5,6 — больцмановские составляющие аномального остатка 3.
Германий — хрупкий, серебристо-белый полуметалл. Кристаллическая решётка устойчивой при нормальных условиях аллотропной модификации — кубическая типа алмаза.
Температура плавления 938,25 °C, температура кипения 2850 °C, плотность германия 5,33 г/см3.
Теплоёмкость германия имеет аномальный вид, а именно, содержит пик над уровнем нормальной (колебательной) составляющей, который, как пишет Ф.Зейтц : «не может быть объяснён никакой теорией, предполагающей гуковский закон сил, ибо никакая суперпозиция эйнштейновских функций не даёт кривой с максимумом» и объясняется, как и аномальность поведения теплоёмкостей гафния, алмаза и графита, больцмановским фактором, контролирующим диффузионную (диссоциационную) компоненту.
Германий является одним из немногих аномальных веществ, которые увеличивают плотность при плавлении. Плотность твёрдого германия 5,327 г/см3 (25 °С), жидкого — 5,557 г/см3 (1000 °С). Другие вещества, обладающие этим свойством — вода, кремний, галлий, сурьма, висмут, церий, плутоний.
Германий по электрофизическим свойствам является непрямозонным полупроводником.
Основные полупроводниковые свойства нелегированного монокристаллического германия
- Статическая диэлектрическая проницаемость ε = 16,0
- Ширина запрещённой зоны (при 300 К) Eg = 0,67 эВ
- Собственная концентрация ni=2,33⋅1013 см−3
- Эффективная масса:
- электронов, продольная: mII=1,58m0, mII=1,64m0
- электронов, поперечная: m┴=0,0815m0 , m┴=0,082m0
- дырок, тяжелых: mhh=0,379m0
- дырок, легких: mhl=0,042m0
- Энергия сродства к электрону: χ = 4,0 эВ.
Легированный галлием германий в виде тонкой плёнки переходит при низких температурах в сверхпроводящее состояние.
Изотопы
Основная статья: Изотопы германия
Природный германий состоит из смеси пяти изотопов: 70Ge (20,55 % ат.), 72Ge (27,37 %), 73Ge (7,67 %), 74Ge (36,74 %), 76Ge (7,67 %).
Первые четыре изотопа стабильны, пятый (76Ge) весьма слабо радиоактивен и испытывает двойной бета-распад с периодом полураспада 1,58⋅1021 лет.
Искусственно получено 27 радиоизотопов с атомными массами от 58 до 89. Наиболее стабильным из радиоизотопов является 68Ge, с периодом полураспада 270,95 суток. А наименее стабильным — 60Ge, с периодом полураспада 30 мс.
Химические свойства
В химических соединениях германий обычно проявляет валентности 4 или 2. Соединения с валентностью 4 стабильнее. При нормальных условиях устойчив к действию воздуха и воды, щелочей и кислот, растворим в царской водке и в щелочном растворе перекиси водорода.
Соединения германия
Неорганические
- Гидриды
- Гермилен GeH2
- Герман GeH4
- Дигерман Ge2H6
- Тригерман Ge3H8
- Оксиды
- Оксид германия (II) GeO
- Оксид германия (IV) GeO2
- Гидроксиды
- Гидроксид германия (II) Ge(OH)2
- Гидроксид германия (IV) Ge(OH)4
- Метагидроксид германия (IV) GeO(OH)2
- Соли
- Галогениды
- Бромид германия (IV) GeBr4
- Йодид германия (II) GeI2
- Йодид германия (IV) GeI4
- Фторид германия (IV) GeF4
- Хлорид германия (IV) GeCl4
- Нитрид германия (IV) Ge3N4
- Сульфид германия (II) GeS
- Сульфид германия (IV) GeS2
- Сульфат германия (IV) Ge(SO4)2
- Галогениды
Органические
Основная статья: Германийорганические соединения
Германийорганические соединения — металлоорганические соединения содержащие связь «германий-углерод». Иногда ими называются любые органические соединения, содержащие германий.
Первое германоорганическое соединение — тетраэтилгерман, было синтезировано немецким химиком Клеменсом Винклером (нем. Clemens Winkler) в 1887 году
- Тетраметилгерман (Ge(CH3)4)
- Тетраэтилгерман (Ge(C2H5)4).
- Изобутилгерман ((CH3)2CHCH2GeH3)
Применение
В 2007 году основными потребителями германия были: 35 % волоконная оптика; 30 % тепловизорная оптика; 15 % химические катализаторы; 15 % электроника; небольшие количества германия потребляет металлургия.
Оптика

Пример инфракрасной линзы из германия

Пример линзы из кристаллического германия в военных инфракрасных камерах на танке Армата Т-14
- Благодаря прозрачности в инфракрасной области спектра металлический германий сверхвысокой чистоты имеет стратегическое значение в производстве оптических элементов инфракрасной оптики: линз, призм, оптических окон датчиков. Наиболее важная область применения — оптика тепловизионных камер, работающих в диапазоне длин волн от 8 до 14 микрон. Это диапазон для наиболее популярных инфракрасных матриц на микроболометрах используемых в системах пассивного тепловидения, военных системах инфракрасного наведения, приборах ночного видения, противопожарных системах. Германий также используется в ИК-спектроскопии в оптических приборах, использующих высокочувствительные ИК-датчики. Германий проигрывает по пропускающей способности света в диапазоне от 8 до 14 микрон сульфиду цинка. Однако германий в отличие от сульфида цинка продолжает пропускать порядка 25 % инфракрасного излучения до длины волны 23 микрона, поэтому является одним из основных материалов для длинноволновой инфракрасной оптики, обычно используемой в военных прицелах.
- Оптические детали из Ge обладают очень высоким показателем преломления (4,0) и обязательно требует использования просветляющих покрытий. В частности, используется покрытие из очень твердого алмазоподобного углерода, с показателем преломления 2,0.
- Наиболее заметные физические характеристики оксида германия (GeO2) — его высокий показатель преломления и низкая оптическая дисперсия. Эти свойства находят применение в изготовлении широкоугольных объективов камер, микроскопии, и производстве оптического волокна.
- Тетрахлорид германия используется в производстве оптоволокна, так как образующийся в процессе разложения этого соединения диоксид германия удобен для данного применения благодаря своему высокому показателю преломления и низкому оптическому рассеиванию и поглощению.
- Сплав GeSbTe используется при производстве перезаписываемых DVD. Сущность перезаписи заключается в изменении оптических свойств этого соединения при фазовом переходе под действием лазерного излучения.
Радиоэлектроника
- До 1970-х годов германий был основным полупроводниковым материалом электронной промышленности и широко использовался в производстве транзисторов и диодов. Впоследствии германий был полностью вытеснен кремнием. Германиевые транзисторы и диоды обладают характеристиками, отличными от кремниевых, ввиду меньшего напряжения отпирания p-n-перехода в германии — 0,35…0,4 В против 0,6…0,7 В у кремниевых приборов. Кроме того, обратные токи у германиевых приборов имеют сильную зависимость от температуры, и на несколько порядков больше таковых у кремниевых — скажем, в одинаковых условиях кремниевый диод будет иметь обратный ток 10 пА, а германиевый — 100 нА, что в 10000 раз больше. Также у германиевых приборов значительно выше шум и ниже температура, при которой происходит разрушение p-n-переходов. По советскому ГОСТ 10862-64 (1964 г.) и более поздним стандартам германиевые полупроводниковые приборы имеют обозначение, начинающиеся с буквы Г или цифры 1, например: ГТ313, 1Т308 — высокочастотные маломощные транзисторы, ГД507 — импульсный диод. До того транзисторы имели индексы, начинающиеся с букв С, Т или П (МП), а диоды — Д, и определить материал прибора по индексу было сложнее. Диоды и транзисторы с индексами меньше 100, были германиевыми, от 100 до 199, — кремниевыми. Далее индексы зависели от частоты и мощности, причём, у транзисторов и диодов правила отличались. До конца 1960-х гг. германиевые полупроводниковые приборы использовались повсеместно, в настоящее время германиевые диоды и транзисторы практически полностью вытеснены кремниевыми, как имеющими значительно лучшие эксплуатационные характеристики.
- Сейчас в электронике германий используется в СВЧ-устройствах, как составная часть структур SiGe, позволяя достичь субтерагерцовых частот. Работы Жореса Алфёрова по структурам SiGe, в частности, заложили основу этого направления.
- Теллурид германия применяется как стабильный термоэлектрический материал и компонент термоэлектрических сплавов (термо-ЭДС 50 мкВ/К).
Прочие применения
- Германий широко применяется в ядерной физике в качестве материала для детекторов гамма-излучения.
- В ювелирном сплаве Argentium® (серебро пробы 935 либо 960) германий является легирующим элементом, обеспечивающим формирование прозрачного и стойкого защитного оксидного слоя на поверхности изделий.
Экономика
Цены
| Год | Цена ($/кг) |
|---|---|
| 1999 | 1 400 |
| 2000 | 1 250 |
| 2001 | 890 |
| 2002 | 620 |
| 2003 | 380 |
| 2004 | 600 |
| 2005 | 660 |
| 2006 | 880 |
| 2007 | 1 240 |
| 2008 | 1 490 |
| 2009 | 950 |
Средние цены на германий в 2007 году
- Германий металлический $1200/кг
- Германия диоксид $840/кг
Биологическая роль
Германий обнаружен в животных и растительных организмах. Малые количества германия не оказывают физиологического действия на растения, но токсичны в больших количествах. Германий нетоксичен для плесневых грибков.
Для животных германий малотоксичен. У соединений германия не обнаружено фармакологическое действие. Допустимая концентрация германия и его оксида в воздухе — 2 мг/м³, то есть такая же, как и для асбестовой пыли.
Соединения двухвалентного германия значительно более токсичны.
Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Электрохимический ряд активности металлов | |
|---|---|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, | |
Источник
