Какие свойства проявляет фенол кислотные или основные

13 августа 2014
Автор
КакПросто!
Фенолы – это производные ароматических углеводородов, в молекулах которых гидроксильные группы –OH находятся у углеродных атомов бензольного кольца. По числу гидроксогрупп они бывает одноатомными (аренолы), двухатомными (арендиолы) и трехатомными (арентриолы). Простейший одноатомный фенол – гидроксибензол C6H5OH.
По электронному строению фенолы являются полярными соединениями, или диполями. Отрицательный конец диполя – это бензольное кольцо, положительный – группа –OH. Дипольный момент направлен к бензольному кольцу.
Поскольку гидроксильная группа – заместитель I рода, она повышает электронную плотность, особенно для орто- и пара-положений, в бензольном кольце. Это объясняется сопряжением, возникающим между одной из неподеленных электронных пар атома кислорода в OH-группе и π-системой кольца. Такое смещение неподеленной пары электронов приводит к повышению полярности связи O-H.
Взаимное влияние атомов и атомных групп в фенолах отражается на свойствах этих веществ. Так, увеличивается способность к замещению водородных атомов в орто- и пара-положениях бензольного ядра, и обычно в результате таких реакций замещения образуются тризамещенные производные фенола. Повышение полярности связи между кислородом и водородом обусловливает появление достаточно большого положительного заряда (δ+) на атоме водорода, в связи с чем фенол диссоциирует в водных растворах по кислотному типу. В результате диссоциации образуются фенолят-ионы и катионы водорода.
Фенол C6H5OH – слабая кислота, называемая также карболовой кислотой. В этом заключается главное отличие фенолов от спиртов – неэлектроолитов.
По физическим свойствам C6H5OH – бесцветное кристаллическое вещество с температурой плавления 43˚C и температурой кипения 182˚C. На воздухе он окисляется и приобретает розовую окраску. При обычных условиях фенол ограниченно растворим в воде, но при нагревании выше 66˚C смешивается с H2O в любых отношениях. Это токсичное для человека вещество, способное вызывать ожоги кожи, антисептик.
Подобно всем кислотам, фенол диссоциирует в водных растворах, а также взаимодействует со щелочами с образованием фенолятов. Например, реакция C6H5OH и NaOH дает в итоге фенолят натрия C6H5ONa и воду H2O:
C6H5OH+NaOH=C6H5ONa+H2O.
Это свойство отличает фенолы от спиртов. Сходство со спиртами – реакция с активными металлами с образованием солей – фенолятов:
2C6H5OH+2K=2C6H5OK+H2↑.
Феноляты натрия и калия, образующиеся в результате двух последних реакций, легко разлагаются под действием кислот, даже такой слабой, как угольная. Из этого можно сделать вывод, что фенол – более слабая кислота, чем H2CO3:
C6H5ONa+H2O+CO2=C6H5OH+NaHCO3.
Источник
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Кислотные свойства
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода: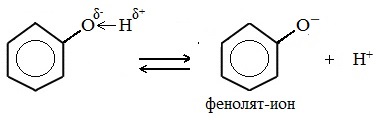
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2- , Br- )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот: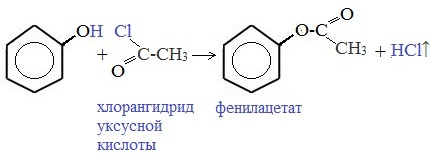
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
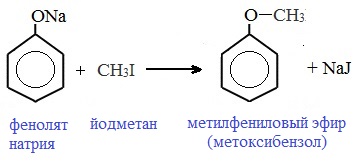
II. Реакции, с участием бензольного кольца
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+М-эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
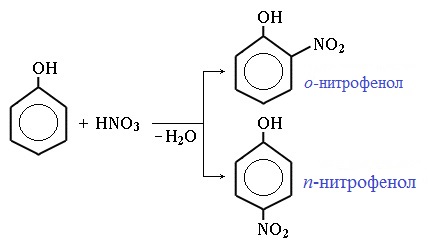
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):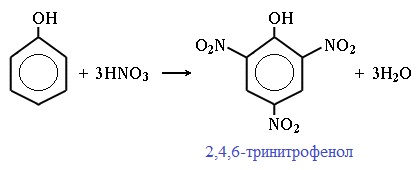
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.

2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол!):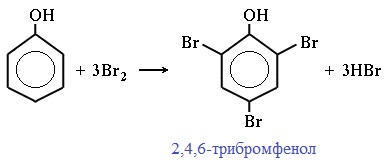
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: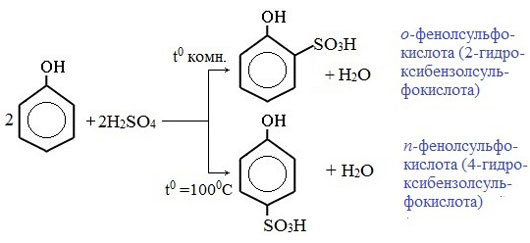 Реакции присоединения
Реакции присоединения
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
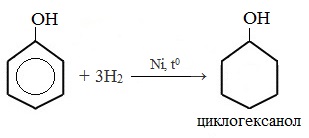
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
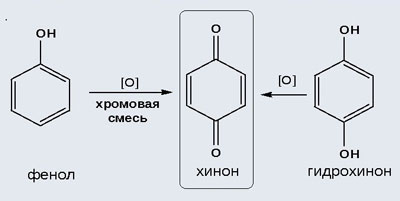
IV. Качественная реакция! – обнаружение фенола
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
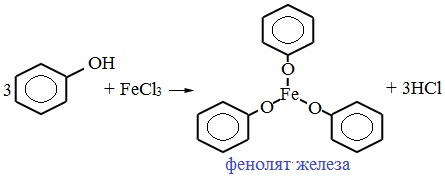
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Фенолы
Источник
Для фенолов, как и для других енолов, характерная кето-енольная таутомерия. Однако большинство одноатомных фенолов существует исключительно в енольной форме. Такая устойчивость енольной формы по сравнению с кетонами обусловлена ароматичностью бензольного ядра, а также высокой степенью сопряжения пары электронов атома гидроксильного кислорода с $pi$-электронной системой бензольного кольца ($rho-pi$-сопряжение):
Рисунок 1.
В результате указанного сопряжения электронная плотность кислорода смещается к бензольному ядру и усиливает его электронодонорные свойства, несмотря на $-I$-эффект $OH$-группы. При этом $O-H$-связь становится более полярной, что способствует ее ионизации с образованием протона и фенолят-аниона. Итак, фенолы – это типичные $OH$-кислоты:
Рисунок 2.
В фенолят-анионе отрицательный заряд атома кислорода значительно делокализован, что повышает его устойчивость, но уменьшает основность по сравнению с алкоксид-анионом $RO^-$. Рассредоточение отрицательного заряда можно передать с помощью резонансных структур I-IV, которые невозможны для алифатических спиртов:
Рисунок 3.
Фенолы как кислоты
Как кислоты фенолы сильнее, чем вода и спирты, но слабее, чем угольная, цианидная и карбоновые кислоты:
Рисунок 4.
Поэтому фенолы взаимодействуют не только с натрием, но и, в отличие от алканолов, с сильными основаниями – щелочами. Со слабыми основаниями вроде гидрокарбонатов щелочных металлов фенолы не взаимодействуют:
Рисунок 5.
Это используют для разделения смесей спиртов, фенолов и карбоновых кислот по схеме:
Рисунок 6.
Приведенный способ разделения не может быть применен, если все три исходных соединения растворяются в воде.
Феноляты щелочных металлов аналогично солям сильных оснований и слабых кислот легко гидролизуются водой, и раствор проявляет сильнощелочную реакцию:
Рисунок 7.
Зависимость кислотности фенолов зависит от заместителя в ядре
Кислотность фенолов зависит от природы заместителя в ядре. Электроноакцепторные заместители увеличивают кислотность, а электронодонорные – уменьшают. Влияние природы заместителя на фенолы противоположна его действия на основность ароматических аминов. Так, введение сильной акцепторной нитрогруппы изменяет значение показателя кислотности $pK_a$ фенолов следующим образом:
Рисунок 8.
Повышение кислотности объясняется способностью $NO_2$-группы участвовать в делокализации отрицательного заряда феноксидного аниона. При наличии в молекуле фенола трех нитрогрупп кислотные свойства, например, пикриновой кислоты достигают уровня минеральных.
В таблице 1 приведены значение показателя кислотности $pK_a$ некоторых замещенных фенолов в воде при 25$^circ$С с расположением заместителя в орто-, мета– и пара– положении.
Значение $pK_a$ орто-, мета– и пара-замещенных фенолов в воде при 25$^circ$С:
В таблице 2 приведены значение показателя кислотности $pK_a$ некоторых замещенных фенолов в воде при 25$^circ$С.
Значение $pK_a$ замещенных фенолов в воде при 25$^circ$С:
Рисунок 10.
Феноляты тяжелых металлов
Фенолы способны образовывать феноляты не только со щелочными металлами, но и с солями тяжелых металлов. Так, с солями железа (III) они дают окрашенные в фиолетовый цвет комплексные соединения, поэтому соли $Fe$(III) выступают как реактивы на енольный (фенильный) гидроксил:
Рисунок 11.
Источник
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов

Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.

Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты:

В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.

Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия
Видеоопыт взаимодействия фенола с гидроксидом натрия можно посмотреть здесь.
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:

1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода.
Видеоопыт взаимодействия фенола с натрием можно посмотреть здесь.
2. Реакции фенола по бензольному кольцу
Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце.
2.1. Галогенирование
Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол).
Видеоопыт взаимодействия фенола с бромом можно посмотреть здесь.
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):

3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.

4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видеоопыт взаимодействия фенола с хлоридом железа (III) можно посмотреть здесь.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.

1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:

Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:

Суммарное уравнение реакции:

3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Источник
Реакции по гидроксильной группе
Фенол обладает слабыми кислотными свойствами (тривиальное название фенола – карболовая кислота), поэтому взаимодействует с щелочными металлами и щелочами. Кислотные свойства выражены более ярко, чем у предельных одноатомных спиртов, что связано с взаимодействием электронной пары атома кислорода с электронной плотностью бензольного ядра (вспомните: гидроксильная группа является ориентантом I рода).

При взаимодействии с щелочными металлами и щелочами образуются соли — феноляты (например, фенолят натрия – $C_6H_5ONa$):
$2C_6H_5OH + 2Na longrightarrow 2C_6H_5ONa + H_2uparrow$
$C_6H_5OH + NaOH longrightarrow C_6H_5ONa + H_2O$
Реакции электрофильного замещения по бензольному ядру
Фенол вступает в реакции электрофильного замещения по ароматическому кольцу и этим фенол напоминает бензол. Гидроксильная группа, являясь ориентантом I рода, увеличивает реакционную способность кольца к этим реакциям, и направляет замещение в орто- и пара-положения. Фенол достаточно легко вступает в реакции, галогенирование, нитрования и сульфирования. Фенол также подвергается формилированию и ацилированию.
а) галогенирование (бромирование) фенола:

Реакция протекает по следующему механизму:
Галогенирование фенолов не требует присутствия кислот Льюиса ($FeCl_3$, $FeBr_3$, $AlCl_3$ и др.), как при электрофильном замещении бензола, и легко осуществляется под действием молекулярного галогена. В результате реакции образуется нерастворимое твердое вещество белого цвета – 2,4,6-трибромфенол. Эта реакция настолько чувствительна, что позволяет обнаружить фенол в концентрации $10^{- 5}$ М в водном растворе, поэтому является качественной реакцией на фенол.



б) нитрование фенола можно проводить различными способами:
нитрующей смесью ($HNO_3+H_2SO_4$ c образованием нитроний-катиона):
$HNO_3 + 2H_2SO_4 leftrightarrow NO_2^+ + 2HSO_4^- +H_3O^+$
Такие условия чаще используется для нитрования бензола и его алкилпроизводных по общей схеме:

Реакция протекает легче, чем с бензолом, по следующему механизму и приводит преимущественно к образованию орто-монопроизводного:
разбавленной азотной кислотой также приводит к образованию смеси орто- и пара-монопроизводных
последовательным добавлением концентрированной серной (сульфирование) и разбавленной азотной кислотами:

В результате последней реакции образуется образуется 2,4,6 -тринитрофенол (пикриновая кислота). Пикриновую кислоту также можно получить при нитровании фенола концентрированной азотной кислотой.
в) сульфирование фенола проводят концентрированной серной кислотой при нагревании:
Концентрированная серная кислота выполняет одновременно роль реагента и катализатора, в результате взаимодействия образуется сульфоний-катион, который начинает электрофильную атаку:
$H-O-SO_3H +H^+ longrightarrow HOH +SO_3H^+$
Механизм сульфирования аналогичен для бензола и его производных.
Как было установлено, скорость электрофильного замещения (в том числе процесса галогенирования, нитрования и сульфирования), сильно зависит от характера и расположения заместителей в ядре ароматического соединения. По своему влиянию на скорость процесса нитрования заместители могут быть расположены в следующем ряду:
Хлор и группы, расположенные левее его, замедляют скорость реакции и тем больше, чем дальше от хлора они стоят. Группы, расположенные вправо от хлора, ускоряют реакцию, и тем более, чем правее они расположены. Как видно, гидроксильная группа наиболее сильно ускоряет химическую реакцию.
другие химические свойства фенола
1. Качественной реакцией на фенол также является реакция с хлорным железом (III).

В результате реакции образуется трихлоридфенолят железа (III), имеющий фиолетовую окраску.



2. Гидрирование ароматического ядра фенола. Реакция проходит легко в присутствии катализатора, при этом гидрируются двойные связи бензольного ядра с образованием циклогексанола:
3. Реакция поликонденсации фенола с альдегидами. В результате реакции образуется полимерный продукт – фенолформальдегидная смола, которая широко используется при изготовлении древесно-стружечных плит (ДСП).
Определение
Реакция поликонденсации – реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта (воды, аммиака и др.)

Линейные молекулы полимера образуются при обычной температуре, при нагревании полимер приобретает разветвленное строение.

При нагревании с избытком формальдегида получаютсятвердые пластмассы с уникальными свойствами, которые пименяют при производстве лаков, клеев и красок, деталей электроприборов, мебели.
4. Для фенола также характерно карбоксилирование (реакция Кольбе-Шмитта), то есть нуклеофильное присоединение фенолят-иона к диоксиду углерода в жестких условиях (100 атм, 120 град):

Данная реакция используется для синтеза салициловой кислоты, которая является прекурсором аспирина.
Источник
