Какие свойства проявляет cl2

Основаны на процессе окисления анионов Cl-
2Cl– 2e- = Cl20
Электролиз водных растворов хлоридов, чаще – NaCl:
2NaCl + 2Н2O = Cl2↑ + 2NaOH + H2↑
Окисление конц. HCI различными окислителями:
4HCI + MnO2 = Cl2↑ + МпCl2 + 2Н2O
16НСl + 2КМпО4 = 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2O
6HCl + КСlO3 = ЗCl2↑ + KCl + 3Н2O
14HCl + К2Сr2O7 = 3Cl2↑ + 2CrCl3 + 2KCl + 7Н2O
Хлор – очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl-:
Cl20+ 2e- = 2Cl-
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Примеры:
Cl2+ 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Примеры:
Cl2 + Сu = CuCl2
3Cl2 + 2Аu = 2AuCl3
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Примеры:
Cl2 + Н2 =2НС1
Cl2 + 2S (расплав) = S2Cl2
ЗCl2 + 2Р = 2РCl3 (или РCl5 — в избытке Cl2)
2Cl2 + Si = SiCl4
3Cl2 + I2 = 2ICl3
Примеры:
Cl2 + 2KBr = Br2 + 2KCl
Cl2 + 2KI = I2 + 2KCl
Cl2 + 2HI = I2 + 2HCl
Cl2 + H2S = S + 2HCl
ЗСl2 + 2NH3 = N2 + 6HCl
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl-, а другие в положительной степени окисления входят в состав анионов ClO- или ClO3-.
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Cl2 + 2КОН =KCl + KClO + Н2O
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2O
3Cl2 + 2Са(ОН)2 = CaCl2 + Са(ClO)2+ 2Н2O
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 – гипохлориты; КClO3 – хлорат калия (бертолетова соль).
а) замещение атомов водорода в молекулах ОВ
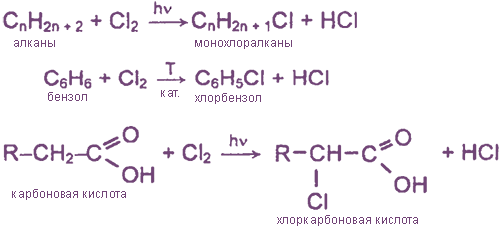
б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
H2C=CH2 + Cl2 → ClH2C-CH2Cl 1,2-дихлорэтан
HC≡CH + 2Cl2 → Cl2HC-CHCl2 1,1,2,2-тетрахлорэтан
Хлороводород и соляная кислота
HCl – хлорид водорода. При об. Т – бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F2 = Сl2 + 2HF
4HCl + O2 = 2Сl2 + 2Н2O
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
1. Синтез из простых веществ:
Н2 + Cl2 = 2HCl
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется ~ 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н+
HCl → H+ + Cl-
Взаимодействие:
а) с металлами (до Н):
2HCl2 + Zn = ZnCl2 + H2
б) с основными и амфотерными оксидами:
2HCl + CuO = CuCl2 + Н2O
6HCl + Аl2O3 = 2АlCl3 + ЗН2O
в) с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН)2 = CaCl2 + 2Н2О
3HCl + Аl(ОН)3 = АlСl3 + ЗН2O
г) с солями более слабых кислот:
2HCl + СаСО3 = CaCl2 + СO2 + Н3O
HCl + C6H5ONa = С6Н5ОН + NaCl
д) с аммиаком:
HCl + NH3 = NH4Cl
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl-окисляется до свободного галогена:
2Cl– 2e- = Cl20
Уравнения реакция см. “Получение хлора”. Особое значение имеет ОВР между соляной и азотной кислотами:
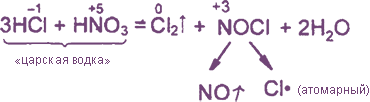
Взаимодействие:
а) с аминами (как органическими основаниями)
R-NH2 + HCl → [RNH3]+Cl-
б) с аминокислотами (как амфотерными соедимнеиями)

Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора – чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.


гипохлориты | хлориты | хлораты | перхлораты |
NaClOKClOCa(ClO)2 | Ca(ClO2)2 | KClO3 бертолетова сольMg(ClO3)2 | KClO4NaClO4NH4ClO4 |
1. Все оксокислоты хлора и их соли являются сильными окислителями.
2. Почти все соединения при нагревании разлагаются за счет внутримолекулярного окисления-восстановления или диспропорционирования.
Примеры:

Хлорная известь
Хлорная (белильная) известь – смесь гипохлорита и хлорида кальция, обладает отбеливающим и дезинфицирующим действием. Иногда рассматривается как пример смешанной соли, имеющей в своем составе одновременно анионы двух кислот:

Жавелевая вода
Водный раствор хлорида и гапохлорита калия KCl + KClO + H2O
Источник

- Обозначение – Cl (Chlorum);
- Период – III;
- Группа – 17 (VIIa);
- Атомная масса – 35,4527;
- Атомный номер – 17;
- Радиус атома = 99 пм;
- Ковалентный радиус = 102±4 пм;
- Распределение электронов – 1s22s22p63s23p5;
- t плавления = 100,95°C;
- t кипения = -34,55°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 3,16/-;
- Степень окисления: +7, +6, +5, +4, +3, +1, 0, -1;
- Плотность (н. у.) = 3,21 г/см3;
- Молярный объем = 18,7 см3/моль.
- Уравнения окислительно-восстановительных реакций хлора (метод электронного баланса).
- Уравнения окислительно-восстановительных реакций хлора (метод полуреакций).
- Соляная кислота
Хлор в чистом виде впервые выделил шведский ученый Карл Шееле в 1774 году. Своё нынешнее название элемент получил в 1811 году, когда Г.Дэви предложил название “хлорин”, которое вскоре было сокращено до “хлор” с легкой руки Ж. Гей-Люссака. Немецкий ученый Иоганн Швейгер предложил для хлора название “галоген”, но этим термином было решено назвать всю группу элементов, в которую входит и хлор.
Хлор является самым распространенным галогеном в земной коре – на долю хлора приходится 0,025% всей массы атомов земной коры. По причине своей высокой активности хлор не встречается в природе в свободном виде, а только в составе соединений, при этом хлору “по барабану” с каким элементом вступать в реакцию, современной науке известны соединения хлора практически со всей таблицей Менделеева.
Основная масса хлора на Земле содержится в соленой воде Мирового океана (содержание 19 г/л). Из минералов больше всего хлора содержится в галите, сильвине, сильвините, бишофите, карналлите, каините.
Хлор играет важную роль в деятельности нервных клеток, а также в регуляции осмотических процессов, происходящих в организме человека и животных. Также хлор входит в состав зеленого вещества растений – хлорофилла.
Природный хлор состоит из смеси двух изотопов:
- 35Cl – 75,5%
- 37Cl – 24,5%
Хлор в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером “17”, относится к галогенам (См. Атомы элементов 17(VIIa) группы (галогены)).
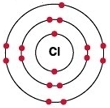
Рис. Строение атома хлора.
Электронная конфигурация атома хлора – 1s22s22p63s23p5 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 5 электронов, находящихся на внешнем 3p-уровне + 2 электрона 3s уровня (всего 7 электронов), поэтому в соединениях хлор может принимать степени окисления от +7 до -1. Как уже было сказано выше, хлор является химически активным галогеном.
Физические свойства хлора:
- при н.у. хлор является ядовитым газом желто-зеленого цвета с резким запахом;
- хлор в 2,5 раза тяжелее воздуха;
- при н.у. в 1 л воды растворяется 2,5 объема хлора – этот раствор называется хлорная вода.
Химические свойства хлора
Взаимодействие хлора с простыми веществами (Cl выступает в роли сильного окислителя):
- с водородом (реакция протекает только при наличии света):
Cl2+H2 = 2HCl
- с металлами с образованием хлоридов:
Cl20+2Na0 = 2Na+1Cl-1
3Cl20+2Fe0 = 2Fe+3Cl3-1 - с неметаллами, менее электроотрицательными, чем хлор:
Cl20+S0 = S+2Cl2-1
3Cl20+2P0 = 2P+3Cl3-1 - с азотом и кислородом хлор не реагирует непосредственно.
Взаимодействие хлора со сложными веществами:
Одной из самых известных реакций хлора со сложными веществами есть взаимодействие хлора с водой – кто живет в большом городе, наверняка, периодически сталкивается с ситуацией, когда, открыв кран с водой, ощущает стойкий запах хлора, после чего многие сетуют, дескать, опять воду хлорировали. Хлорирование воды является одним из основных способов ее обеззараживания от нежелательных микроорганизмов, небезопасных для здоровья человека. Почему так происходит? Разберем реакцию хлора с водой, которая протекает в два этапа:
- На первом этапе происходит образование двух кислот: соляной и хлорноватистой:
Cl20+H2O ↔ HCl-1+HCl+1O
- На втором этапе хлорноватистая кислота разлагается с выделением атомарного кислорода, который окисляет воду (убивая микроорганизмы) + подвергает отбеливающему действию ткани, окрашенные органическими красителями, если их опустить в хлорную воду:
HClO = HCl+[O] – реакция идет на свету
С кислотами хлор не взаимодействует.
Взаимодействие хлора с основаниями:
- на холоде:
Cl20+2NaOH = NaCl-1+NaCl+1O+H2O
- при нагревании:
3Cl20+6KOH = 5KCl-1+KCl+5O3+3H2O
- с бромидами металлов:
Cl3+2KBr = 2KCl+Br2↓
- с йодидами металлов:
Cl2+2KI = 2KCl+I2↓
- с фторидами металлов хлор не реагирует, по причине их более высокой окислительной способности, нежели у хлора.
Хлор “охотно” вступает в реакции с органическими веществами:
Cl2+CH4 → CH3Cl+HCl
Cl2+C6H6 → C6H5Cl+HCl
В результате первой реакции с метаном, которая протекает на свету, образуется хлористый метил и соляная кислота. В результате второй реакции с бензолом, которая протекает в присутствии катализатора (AlCl3), образуется хлорбензол и соляная кислота.
- Уравнения окислительно-восстановительных реакций хлора (метод электронного баланса).
- Уравнения окислительно-восстановительных реакций хлора (метод полуреакций).
Получение и применение хлора
Промышленным способом хлор получают электролизом водного раствора (хлор выделяется на аноде; на катоде – водород) или расплава хлорида натрия (хлор выделяется на аноде; на катоде – натрий):
2NaCl+2H2O → Cl2↑+H2↑+2NaOH
2NaCl → Cl2↑+2Na
В лаборатории хлор получают действием концентрированной HCl на различные окислители при нагревании. В роли окислителей могут выступать оксид марганца, перманганат калия, бертолетова соль:
4HCl-1+Mn+4O2 = Mn+2Cl2+Cl20↑+2H2O
2KMn+7O4+16HCl-1 = 2KCl+2Mn+2Cl2+5Cl20↑+8H2O
KCl+5O3+6HCl-1 = KCl+3Cl20↑+3H2O
Применение хлора:
- отбеливание тканей и бумаги;
- обеззараживание воды;
- производство пластмасс;
- производство хлорной извести, хлороформа, ядохимикатов, моющих средств, каучуков;
- синтез хлороводорода в производстве соляной кислоты.
См. далее: Соляная кислота
Источник
|
| |||||||||||||||||||||||||||||||||||||||
ПОЛЕЗНЫЕ ССЫЛКИ: БОНУСЫ ИНЖЕНЕРАМ!: | Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Свойства рабочих сред / / Хлор Cl2 / / Химические, физические и тепловые свойства хлора Cl2.
| |||||||||||||||||||||||||||||||||||||||
Нашли ошибку? Есть дополнения? Напишите нам об этом, указав ссылку на страницу. | ||||||||||||||||||||||||||||||||||||||||
TehTab.ru Реклама, сотрудничество: info@tehtab.ru | Обращаем ваше внимание на то, что данный интернет-сайт носит исключительно информационный характер. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Все риски за использование информаци с сайта посетители берут на себя. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. | |||||||||||||||||||||||||||||||||||||||
Источник
Õëîð – ýëåìåíò VII ïîäãðóïïû Ïåðèîäè÷åñêîé òàáëèöû Ä.È.Ìåíäåëååâà. Íà âíåøíåì óðîâíå – 7 ýëåêòðîíîâ, ïîýòîìó ïðè âçàèìîäåéñòâèè ñ âîññòàíîâèòåëÿìè, õëîð ïîêàçûâàåò ñâîè îêèñëèòåëüíûå ñâîéñòâà, ïðèòÿãèâàÿ ê ñåáå ýëåêòðîí ìåòàëëà.
Ôèçè÷åñêèå ñâîéñòâà õëîðà.
Õëîð ïðåäñòàâëÿåò ñîáîé æåëòûé ãàç. Èìååò ðåçêèé çàïàõ.
Õèìè÷åñêèå ñâîéñòâà õëîðà.
Ñâîáîäíûé õëîð î÷åíü àêòèâåí. Îí ðåàãèðóåò ñî âñåìè ïðîñòûìè âåùåñòâàìè, êðîìå êèñëîðîäà, àçîòà è áëàãîðîäíûõ ãàçîâ:
Si + 2Cl2 = SiCl4 + Q.
Ïðè âçàèìîäåéñòâèè ñ âîäîðîäîì ïðè êîìíàòíîé òåìïåðàòóðå ðåàêöèè ïðàêòè÷åñêè íåò, íî êàê òîëüêî îñâåùåíèå âûñòóïàåò â êà÷åñòâå âíåøíåãî âîçäåéñòâèÿ, âîçíèêàåò öåïíàÿ ðåàêöèÿ, êîòîðàÿ íàøëà ñâîå ïðèìåíåíèå â îðãàíè÷åñêîé õèìèè.
Ïðè íàãðåâå õëîð ñïîñîáåí âûòåñíèòü éîä èëè áðîì èç èõ êèñëîò:
Cl2 + 2HBr = 2HCl + Br2.
Ñ âîäîé õëîð ðåàãèðóåò, ÷àñòè÷íî ðàñòâîðÿÿñü â íåé. Ýòó ñìåñü íàçûâàþò õëîðíîé âîäîé.
Ðåàãèðóåò ñ ùåëî÷àìè:
Cl2 + 2NaOH = NaCl + NaClO + H2O (õîëîä),
Cl2 + 6KOH = 5KCl + KClO3 + 3 H2O (íàãðåâ).
Ïîëó÷åíèå õëîðà.
1. Ýëåêòðîëèç ðàñïëàâà õëîðèäà íàòðèÿ, êîòîðûé ïðîòåêàåò ïî ñëåäóþùåé ñõåìå:
2. Ëàáîðàòîðíûé ñïîñîá ïîëó÷åíèÿ õëîðà:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O.
Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Õèìè÷åñêèå ýëåìåíòû | |
| Õèìè÷åñêèå ýëåìåíòû Ïåðèîäè÷åñêîé ñèñòåìû Ìåíäåëååâà, ñâîéñòâà, âàëåíòíîñòü õèìè÷åñêèõ ýëåìåíòîâ | |
| Õèìè÷åñêèå ýëåìåíòû | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Õëîðèäû ìåòàëëîâ. | |
| Õëîðèä ìåòàëëîâ ýòî ïðîèçâîäíîå îò õëîðîâîäîðîäíîé êèñëîòû è àòîìîì ìåòàëëà. | |
| Õëîðèäû ìåòàëëîâ. | |
Источник

