Какие свойства проявляет азотная кислота

Эта статья включает описание термина «Меланж»; см. также другие значения.
| Азотная кислота | |
|---|---|
| Систематическое наименование | азотная кислота |
| Хим. формула | HNO3 |
| Состояние | жидкость |
| Молярная масса | 63,012 г/моль |
| Плотность | 1,513 г/см³ |
| Энергия ионизации | 11,95 ± 0,01 эВ[2] |
| Температура | |
| • плавления | −41,59 °C |
| • кипения | 82,6 °C |
| Мол. теплоёмк. | 109,9 Дж/(моль·К) |
| Энтальпия | |
| • образования | −174,1 кДж/моль |
| • плавления | 10,47 кДж/моль |
| • кипения | 39,1 кДж/моль |
| • растворения | −33,68 кДж/моль |
| Давление пара | 56 гПА |
| Константа диссоциации кислоты | −1,64 [1] |
| Растворимость | |
| • в воде | смешивается |
| Показатель преломления | 1,397 |
| Дипольный момент | 2,17 ± 0,02 Д |
| Рег. номер CAS | 7697-37-2 |
| PubChem | 944 |
| Рег. номер EINECS | 231-714-2 |
| SMILES | O[N+](=O)[O-] |
| InChI | InChI=1S/HNO3/c2-1(3)4/h(H,2,3,4) GRYLNZFGIOXLOG-UHFFFAOYSA-N |
| RTECS | QU5775000 |
| ChEBI | 48107 |
| Номер ООН | 2031 |
| ChemSpider | 919 |
| ЛД50 | 430 мг/кг |
| Токсичность | 3 класс (умеренноопасная) |
| Пиктограммы СГС | |
| NFPA 704 | 4 2 COR |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Азо́тная кислота́ (HNO3) — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентрацией 68,4 % и tкип 120 °C при нормальном атмосферном давлении. Известны два твёрдых гидрата: моногидрат (HNO3·H2O) и тригидрат (HNO3·3H2O). Кислота ядовита.
Физические и физико-химические свойства[править | править код]
Плотность раствора азотной кислоты в зависимости от концентрации
Фазовая диаграмма водного раствора азотной кислоты
Азот в азотной кислоте четырёхвалентен[3], степень окисления +5.
Азотная кислота — бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C (при нормальном атмосферном давлении) с частичным разложением. Азотная кислота смешивается с водой во всех соотношениях. Водные растворы HNO3 с массовой долей 0,95—0,98 называют «дымящей азотной кислотой», с массовой долей 0,6—0,7 — концентрированной азотной кислотой.
С водой образует азеотропную смесь (массовая доля 68,4 %, d20 = 1,41 г/см3, Tкип = 120,7 °C)
При кристаллизации из водных растворов азотная кислота образует кристаллогидраты:
- моногидрат HNO3·H2O, Tпл = −37,62 °C;
- тригидрат HNO3·3H2O, Tпл = −18,47 °C.
Твёрдая азотная кислота образует две кристаллические модификации:
- моноклинная сингония, пространственная группа P 21/a, параметры ячейки a = 1,623 нм, b = 0,857 нм, c = 0,631 нм, β = 90°, Z = 16;
- ромбическая
Моногидрат образует кристаллы ромбической сингонии, пространственная группа P na2, параметры ячейки a = 0,631 нм, b = 0,869 нм, c = 0,544 нм, Z = 4.
Плотность водных растворов азотной кислоты как функция её концентрации описывается уравнением
где d — плотность в г/см³, c — массовая доля кислоты. Данная формула плохо описывает поведение плотности при концентрации более 97 %.
Химические свойства[править | править код]
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять без разложения только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
б) с основаниями:
в) вытесняет слабые кислоты из их солей:
При кипении или под действием света азотная кислота частично разлагается:
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +5 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3
Разбавленная HNO3
б) с металлами, стоящими в ряду напряжений левее водорода:
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение концентрации кислоты увеличение активности металла
Продукты, полученные при взаимодействии железа с HNO3, разной концентрации
С золотом и платиной азотная кислота, даже концентрированная, не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
и сложные вещества, например:
Некоторые органические соединения (например амины, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Некоторые металлы (железо, хром, алюминий, кобальт, никель, марганец, бериллий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж».
Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:
Взаимодействие концентрированных азотной и соляной кислот с благородными металлами:
Нитраты[править | править код]
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы и некоторые соединения неметаллов, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется.
Соли азотной кислоты при нагревании необратимо разлагаются, причём состав продуктов разложения определяется катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния (исключая литий):
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью (а также литий):
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
г) нитрат аммония:
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии являются сильными окислителями, например, при сплавлении твердых веществ:
Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно.
С азотной кислотой не реагируют стекло, фторопласт-4.
Исторические сведения[править | править код]
Методика получения разбавленной азотной кислоты путём сухой перегонки селитры с квасцами и медным купоросом была, по-видимому, впервые описана в трактатах Джабира (Гебера в латинизированных переводах) в VIII веке. Этот метод с теми или иными модификациями, наиболее существенной из которых была замена медного купороса железным, применялся в европейской и арабской алхимии вплоть до XVII века.
В XVII веке Глаубер предложил метод получения летучих кислот реакцией их солей с концентрированной серной кислотой, в том числе и азотной кислоты из калийной селитры, что позволило ввести в химическую практику концентрированную азотную кислоту и изучить её свойства. Метод Глаубера применялся до начала XX века, причём единственной существенной модификацией его оказалась замена калийной селитры на более дешёвую натриевую (чилийскую) селитру.
Во времена М. В. Ломоносова и вплоть до середины XX века азотная кислота в обиходе именовалась крепкой водкой[4].
Промышленное производство, применение и действие на организм[править | править код]
Азотная кислота является одним из самых крупнотоннажных продуктов химической промышленности.
Производство азотной кислоты[править | править код]
Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой
Все три реакции — экзотермические, первая — необратимая, остальные — обратимые[5]. Концентрация полученной таким методом азотной кислоты колеблется в зависимости от технологического оформления процесса от 45 до 58 %. Для получения концентрированной азотной кислоты либо смещают равновесие в третьей реакции путём повышения давления до 50 атмосфер, либо в разбавленную азотную кислоту добавляют серную кислоту и нагревают, при этом азотная кислота, в отличие от воды и серной кислоты, испаряется[6].
В России масштабное производство азотной кислоты (10000 тонн в год) по этому методу началось в 1917 г. в Юзовке, сырьём служил аммиак из коксового газа (см. И.И. Андреев).
Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса:
Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой:
Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды.
Применение[править | править код]
- в производстве минеральных удобрений;
- в военной промышленности (дымящая — в производстве взрывчатых веществ, как окислитель ракетного топлива, разбавленная — в синтезе различных веществ, в том числе отравляющих);
- крайне редко в фотографии — разбавленная — подкисление некоторых тонирующих растворов[7];
- в станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише);
- в производстве красителей и лекарств (нитроглицерин);
- в ювелирном деле — основной способ определения золота в золотом сплаве;
- в основном органическом синтезе (нитроалканы, анилин, нитроцеллюлоза, тротил)
Действие на организм[править | править код]
Азотная кислота ядовита. По степени воздействия на организм относится к веществам 3-го класса опасности.
Её пары очень вредны: пары вызывают раздражение дыхательных путей, а сама кислота оставляет на коже долгозаживающие язвы. При действии на кожу возникает характерное жёлтое окрашивание кожи, обусловленное ксантопротеиновой реакцией. При нагреве или под действием света кислота разлагается с образованием высокотоксичного диоксида азота NO2 (газа бурого цвета). ПДК для азотной кислоты в воздухе рабочей зоны по NO2 2 мг/м3[8]. Рейтинг NFPA 704 для концентрированной азотной кислоты: опасность для здоровья: 4, огнеопасность: 0, нестабильность: 0, специальное: СOR[9]
Юникод[править | править код]
В Юникоде есть алхимический символ азотной кислоты (лат. Aqua fortis).
| Графема | Unicode | HTML | |||
|---|---|---|---|---|---|
| Код | Название | Шестнадцатеричное | Десятичное | Мнемоника | |
| ???? | U+1F705 | ALCHEMICAL SYMBOL FOR AQUAFORTIS | 🜅 | 🜅 | — |
См. также[править | править код]
- Красная дымящая азотная кислота
Примечания[править | править код]
- ↑ Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.,Л.: Химия, 1965. — Т. 3. — 1008 с.
- ↑ https://www.cdc.gov/niosh/npg/npgd0447.html
- ↑ Азотная кислота: свойства и реакции, лежащие в основе производства Архивировано 27 октября 2011 года.
- ↑ Крепкая водка // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.;
Крепкая водка // Корзинка — Кукунор. — М. : Советская энциклопедия, 1953. — С. 337. — (Большая советская энциклопедия : [в 51 т.] / гл. ред. Б. А. Введенский ; 1949—1958, т. 23). - ↑ Ходаков, 1976, pp. 43,60—61.
- ↑ Ходаков, 1976, p. 61.
- ↑ Азотная кислота // Фотокинотехника: Энциклопедия / Гл. ред. Е. А. Иофис. — М.: Советская энциклопедия, 1981. — 447 с.
- ↑ Межгосударственный стандарт ГОСТ 12.1.005-88, Приложение 2, стр. 1
- ↑ Fisher Scientific.
Литература[править | править код]
- Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. Неорганическая химия. Учебник для 9 класса. — 7-е изд. — М.: Просвещение, 1976. — 2 350 000 экз.
- Энциклопедический словарь юного химика, Сост. В. А. Крицман, В. В. Станцо. — 2-е издание, М., 1990.
- Ахметов Н. С. Общая и неорганическая химия. М.: Высшая школа, 2001.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
Ссылки[править | править код]
- Азотная кислота // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Nitric Acid 65—67% (англ.). fishersci.com. Fisher Scientific. Дата обращения 13 апреля 2018.
Источник
Строение молекулы азотной кислоты:
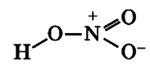
Связь N+-O- образуются по донорно-акцепторному механизму: атом азота отдает электрон, играя роль донора и приобретая положительный заряд, атом кислорода присоединяет электрон, выступая в роли акцептора и приобретая отрицательный заряд. Атомы азота проявляют степень окисления +5 (валентность 4).
Физические свойства азотной кислоты:
- бесцветная маслянистая жидкость с резким запахом;
- температура кипения 83°C
- плотность 1,4 г/см3 (63% HNO3);
- с водой смешивается в любых пропорциях, проявляя в водных растворах свойства сильной кислоты;
- легко разлагается на свету при длительном хранении, приобретая при этом желтый оттенок, в который ее окрашивает газ NO2, выделяющийся при разложении:
4HNO3 ↔ 2H2O+4NO2↑+O2↑
Химические свойства азотной кислоты
HNO3 является одной из самых сильных кислот – в водных растворах полностью диссоциирует на катионы водорода и нитрат-ионы:
HNO3 ↔ H++NO3-
Азотная кислота вступает в реакции:
- с оксидами металлов:
MgO+2H+NO3 = Mg2+(NO3)2+H2O - с основаниями:
Mg(OH)2+2H+NO3 = Mg2+(NO3)2+2H2O - с солями более слабых кислот:
Na2CO32-+2H+NO3 = 2NaNO3+CO2↑+H2O
Следует обратить внимание, что азотная кислота в обменных реакциях может взаимодействовать далеко не со всеми солями, а лишь только с теми, при реагировании с которыми образуются нерастворимые, слабодиссоциирующие и газообразные вещества, которые, по мере их образования, более не участвуют в реакции обмена. В обменных реакциях солями, при взаимодействии с которыми образуются растворимые в воде соли азотной кислоты, азотная кислота не участвует.
В окислительно-восстановительных реакциях азотная кислота выступает в роли сильного окислителя. Высокие окислительные свойства HNO3 объясняются тем, что в молекуле азотной кислоты атом азота в составе кислотного остатка NO3- имеет максимально возможную степень окисления +5. По этой причине окислительные свойства NO3- значительно превосходят “возможности” катионов водорода H+, из-за чего азотная кислота реагирует практически со всеми металлами за исключением золота,платины, родия, рутения, иридия и тантала, стоящими в конце ряда напряжений.

Характерной особенностью взаимодействия азотной кислоты с металлами является отсутствие выделения водорода, поскольку окислителями являются не катионы водорода, а нитрат-ионы NO3-, которые, при взаимодействии азотной кислоты с металлами восстанавливается тем полнее, чем более активным является металл и чем более разбавленной является HNO3.
По этой причине образование тех или иных продуктов реакции азотной кислоты и металла зависит от концентрации кислоты и активности металла.
Атом азота в молекуле азотной кислоты имеет степень окисления +5, и может принимать 1, 2, 3, 4, 5 или 8 электронов:
HN+5O3+1e- → N+4O2
HN+5O3+2e- → HN+3O2
HN+5O3+3e- → N+2O
HN+5O3+4e- → N2+1O
HN+5O3+5e- → N20
HN+5O3+8e- → N-3H3
HN+5O3+8e- → N-3H4NO3
Чем более концентрированной является азотная кислота, тем меньшей окислительной способностью по отношению к металлам она обладает.
С другой стороны, чем более активным является металл, тем в большей степени он восстанавливает азотную кислоту.
Примеры реакций азотной кислоты:
- концентрированная HN+5O3 с активными металлами (до алюминия в ряду напряжений) восстанавливается до N2O
10HN+5O3+4Ca0 = 4Ca+2(NO3)2+N2+1O↑+5H2O - концентрированная HN+5O3 с неактивными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2
4HN+5O3+Ni0 = Ni+2(NO3)2+2N+4O2↑+2H2O - концентрированная HN+5O3 с неметаллами (Ni, Cu, Ag, Hg) восстанавливается до NO2
4HN+5O3+P0 = HP+5O3+5N+4O2↑+2H2O - разбавленная HN+5O3 с активными металлами (до алюминия в ряду напряжений) образует аммиак или нитрат аммония
10HN+5O3+4Mg0 = 4Mg+2(NO3)2+N-3H4N+5O3+3H2O - разбавленная HN+5O3 с неактивными металлами образует оксид азота (II)
8HN+5O3+3Cu0 = 3Cu+2(NO3)2+2N+2O↑+4H2O - разбавленная HN+5O3 с неметаллами образует оксид азота (II)
2HN+5O3+S0 = H2S+6O4+2N+2O↑
Уравнения окислительно-восстановительных реакций азотной кислоты…
Концентрированная азотная кислота пассивирует алюминий, железо и хром, образуя на их поверхности очень прочную нерастворимую оксидную пленку:
2Al+6HNO3 = Al2O3+6NO2+3H2O
“Царская водка” (смесь концентрированной азотной кислоты с соляной в соотношении 1:3) окисляет золото и платину:
Au+3HNO3+3HCl = AuCl3+3NO2+3H2O
Получение и применение азотной кислоты
Промышленный способ получения азотной кислоты:
- окислением аммиака на платиновом катализаторе до оксида азота (II):
4N-3H3+5O20 = 4N+2O-2+6H2O - окислением оксида азота (II) до оксида азота (IV):
2N+2O-2+O20 = 2N+4O2-2 - растворением оксида азота (IV) в воде в присутствии кислорода (автор способа И.И.Андреев, 1916 г.):
4N+4O2+2H2O+O20 = 4HN+5O3-2
Лабораторный способ получения азотной кислоты:
- взаимодействием безводных нитратов с концентрированной серной кислотой:
NaNO3+H2SO4 = NaHSO4+HNO3
Применение азотной кислоты:
- производство азотных удобрений;
- в фармакологии для производства лекарственных препаратов;
- в производстве взрывчатых веществ.
Соли азотной кислоты
О солях азотной кислоты, наверняка, слышали многие, ведь в последнее время так много говорят о вреде нитратов в овощах и фруктах.
Нитраты калия, натрия, аммония и кальция называются селитрами (калийная селитра, натриевая селитра, аммонийная селитра, известковая селитра). Селитры нашли широкое применение в сельском хозяйстве в качестве минеральных азотных удобрений, что вполне логично, ибо азот является одним из основных элементов растений.
Нитраты хорошо растворяются в воде, при этом такие растворы не обладают окислительными свойствами, а вот расплавы нитратов являются хорошими окислителями.
Те нитраты, которые были образованы слабыми основаниями, гидролизуются, их водные растворы являются кислыми:
Cu2+(NO3)2+H2O ↔ CuOH+NO3+H+NO3
Соли азотной кислоты являются сильными окислителями.
Все нитраты, за исключением нитрата аммония разлагаются с выделением кислорода, при этом образующиеся продукты разложения зависят от электроотрицательности металла (см. таблицу выше):
- соли металлов, расположенных в ряду напряжений левее магния, при разложении образуют кроме кислорода еще и нитриты:
MeN+5O3 → MeN+3O2+O20↑
2KNO3 = 2KNO2+O2 - соли металлов, расположенных от магния до меди – образуют оксиды металла и азота (IV):
MeN+5O3 → MeO+N+4O2↑+O20↑
2Pb(NO3)2 = 2PbO+4NO2+O2 - соли металлов, расположенных правее меди – образуют свободный металл и оксид азота (IV):
MeN+5O3 → Me+N+4O2↑+O20↑
2AgNO3 = 2Ag+2NO2+O2 - нитрат аммония разлагается с образованием оксида азота (I) и воды:
NH4NO3 = N2O+2H2O
Нитраты вступают в реакции, типичные для всех солей:
- с металлами:
Hg(NO3)2+Zn = Zn(NO3)2+Hg - с щелочами:
Pb(NO3)2+2NaOH = Pb(OH)2↓+2NaNO3 - с кислотами:
Ba(NO3)2+H2SO4 = BaSO4↓+2HNO3 - с другими солями:
AgNO3+NaCl = AgCl↓+NaNO3
Получение и применение нитратов
Нитраты получают реакцией азотной кислоты:
- на металлы:
10HNO3(разб)+4Zn = 4Zn(NO3)2+NH4NO3+3H2O - на оксиды металлов:
2HNO3+CuO = Cu(NO3)2+H2O - на основания:
3HNO3+Al(OH)3 = Al(NO3)3+3H2O
Применение нитратов:
- Селитры используются в качестве минеральных удобрений:
- KNO3 – калийная или индийская селитра;
- NaNO3 – натриевая или чилийская селитра;
- NH4NO3 – аммонийная селитра;
- Ca(NO3)2 – известковая или норвежская селитра.
- Калийная селитра используется для изготовления “черного пороха”.
- Аммонийная селитра используют для изготовления взрывчатого вещества – аммонала.
Другие соединения азота:
- Аммиак
- Оксиды азота
Источник
