Какие свойства проявляет анилин аммиак
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
I. Основные свойства
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора!!!
Видеоопыт «Изучение среды раствора анилина»
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Особые свойства анилина
Реакции с участием аминогруппы
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях: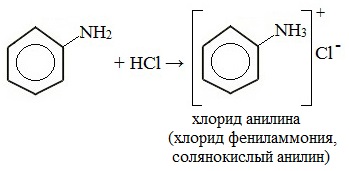
Видеоопыт «Взаимодействие анилина с соляной кислотой»
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
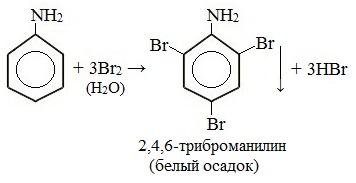
Качественная реакция на анилин!
Видеоопыт «Бромирование анилина»
2. Сульфирование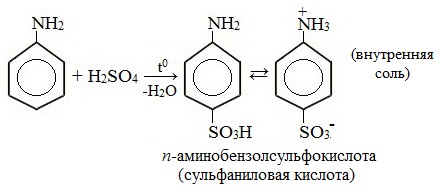
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
III. Окисление анилина
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция»
При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»).
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
Видеоопыт «Окисление анилина раствором дихроматом калия – получение красителей»
IV. Диазотирование анилина
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Анилин
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 2 декабря 2019; проверки требуют 12 правок.
| Анилин | |
|---|---|
| Традиционные названия | Аминобензол Анилин Бензоламин Фениламин |
| Хим. формула | C6H5NH2 |
| Рац. формула | C6H7N |
| Состояние | бесцветная или желтоватая жидкость |
| Молярная масса | 93,1265 ± 0,0055 г/моль |
| Плотность | 1,0217 г/см³ |
| Поверхностное натяжение | 43,3 Н/м |
| Динамическая вязкость | 3,71 Па·с |
| Энергия ионизации | 7,7 ± 0,1 эВ[1] |
| Скорость звука в веществе | 1659 м/с |
| Температура | |
| • плавления | −6,3 °C |
| • кипения | 184,13 °C |
| • вспышки | 158 ± 1 °F[1] и 76 °C |
| • самовоспламенения | 562 °C |
| Пределы взрываемости | 1,3 ± 0,1 об.%[1] |
| Критическая точка | |
| • температура | 425,65 °C |
| • давление | 5,134 МПа |
| Критическая плотность | 0,314 см³/моль |
| Давление пара | 0,6 ± 0,1 мм рт.ст.[1] |
| Растворимость | |
| • в воде | 3,6 г/100 мл |
| • в циклогексане | 66,7 (30,8°C) |
| Диэлектрическая проницаемость | 6,89 |
| Показатель преломления | 1,5863 |
| Дипольный момент | 1,53 Д |
| Рег. номер CAS | 62-53-3 |
| PubChem | 6115 |
| Рег. номер EINECS | 200-539-3 |
| SMILES | NC1=CC=CC=C1 |
| InChI | InChI=1S/C6H7N/c7-6-4-2-1-3-5-6/h1-5H,7H2 PAYRUJLWNCNPSJ-UHFFFAOYSA-N |
| RTECS | BW6650000 |
| ChEBI | 17296 |
| Номер ООН | 1547 |
| ChemSpider | 5889 |
| Предельная концентрация | 0,3 мг/м3 |
| ЛД50 | 9-12 мг/кг (кошки, внутрижелудочно), 132 мг/кг (мыши, внутрижелудочно) |
| Токсичность | Чрезвычайно токсичен для мелких млекопитающих, высокотоксичен для человека, является гематотоксином (вызывает гемолиз). |
| Пиктограммы ECB | |
| NFPA 704 | 2 4 1 POI |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Анили́н (аминобензол, фениламин) — органическое соединение с формулой C6H5NH2, родоначальник класса ароматических аминов. Представляет собой бесцветную маслянистую жидкость с характерным запахом, немного плотнее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Весьма токсичен. Название «анилин» происходит от названия одного из растений, содержащих индиго — Indigofera anil (современное международное название растения — Indigofera suffruticosa).
История[править | править код]
Впервые анилин был получен в 1826 году при перегонке индиго с известью немецким химиком Отто Унфердорбеном, который дал ему название «кристаллин».
В 1834 году Фридлиб Фердинанд Рунгe обнаружил анилин в каменноугольной смоле и назвал «кианолом».
В 1840 году Юлий Фрицше получил анилин нагреванием индиго с раствором гидроксида калия и назвал его «анилином».
В 1842 году Николай Зинин получил анилин восстановлением нитробензола действием (NH4)2S и назвал его «бензидамом».
В 1843 году Август Вильгельм Гофман установил идентичность всех перечисленных соединений.
Промышленное производство фиолетового красителя мовеина на основе анилина началось в 1856 году.
Получение[править | править код]
В промышленности анилин получают в две стадии. На первой стадии бензол нитруется смесью концентрированной азотной и серной кислот при температуре 50—60 °C, в результате образуется нитробензол. На втором этапе нитробензол гидрируют при температуре 200—300 °C в присутствии катализаторов:
Впервые восстановление нитробензола было произведено с помощью железа:
Другим способом получение анилина является восстановление нитросоединений — реакция Зинина:
Также, в анилин — идёт восстановление нитробензола цинком в присутствии избытка соляной кислоты.
;
;
И этот избыток связывает образующийся анилин в соль под названием хлорид фениламмония (анилин солянокислый):
;
Эта соль легко растворима в образующейся при этом воде и может быть выкристаллизована из неё,
к тому же после обработки щелочью хлорид фениламмония — даёт анилин:
Химические свойства[править | править код]
Для анилина характерны реакции как по аминогруппе, так и по ароматическому кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов. С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению с алифатическими аминами и даже с аммиаком. С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол. Хорошо галогенируется, нитруется и сульфируется. Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок). С HNO2 дает диазосоединения.
Окисление[править | править код]
В отличие от аминов алифатического ряда, ароматические амины легко окисляются. Примером может служить реакция хромовой смеси с анилином, в результате образуется краситель «чёрный анилин».
Классическая реакция окисления анилина дихроматом калия в кислой среде часто используется как качественная реакция на анилин:
Аналитическим эффектом в данном случае служит появление окраски раствора от тёмно-синей до чёрной. Как и в большинстве реакций окисления анилина, продуктами являются различные Хиноны.
Другой качественной реакцией на анилин, очень чувствительной, является окисление анилина хлорной известью, при котором появляется фиолетовое окрашивание[2].
Реакции электрофильного замещения[править | править код]
Аминогруппа, являясь заместителем первого рода, оказывает сильное активирующее влияние на бензольное кольцо, из-за чего при нитровании может произойти окисление молекулы анилина. Для предотвращения окисления аминогруппу перед нитрованием «защищают» ацилированием.
Реакции на азот[править | править код]
С азотистой кислотой образует катион диазония, например:
Эта реакция может быть использована для получения фенола, если вместо соляной кислоты использовать разбавленную серную:
Где сначала образуется та же диазониевая соль, которая при нагревании в разбавленном водном растворе гидролизуется и разлагается до фенола, при этом выделяется молекулярный азот.
В связи с нестойкостью азотистой кислоты её часто заменяют нитритом щёлочного металла в кислой среде. Диазониевые соли используют для реакции Зандмейера.
Другие реакции[править | править код]
Гидрирование анилина в присутствии никелевого катализатора даёт циклогексиламин.
Анилин взаимодействует с соляной кислотой с образованием хлорида фениламмония[3]:
Анилин взаимодействует с бромом и даже бромной водой с образованием 2,4,6-триброманилина[4]:
Производство и применение[править | править код]
Изначально анилин получали восстановлением нитробензола молекулярным водородом; практический выход анилина не превышал 15 %. При взаимодействии концентрированной соляной кислоты с железом выделялся атомарный водород, более химически активный по сравнению с молекулярным. Реакция Зинина является более эффективным методом получения анилина. В реакционную массу вливали нитробензол, который восстанавливается до анилина.
По состоянию на 2002 год, в мире основная часть производимого анилина используется для производства метилдиизоцианатов, используемых затем для производства полиуретанов. Анилин также используется при производстве искусственных каучуков, гербицидов и красителей (фиолетового красителя мовеина)[5].
В России он в основном применяется в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты), но в связи с ожидаемым ростом производства полиуретанов возможно значительное изменение картины в среднесрочной перспективе.
Биологические свойства[править | править код]
Анилин — высокотоксичное вещество. В больших концентрациях фениламин оказывает негативное воздействие на центральную нервную систему. Кровеносный яд, вызывает кислородное голодание организма за счёт образования в крови метгемоглобина, гемолиза и дегенеративных изменений эритроцитов.
В организм анилин проникает при дыхании, в виде паров, а также через кожу и слизистые оболочки. Всасывание через кожу усиливается при нагреве воздуха или приёме алкоголя.
При лёгком отравлении анилином наблюдаются слабость, головокружение, головная боль, синюшность губ, ушных раковин и ногтей. При отравлениях средней тяжести также наблюдаются тошнота, рвота, иногда, шатающаяся походка, учащение пульса. Тяжёлые случаи отравления аминобензолом крайне редки.
При хроническом отравлении анилином (анилизм) возникают токсический гепатит, а также нервно-психические нарушения, расстройство сна, снижение памяти и т. д.
При отравлении анилином необходимо прежде всего удаление пострадавшего из очага отравления, обмывание тёплой (но не горячей!) водой. Также применяют введение антидотов (метиленовая синь), сердечно-сосудистые средства или вдыхание карбогена. Пострадавшему надо обеспечить покой.
Предельно допустимая концентрация анилина в воздухе рабочей зоны 0,3мг/м3[6] по ГОСТ 12.1.005-76. В водоёмах (при их промышленном загрязнении) — ПДК 0,1 мг/л (100 мг/м3)[7].
В соответствии с ГОСТ 12.1.007-76 аминобензол относится ко II классу опасности[8].
Охрана труда[править | править код]
Порог восприятия запаха анилина человеком может быть, например, 0,37-2,82 мг/м3[9]; 3,8 мг/м3[10]. ПДК аминобензола в воздухе рабочей зоны[11] 0,3 мг/м3 (максимальная разовая) и 0,1 мг/м3 (средняя сменная за 8 часов). Применение широко распространённых фильтрующих СИЗОД в сочетании с «заменой фильтров по появлении запаха под маской» (как рекомендуется в РФ[12]) приведёт к запоздалой замене противогазных фильтров и чрезмерному воздействию анилина на, по крайней мере, часть работников. Для их защиты необходимо использовать значительно более эффективные изменение технологии и средства коллективной защиты.
Примечания[править | править код]
- ↑ 1 2 3 4 https://www.cdc.gov/niosh/npg/npgd0033.html
- ↑ Окисление анилина раствором хлорной извести. Единая коллекция цифровых образовательных ресурсов. Дата обращения: 14 августа 2017.
- ↑ Цветков Л.А. § 36. Амины // Органическая химия. Учебник для 10 класса. — 20-е изд. — М.: Просвещение, 1981. — С. 171—175.
- ↑ Габриелян О.С. § 16. Амины. Анилин // Химия. 10 класс. Базовый уровень : учеб. для общеобразоват. учреждений. — 4-е изд. — М.: Дрофа, 2008. — С. 116—121.
- ↑ Aniline (англ.) (недоступная ссылка). www.the-innovation-group.com (19 February 2002). — Aniline producers price capacity market demand consumption production growth uses outlook n.d., The Chemical Market Reporter, Schnell Publishing Company. Дата обращения: 14 августа 2017. Архивировано 19 февраля 2002 года.
- ↑ name=https://docs.cntd.ru_ГОСТ 313-77 Анилин технический. Технические условия (с Изменениями N 1, 2, 3)
- ↑ Анилин // Ангола — Барзас. — М. : Советская энциклопедия, 1970. — С. 32—33. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 2).
- ↑ name=https://docs.cntd.ru_ГОСТ 5819-78 Реактивы. Анилин. Технические условия (с Изменениями N 1)
- ↑ Ткачев П.Г. Материалы к гигиенической характеристике анилина как загрязнителя атмосферного воздуха / Рязанов В.А., Гольдберг М.С. (ред). — Предельно допустимые концентрации атмосферных загрязнений. — Москва: Издательство “Медицина”, 1964. — С. 41—58. — 204 с. — (Выпуск 8). — 2800 экз.
- ↑ Gregory Leonardos, David Kendall & Nancy Barnard. Odor Threshold Determinations of 53 Odorant Chemicals (англ.) // Air & Waste Management Association Journal of the Air & Waste Management Association. — Taylor & Francis, 1969. — February (vol. 19 (iss. 2). — P. 91—95. — ISSN 1096-2247. — doi:10.1080/00022470.1969.10466465.
- ↑ (Роспотребнадзор). № 54 // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» (рус.) / утверждены А.Ю. Поповой. — Москва, 2018. — С. 7. — 170 с. — (Санитарные правила).
- ↑ под ред. Сорокина Ю.Г., Преображенского В.Б. и др. 5. Сроки службы и признаки неисправности СИЗОД // Методические рекомендации по выбору и применению средств индивидуальной защиты органов дыхания (рус.). — Москва: Издательство “КОЛОС”, 2006. — С. 22—35. — 56 с. — 2000 экз. — ISBN 5-10-003932-9.
Литература[править | править код]
- Артеменко А. И. Органическая химия. — М.: «Высшая школа», 1987. — 430 с.
Ссылки[править | править код]
- Анилин // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Источник
Амины
Амины – производные аммиака, в молекуле которого один, два или все три атома водорода замещены на углеводородные радикалы.
По количеству замещенных атомов водорода амины делят на:
По характеру углеводородных заместителей амины делят на
Общие особенности строения аминов
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота. Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным (+I) эффектом. В связи с этим на атоме азота увеличивается электронная плотность, что облегчает его взаимодействие с катионом Н+.
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается. В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Вторичные предельные амины являются более сильными основаниями, чем первичные предельные, которые являются в свою очередь более сильными основаниями, чем аммиак. Что касается основных свойств третичных аминов, то то если речь идет о реакциях в водных растворах, то основные свойства третичных аминов выражены намного хуже, чем у вторичных аминов, и даже чуть хуже чем у первичных. Связано это со стерическими затруднениями, существенно влияющими на скорость протонирования амина. Другими словами три заместителя «загораживают» атом азота и мешают его взаимодействию с катионами H+.
Взаимодействие с кислотами
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином:
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой взаимодействуют также как и с другими кислотами — с образованием соответствующих солей, в данном случае, нитритов.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Взаимодействие с галогеналканами
Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
Получение аминов:
1) Алкилирование аммиака галогеналканами:
В случае недостатка аммиака вместо амина получается его соль:
2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
с последующей обработкой раствора щелочью для высвобождения свободного амина:
3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Химические свойства анилина
Анилин – тривиальное название аминобензола, имеющего формулу:
Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной.
Взаимодействие анилина с кислотами
Анилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония:
Взаимодействие анилина с галогенами
Как уже было сказано в самом начале данной главы, аминогруппа в ароматических аминах , втянута в ароматическое кольцо, что в свою очередь снижает электронную плотность на атоме азота, и как следствие увеличивает ее в ароматическом ядре. Увеличение электронной плотности в ароматическом ядре приводит к тому, что реакции электрофильного замещения, в частности, реакции с галогенами протекают значительно легче, особенно в орто- и пара- положениях относительно аминогруппы. Так, анилин с легкостью вступает во взаимодействие с бромной водой, образуя белый осадок 2,4,6-триброманилина:
Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений.
Взаимодействие анилина с азотистой кислотой
Анилин реагирует с азотистой кислотой, но в виду специфичности и сложности данной реакции в реальном ЕГЭ по химии она не встречается.
Реакции алкилирования анилина
С помощью последовательного алкилирования анилина по атому азота галогенпроизводными углеводородов можно получать вторичные и третичные амины:
Получение анилина
1. Восстановление маталлами нитробензола в присутствии сильных кислот-неокислителей:
C6H5-NO2 + 3Fe + 7HCl = [C6H5-NH3]+Cl- + 3FeCl2 + 2H2O
2. Далее полученную соль обрабатывают щелочью для высвобождения анилина:
[C6H5-NH3]+Cl— + NaOH = C6H5-NH2 + NaCl + H2O
В качестве металлов могут быть использованы любые металлы, находящиеся до водорода в ряду активности.
Реакция хлорбензола с аммиаком:
С6H5−Cl + 2NH3 → C6H5NH2 + NH4Cl
Химические свойства аминокислот
Аминокислотами называют соединения в молекулах которых присутствуют два типа функциональных групп – амино (-NH2) и карбокси- (-COOH) группы.
Другими словами, аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы.
Таким образом, общую формулу аминокислот можно записать как (NH2)xR(COOH)y, где x и y чаще всего равны единице или двум.
Поскольку в молекулах аминокислот есть и аминогруппа и карбоксильная группа, они проявляют химические свойства схожие как аминов, так и карбоновых кислот.
Кислотные свойства аминокислот
Образование солей с щелочами и карбонатами щелочных металлов
Этерификация аминокислот
Аминокислоты могут вступать в реакцию этерификации со спиртами:
NH2CH2COOH + CH3OH → NH2CH2COOCH3+ H2O
Основные свойства аминокислот
1. Образование солей при взаимодействии с кислотами
NH2CH2COOH + HCl → [NH3CH2COOH]+Cl—
2. Взаимодействие с азотистой кислотой
NH2-CH2-COOH + HNO2 → НО-CH2-COOH + N2↑ + H2O
Примечание: взаимодействие с азотистой кислотой протекает так же, как и с первичными аминами
3. Алкилирование
NH2CH2COOH + CH3I → [CH3NH2CH2COOH]+I—
4. Взаимодействие аминокислот друг с другом
Аминокислоты могут реагировать друг с другом образуя пептиды – соединения, содержащие в своих молекулах пептидную связь –C(O)-NH-
При этом, следует отметить, что в случае проведения реакции между двумя разными аминокислотами, без соблюдения некоторых специфических условий синтеза, одновременно протекает образование разных дипептидов. Так, например, вместо реакции глицина с аланином выше, приводящей к глицилананину, может произойти реакция приводящая к аланилглицину:
Кроме того, молекула глицина не обязательно реагирует с молекулой аланина. Протекают также и реакции пептизации между молекулами глицина:
И аланина:
Помимо этого, поскольку молекулы образующихся пептидов как и исходные молекулы аминокислот содержат аминогруппы и карбоксильные группы, сами пептиды могут реагировать с аминокислотами и другими пептидами, благодаря образованию новых пептидных связей.
Отдельные аминокислоты используются для производства синтетических полипептидов или так называемых полиамидных волокон. Так, в частности с помощью поликонденсации 6-аминогексановой (ε-аминокапроновой) кислоты в промышленности синтезируют капрон:
Получаемая в результате этой реакции капроновая смола используется для производства текстильных волокон и пластмасс.
Образование внутренних солей аминокислот в водном растворе
В водных растворах аминокислоты существуют преимущественно в виде внутренних солей — биполярных ионов (цвиттер-ионов):
Получение аминокислот
1) Реакция хлорпроизводных карбоновых кислот с аммиаком:
Cl-CH2-COOH + 2NH3 = NH2-CH2-COOH + NH4Cl
2) Расщепление (гидролиз) белков под действием растворов сильных минеральных кислот и щелочей.
Источник
