Какие свойства проявляет аммиак в реакциях
Аммиак – NH3

Аммиак
(в европейских языках его название звучит как «аммониак») своим
названием обязан оазису Аммона в Северной Африке, расположенному на
перекрестке караванных путей. В жарком климате мочевина (NH2)2CO,
содержащаяся в продуктах жизнедеятельности животных, разлагается
особенно быстро. Одним из продуктов разложения и является аммиак. По
другим сведениям, аммиак получил своё название от древнеегипетского
слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
1. Строение молекулы


Молекула аммиака имеет форму тригональной пирамиды с
атомом азота в вершине. Три неспаренных
p-электрона атома азота участвуют в образовании полярных ковалентных
связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара
внешних электронов является неподелённой, она может образовать
донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.
Вид химической связи: ковалентная полярная, три одинарные σ – сигма связи N-H
2. Физические свойства аммиака
При нормальных условиях
— бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти
вдвое легче воздуха, ядовит. По
физиологическому действию на организм относится к группе веществ удушающего и
нейротропного действия, способных при ингаляционном поражении вызвать
токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают
слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и
воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение,
боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы
кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно
велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме
воды.
3. Получение аммиака
В лаборатории | В |
Для получения аммиака в лаборатории NH4Cl (NH4)2SO4 Внимание! Гидроксид аммония неустойчивое основание, При получении аммиака держите пробирку – приёмник дном кверху, так как аммиак легче воздуха: | Промышленный способ получения аммиака N2(г) + 3H2(г) ↔ 2NH3(г) Условия: катализатор температура давление Это так называемый процесс Габера (немецкий |
4. Химические свойства аммиака
Для аммиака характерны реакции:
- с
изменением степени окисления атома азота (реакции окисления) - без
изменения степени окисления атома азота (присоединение)
Реакции N-3 → N0 → N+2 NH3 – сильный |
с кислородом 1. Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H20 2. Каталитическое окисление амииака (катализатор Pt – Rh, температура) 4NH3 + 5O2 → 4NO + 6H2O Видео – Эксперимент ” Окисление аммиака в |
с оксидами металлов 2 NH3 |
с сильными окислителями 2NH3 + 3Cl2 = N2 + 6HCl |
аммиак – непрочное соединение, при 2NH3↔ N2 + 3H2 |
5. Применение аммиака
По объемам производства
аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100
миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде
водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду
применяют также непосредственно в виде удобрения, а иногда поля поливают из
цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого
хладагента в промышленных холодильных установках.
Аммиак используется
также для получения синтетических
волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка,
шерсти и шелка. В нефтехимической промышленности аммиак используют для
нейтрализации кислотных отходов, а в производстве природного каучука аммиак
помогает сохранить латекс в процессе его перевозки от плантации до завода.
Аммиак используется также при производстве соды по методу Сольве. В
сталелитейной промышленности аммиак используют для азотирования – насыщения
поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики
используют водные растворы аммиака (нашатырный спирт)
в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека
из обморочного состояния. Для человека аммиак в такой дозе не опасен.
ТРЕНАЖЁРЫ
Тренажёр №1 “Горение аммиака”
Тренажёр №2 “Химические свойства аммиака”
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
Источник
Нитрид водорода с формулой NH3 называется аммиаком. Это лёгкий (легче воздуха) газ с резким запахом. Строение молекулы определяет физические и химические свойства аммиака.

Строение
Молекула аммиака состоит из одного атома азота и трёх атомов водорода. Связи между атомами водорода и азота ковалентные. Молекула аммиака имеет форму тригональной пирамиды.
На 2р-орбитали азота находится три свободных электрона. С ними вступают в гибридизацию три атома водорода, образуя тип гибридизации sp3.
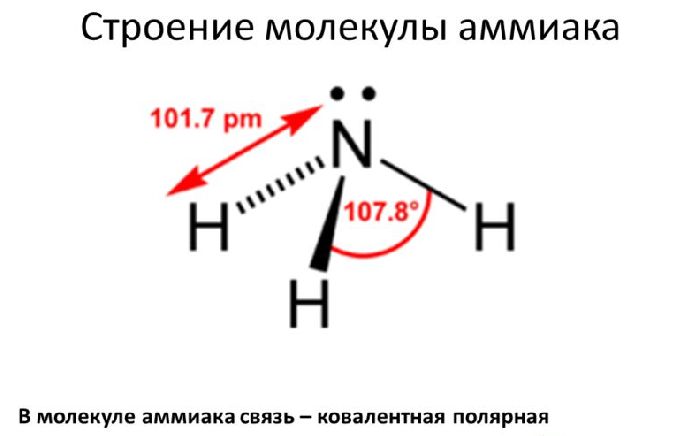
Рис. 1. Строение молекулы аммиака.
Если один атом водорода заменить углеводородным радикалом (CnHm), получится новое органическое вещество – амин. Замещаться может не только один атом водорода, но и все три. В зависимости от количества замещённых атомов различают три вида аминов:
- первичные (метиламин – CH3NH2);
- вторичные (диметиламин – СН3-NH-СН3);
- третичные (триметиламин – СН3-N-(СН3)2).
К молекуле аммиака могут присоединиться С2Н4, С6Н4, (С2Н4)2 и другие вещества, содержащие несколько атомов углерода и водорода.

Рис. 2. Образование аминов.
У аммиака и аминов остаётся свободной пара электронов азота, поэтому свойства двух веществ схожи.
Физические
Основные физические свойства аммиака:
- бесцветный газ;
- резкий запах;
- хорошая растворимость в воде (на один объём воды 700 объёмов аммиака при 20°С, при 0°С – 1200);
- легче воздуха.
Аммиак сжижается при температуре -33°С и становится твёрдым при -78°С. Концентрированный раствор содержит 25 % аммиака и имеет плотность 0,91 г/см3. Жидкий аммиак растворяет неорганические и органические вещества, но не проводит электрический ток.
В природе аммиак выделяется при гниении и разложении органических веществ, содержащих азот (белки, мочевина).
Химические
Степень окисления азота в составе аммиака – -3, водорода – +1. При образовании аммиака водород окисляет азот, отнимая у него три электрона. За счёт оставшейся пары электронов азота и лёгкого отделения атомов водорода аммиак является активным соединением, вступающим в реакции с простыми и сложными веществами.
Основные химические свойства описаны в таблице.
Взаимодействие | Продукты реакции | Уравнение |
С кислородом | Горит с образованием азота или взаимодействует с кислородом в присутствии катализатора (платины), образуя оксид азота | – 4NH3 +3O2 → 2N2 + 6H2O; – 4NH3 + 5O2 → 4NO + 6H2O |
С галогенами | Азот, кислота | 2NH3 + 3Br2 → N2 + 6HBr |
С водой | Гидроксид аммония или нашатырный спирт | NH3 + H2O → NH4OH |
С кислотами | Соли аммония | – NH3 + HCl → NH4Cl; – 2NH3 + H2SO4 → (NH4)2SO4 |
С солями | Замещает металл, образуя новую соль | 2NH3 + CuSO4 → (NH4)2SO4 + Cu |
С оксидами металлов | Восстанавливает металл, образуется азот | 2NH3 + 3CuO → 3Cu + N2 + 3H2O |

Рис. 3. Горение аммиака.
Что мы узнали?
Выяснили, какими свойствами обладает аммиак. Аммиак – бесцветный лёгкий газ с резким запахом. Сжижается при низкой температуре. Раствор аммиака – хороший растворитель. Способен отдавать атомы водорода, присоединяя углеводородный радикал и образуя амины. Аммиак за счёт оставшейся электронной пары азота реагирует с простыми и сложными веществами – галогенами, кислородом, водой, кислотами, солями, оксидами.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-

Костя Антонюк
4/5

Александр Котков
5/5
Оценка доклада
Средняя оценка: 4.3. Всего получено оценок: 290.
Источник
Анонимный вопрос
15 марта 2019 · 13,9 K
Имею естественно научное образование, в юношестве прикипел к литературе, сейчас…
Физические свойства NH3:
- Бесцветный газ
- Резких спиртовой запах
- Растворим в воде
- Легче воздуха
- Плотность концентрированного раствора аммиака 0,91 г/см3
Химические свойства NH3:
- Активен
- Вступает в реакции взаимодействия с разными веществами
- Проявляет восстановительные свойства
- Степень окисления азота в аммиаке «-3»
- В присутствии катализатора окисляется до азота 3
- При нагревании аммиака с галогенами, оксидами тяжелых металлов и кислородом получает азот
- Не имеет кислотных свойств
- Имеет неподеленную пару электронов
- При взаимодействии с кислотами образует соли аммония
А учебник Химия 9 класс уже не катит? У аммиака оснОвные свойства… Уравнения характерных реакций запоминают и… Читать дальше
Нитрид водорода с формулой NH3 называется аммиаком. Это лёгкий (легче воздуха) газ с резким запахом. Строение молекулы определяет физические и химические свойства аммиака. Если один атом водорода заменить углеводородным радикалом (CnHm), получится новое органическое вещество – амин. Замещаться может не только один атом водорода, но и все три. В… Читать далее
Что реагирует с раствором гидроксида калия?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????химические свойства щелочей????
❗️С кислотами
KOH+HCl➡KCl+H2O
❗️С кислотными оксидами
2KOH+CO2➡️K2CO3+H2O
❗️С растворами солей(если есть осадок)
2KOH+CuSO4➡️Cu(OH)2+K2SO4
❗️С амфотерными металлами
2KOH+Zn+2H2O➡️K2[Zn(OH)4]+H2
С чем взаимодействуют кислоты?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
???? Растворы кислот кислые на вкус, изменяют окраску индикаторов:
???? лакмуса в красный цвет
????метилового оранжевого – в розовый
цвет фенолфталеина не изменяется
ХИМИЧЕСКИЕ СВОЙСТВА
???? Взаимодействуют с металлами
▫️Ca + 2HCl = CaCl2 + H2
⚠️ Металл должен стоять левее водорода в ряду напряжений
⚠️ Кислоты-окислители – азотная и серная конц., реагируют с металлами по-другому
????Реагируют с основными оксидами:
▫️CaO + 2HCl = CaCl2 + H2O
????С основаниями (реакция нейтрализации):
▫️H2SO4 + 2KOH = K2SO4 + 2H2O
????С солями (не обязательно растворимыми в воде):
▫️Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
⚠️ Реакция пойдёт только при условии выделения газа или выпадения осадка
???? У кислот есть и специфические свойства, которые связаны с окислительно-восстановительными реакциями
Прочитать ещё 1 ответ
Как отличить этиловый спирт от метилового в домашних условиях?
Главный редактор издания «Популярный университет», химик по образованию, продвигаю массы… · popuni.ru
Можно воспользоваться очень надежным старым методом всех химиков: нагреть жидкость и посмотреть, при какой температуре она будет кипеть. Для метилового спирта это почти 65 градусов, для этилового — 78. Разница достаточная, чтобы ее заметить. Другое дело, что без хорошей химической посуды и вытяжки этого лучше не делать, так как даже пары метанола токсичны (в 200 раз токсичнее паров этанола).
Есть еще один, более химический способ (хотя если у вас завалялся медный купорос на кухне, вы тоже можете его использовать). Надо добавить немного медного купороса CuSO4 к каждому из веществ. Тот, в котором кристаллы растворятся и дадут синий раствор – метанол.
Прочитать ещё 3 ответа
Сколько неметаллов в периодической системе менделеева?
Водород, гелий, бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, германий, мышьяк, селен, бром, криптон, йод, ксенон, астат, радон – всего 22 элемента.
С чем аммиак не вступает во взаимодействие?
Мои интересы: разнообразны, но можно выделить следующие: литература, история…
Аммиак не вступает во взаимодействие с водородм, мотому что аммиак, он же NH3, и так является производным водорода, и повторно с ним в реакцию при нормальных условиях не вступит.
Источник
Химические свойства аммиака
1. Реакции с металлами.
Будет ли аммиак реагировать с металлами? У
атома азота в этом соединении формально восемь
внешних электронов (пять своих и три оттянуты от
атомов водорода), а металлы стремятся свои
валентные электроны отдать. С одной стороны,
атому азота уже некуда их принять. С другой – в
аммиаке есть атомы водорода, частично обедненные
электронами, т. е. имеющие возможность принять их.
Известно, что активные металлы вытесняют
водород из воды, а чем аммиак хуже? Ну только
разве тем, что аммиак газообразен при
температурах выше его точки кипения, равной
–33,4 °С. Соответственно газ NH3
рассредоточен в пространстве, и требуется
дополнительный подогрев, чтобы реакция пошла.
Именно накаливанием металлов в атмосфере
аммиака чаще всего и получают нитриды. (Нитриды –
это соединения, состоящие из двух элементов, один
из которых азот, причем атомы азота имеют в этом
соединении отрицательный заряд.) Например:
2. Реакции с неметаллами.
Формальная степень окисления азота в аммиаке
–3. Следовательно, аммиак может реагировать с
кислородом (и другими окислителями!), увеличивая
при этом степень окисления азота, т. е. отдавая
электроны. Однако на пути к положительным
степеням окисления находится нулевая – простое
вещество азот, как мы уже выяснили, необычайно
устойчиво.
Можно предположить, что при реакции аммиака с
кислородом будут образовываться азот и вода.
Именно так и происходит в действительности.
Следует добавить, что аммиак горит только в
чистом кислороде, а не на воздухе:
4NH3 + 3O2 = 6H2O + 2N2.
Как быть, если надо получить из аммиака оксиды
азота? Вспомним о катализаторах – веществах,
которые ускоряют реакцию или меняют ее
направление. Катализаторы используют и при
получении оксидов азота из аммиака и кислорода.
Реакцию каталитического окисления проводят на
металлической платине:
Интересна реакция аммиака с другим простым
веществом – озоном, более агрессивным
окислителем, чем кислород. Озон переводит азот из
степени окисления –3 в степень окисления +5. Но не
весь! В результате получается нитрат аммония:
6NН3 + 4O3 = 3NН4NO3
+ 3Н2O.
3. Реакция с водой.
Мы уже говорили о хорошей растворимости
аммиака в воде. Но почему фенолфталеин
становится в таком растворе малиновым? Загадка?
Попробуем разобраться, откуда появилась в
растворе щелочная среда. Для начала вспомним
теорию электролитической диссоциации. В водных
растворах все ионы и молекулы гидратированы –
окружены «шубой» из молекул воды,
сориентированных соответствующим образом: к
атомам водорода потянулись «кислородные
половинки», а к атому азота – «водородная
половинка» (рис. 5).
Рис. 5. Аммиак в воде:
атом азота – черный шар; атомы кислорода –
большие белые шары; атомы водорода – малые белые
шары
В какой-то момент образовалась конструкция Н3N•••НОН.
Далее, известно, что вода слабо, но диссоциирует
по реакции:
Поскольку электроотрицательность кислорода
больше, чем азота, связь кислорода с водородом
полярнее, чем связь азота с водородом. Можно
предположить, что равновесие в реакции
диссоциации гидратированной молекулы аммиака
будет больше смещено в сторону образования ионов
(по сравнению с водой):
В растворе появляется весьма ощутимый избыток
ионов ОН–, и фенолфталеин сигнализирует об
этом малиновой окраской. Стоит подчеркнуть, что
все эти реакции обратимые. Поэтому вместе со
щелочной реакцией среды (правая часть уравнения)
растворы аммиака обладают еще и характерным
запахом аммиака, выделяющегося из раствора
(левая часть уравнения), и заметным количеством
нестойкого гидратированного молекулярного
аммиака (это подтверждается, например, реакциями
образования аммиачных комплексов с ионами
металлов).
4. Реакции с кислотами.
Как слабое, но все же основание, водный раствор
аммиака реагирует с кислотами с образованием
соли и воды:
Соли аммония, подобно солям натрия и калия,
хорошо растворяются в воде, но при этом частично
гидролизуются:
С кислотами реагирует и газообразный аммиак,
причем не только с растворами, но и с
газообразными кислотами. В лабораториях, в
которых работают с растворами соляной кислоты и
аммиака, постоянно появляется белый налет на
окружающих предметах. Даже небольших количеств
аммиака и хлороводорода в воздухе достаточно для
протекания реакции:
5. Реакции со щелочами.
Газообразный аммиак со щелочами не реагирует. А
вот водный раствор аммиака «откликается» на
добавление щелочи. Поскольку при растворении
аммиака в воде протекает обратимая реакция
образования иона аммония и гидроксид-иона, то
добавление последнего в раствор смещает
равновесие, растворимость аммиака уменьшается (а
интенсивность запаха соответственно
увеличивается):
NН4OH + NaOH = NH3
+ H2O + NaOH.
Физические свойства аммиака в цифрах
Молярная масса M(NH3) = 17 г/моль. Температура
плавления равна –78 °C, температура кипения
–33 °С. Плотность газообразного аммиака при
нормальных условиях (0 °С, 1 атм) 0,771 г/л (аммиак
легче воздуха почти в два раза). Растворимость
при атмосферном давлении и 0 °С около 90 л (!)
газа в 100 г воды, при 20 °С – 65 л в 100 г воды.
При сравнении физических свойств аммиака и
азота в первую очередь обращает на себя внимание
температура кипения. Почему у аммиака она
настолько выше? У азота – почти –200 °С, а у
аммиака – только –33 °С. Загадка? Попробуем
отгадать.
Для начала сопоставим температуры кипения
соединений с водородом элементов V, VI и VII групп
главных подгрупп периодической системы (рис. 6).
Рис. 6. Графики зависимости температур кипения
водородных соединений элементов V(·),
VI(C)и VII(Д)
групп
главных подгрупп от номера периода (массы атома)
Если экстраполировать графики такой
зависимости, можно оценить, какими должны бы быть
эти температуры, исходя из общей закономерности.
Из графика видно, что аммиак, вода и фтороводород
имеют аномально высокие температуры кипения:
аммиак – примерно на 50 °С выше
«теоретической», фтороводород – на 100 °С, а
вода – на 160 °С. Во-первых, видно, что аммиак не
одинок, а во-вторых, вспоминается, что у азота,
кислорода и фтора самая высокая
электроотрицательность. Значит, и связи этих
элементов с водородом самые полярные. Водород в
таких соединениях почти без электрона и поэтому
сильно притягивается к неподеленным парам
электронов, которые есть и у азота, и у кислорода,
и у фтора. Образуются водородные связи. Они,
конечно, слабее обычных ковалентных связей, но их
много. И это «много» многое значит.
Водородные связи играют в природе огромную
роль. Например, спираль из двух молекул ДНК
образуется только за счет водородных связей.
Такие связи сравнительно легко разрываются,
когда происходит считывание информации с
определенного участка ДНК. Когда водородных
связей много, получается крепкое связывание в
целом.
В заключение стоит сказать, что связь водорода
с фтором полярнее, чем связь азота с водородом, и
соответственно притяжение сильнее, а
температура кипения HF выше, чем NH3. У воды же
самая высокая температура кипения из этой
троицы, потому что молекулы воды образуют
водородные связи сразу «двумя руками» – две
неподеленные пары электронов и два атома
водорода в каждой молекуле! Аммиак и
фтороводород по своему строению «однорукие».
Химические свойства аммиака
(дополнение)
Аммиак сам по себе устойчив и разлагается
только при очень высоких температурах. Но если
проводить нагревание в присутствии
обыкновенного железа, он разлагается на азот и
водород при значительно более низких
температурах. Интересно, что при каталитическом
разложении небольшая часть аммиака всегда
остается в смеси газов, независимо от времени и
температуры проведения реакции. Именно этот факт
подсказал ученым мысль о возможности связывания
атмосферного азота через аммиак. Действительно,
логично предположить, что разложение аммиака –
процесс обратимый, тогда изменением условий и
подбором катализатора можно сместить процесс в
сторону образования аммиака до такой степени,
что это станет выгодно для его промышленного
получения.
Еще немного о реакциях аммиака с простыми
веществами. Интересны реакции аммиака с
галогенами. Йод не может изменить степень
окисления азота! Он просто сам
диспропорционирует:
Нитрид йода (по названию понятно, что у йода в
этом соединении степень окисления
положительная), или иначе йодистый азот, в сухом
виде разлагается со взрывом даже от простого
сотрясения.
Бром и хлор могут отнять у азота только по три
электрона, переведя в простое вещество. И только
фтору под силу перевалить через эту
сверхустойчивую нулевую степень окисления
азота. Получается трифторид. И это максимально
возможный, просто потому, что у атомов второго
периода нет «запасных» орбиталей. Не бывает
поэтому и пятивалентного азота!
Жидкий аммиак – хороший растворитель. Реакции
в жидком аммиаке идут по тем же законам, что и в
воде, а вот растворимость в воде и в жидком
аммиаке у соединений различная. Например,
реакция
2АgNО3 + ВаBr2 = 2АgВr + Ва(NO3)2
в воде идет в сторону образования
нерастворимого бромида серебра, а в жидком
аммиаке – в сторону образования нерастворимого
бромида бария.
Из жидкого аммиака, как и из воды, активные
металлы вытесняют водород. Например, реакция с
цезием протекает за несколько минут:
А вот аналогичная реакция с натрием протекает
значительно дольше. При этом образуется
сольватированный электрон! (Сольватация –
процесс, аналогичный гидратации, только в других
растворителях.)
Экологические свойства аммиака
Аммиак – активное и «едкое» соединение
(едкость кислот и щелочей проявляется в том, что
большие количества ионов Н+ или ОН–
разъедают живую ткань растений, животных и,
естественно, человека; впрочем, неживую «ткань»
они тоже разъедают). Однако если заменить в
аммиаке один, два или все три атома водорода на
органические радикалы, то «едкость» существенно
снижается, а основные свойства остаются. Такие
соединения выполняют в живой природе функции
оснований.
Животные и человек используют уже
приготовленные растениями азотсодержащие
органические соединения, поэтому для нас с вами
аммиак, безусловно, яд. При попадании на кожу
концентрированный раствор аммиака вызывает
химические ожоги, при вдыхании большого
количества аммиака может наступить отек легких
– реакция организма на вдыхание почти всех едких
веществ.
Однако, как и многие другие яды, в малых дозах
аммиак оказывает положительное влияние на
организм: 10%-й раствор аммиака в воде используют в
медицине для стимуляции дыхания (его не пьют,
конечно, а просто дают понюхать), центральной
нервной системы и т. п.
В больших количествах аммиак вреден и для
растений. Но в небольших количествах он им
необходим. Ведь без азота, и в частности без
аммиака, не построить те органические
соединения, которые потом превращаются в
растительные белки, а в дальнейшем – в белки
животных. Большим количествам газообразного
аммиака растения противостоят по-разному.
Некоторые стараются прекратить ему доступ
внутрь (например, закрывают устьица на листьях).
Другие растения перерабатывают аммиак с помощью
соответствующих ферментов в нитрат-ионы, которые
для растений не ядовиты, тем самым запасая ценный
для своего развития элемент.
О.Р. Валединская
(МГУ, Москва)
Источник
