Какие свойства проявляет аммиак и его соединения

Аммиак – NH3

Аммиак
(в европейских языках его название звучит как «аммониак») своим
названием обязан оазису Аммона в Северной Африке, расположенному на
перекрестке караванных путей. В жарком климате мочевина (NH2)2CO,
содержащаяся в продуктах жизнедеятельности животных, разлагается
особенно быстро. Одним из продуктов разложения и является аммиак. По
другим сведениям, аммиак получил своё название от древнеегипетского
слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
1. Строение молекулы


Молекула аммиака имеет форму тригональной пирамиды с
атомом азота в вершине. Три неспаренных
p-электрона атома азота участвуют в образовании полярных ковалентных
связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара
внешних электронов является неподелённой, она может образовать
донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.
Вид химической связи: ковалентная полярная, три одинарные σ – сигма связи N-H
2. Физические свойства аммиака
При нормальных условиях
— бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти
вдвое легче воздуха, ядовит. По
физиологическому действию на организм относится к группе веществ удушающего и
нейротропного действия, способных при ингаляционном поражении вызвать
токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают
слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и
воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение,
боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы
кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно
велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме
воды.
3. Получение аммиака
В лаборатории | В |
Для получения аммиака в лаборатории NH4Cl (NH4)2SO4 Внимание! Гидроксид аммония неустойчивое основание, При получении аммиака держите пробирку – приёмник дном кверху, так как аммиак легче воздуха: | Промышленный способ получения аммиака N2(г) + 3H2(г) ↔ 2NH3(г) Условия: катализатор температура давление Это так называемый процесс Габера (немецкий |
4. Химические свойства аммиака
Для аммиака характерны реакции:
- с
изменением степени окисления атома азота (реакции окисления) - без
изменения степени окисления атома азота (присоединение)
Реакции N-3 → N0 → N+2 NH3 – сильный |
с кислородом 1. Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H20 2. Каталитическое окисление амииака (катализатор Pt – Rh, температура) 4NH3 + 5O2 → 4NO + 6H2O Видео – Эксперимент ” Окисление аммиака в |
с оксидами металлов 2 NH3 |
с сильными окислителями 2NH3 + 3Cl2 = N2 + 6HCl |
аммиак – непрочное соединение, при 2NH3↔ N2 + 3H2 |
5. Применение аммиака
По объемам производства
аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100
миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде
водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду
применяют также непосредственно в виде удобрения, а иногда поля поливают из
цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого
хладагента в промышленных холодильных установках.
Аммиак используется
также для получения синтетических
волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка,
шерсти и шелка. В нефтехимической промышленности аммиак используют для
нейтрализации кислотных отходов, а в производстве природного каучука аммиак
помогает сохранить латекс в процессе его перевозки от плантации до завода.
Аммиак используется также при производстве соды по методу Сольве. В
сталелитейной промышленности аммиак используют для азотирования – насыщения
поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики
используют водные растворы аммиака (нашатырный спирт)
в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека
из обморочного состояния. Для человека аммиак в такой дозе не опасен.
ТРЕНАЖЁРЫ
Тренажёр №1 “Горение аммиака”
Тренажёр №2 “Химические свойства аммиака”
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
Источник
Нитрид водорода с формулой NH3 называется аммиаком. Это лёгкий (легче воздуха) газ с резким запахом. Строение молекулы определяет физические и химические свойства аммиака.

Строение
Молекула аммиака состоит из одного атома азота и трёх атомов водорода. Связи между атомами водорода и азота ковалентные. Молекула аммиака имеет форму тригональной пирамиды.
На 2р-орбитали азота находится три свободных электрона. С ними вступают в гибридизацию три атома водорода, образуя тип гибридизации sp3.
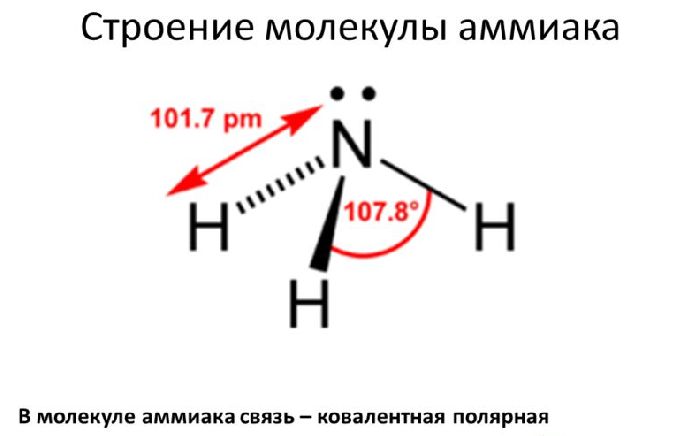
Рис. 1. Строение молекулы аммиака.
Если один атом водорода заменить углеводородным радикалом (CnHm), получится новое органическое вещество – амин. Замещаться может не только один атом водорода, но и все три. В зависимости от количества замещённых атомов различают три вида аминов:
- первичные (метиламин – CH3NH2);
- вторичные (диметиламин – СН3-NH-СН3);
- третичные (триметиламин – СН3-N-(СН3)2).
К молекуле аммиака могут присоединиться С2Н4, С6Н4, (С2Н4)2 и другие вещества, содержащие несколько атомов углерода и водорода.

Рис. 2. Образование аминов.
У аммиака и аминов остаётся свободной пара электронов азота, поэтому свойства двух веществ схожи.
Физические
Основные физические свойства аммиака:
- бесцветный газ;
- резкий запах;
- хорошая растворимость в воде (на один объём воды 700 объёмов аммиака при 20°С, при 0°С – 1200);
- легче воздуха.
Аммиак сжижается при температуре -33°С и становится твёрдым при -78°С. Концентрированный раствор содержит 25 % аммиака и имеет плотность 0,91 г/см3. Жидкий аммиак растворяет неорганические и органические вещества, но не проводит электрический ток.
В природе аммиак выделяется при гниении и разложении органических веществ, содержащих азот (белки, мочевина).
Химические
Степень окисления азота в составе аммиака – -3, водорода – +1. При образовании аммиака водород окисляет азот, отнимая у него три электрона. За счёт оставшейся пары электронов азота и лёгкого отделения атомов водорода аммиак является активным соединением, вступающим в реакции с простыми и сложными веществами.
Основные химические свойства описаны в таблице.
Взаимодействие | Продукты реакции | Уравнение |
С кислородом | Горит с образованием азота или взаимодействует с кислородом в присутствии катализатора (платины), образуя оксид азота | – 4NH3 +3O2 → 2N2 + 6H2O; – 4NH3 + 5O2 → 4NO + 6H2O |
С галогенами | Азот, кислота | 2NH3 + 3Br2 → N2 + 6HBr |
С водой | Гидроксид аммония или нашатырный спирт | NH3 + H2O → NH4OH |
С кислотами | Соли аммония | – NH3 + HCl → NH4Cl; – 2NH3 + H2SO4 → (NH4)2SO4 |
С солями | Замещает металл, образуя новую соль | 2NH3 + CuSO4 → (NH4)2SO4 + Cu |
С оксидами металлов | Восстанавливает металл, образуется азот | 2NH3 + 3CuO → 3Cu + N2 + 3H2O |

Рис. 3. Горение аммиака.
Что мы узнали?
Выяснили, какими свойствами обладает аммиак. Аммиак – бесцветный лёгкий газ с резким запахом. Сжижается при низкой температуре. Раствор аммиака – хороший растворитель. Способен отдавать атомы водорода, присоединяя углеводородный радикал и образуя амины. Аммиак за счёт оставшейся электронной пары азота реагирует с простыми и сложными веществами – галогенами, кислородом, водой, кислотами, солями, оксидами.
Тест по теме
Оценка доклада
Средняя оценка: 4.3. Всего получено оценок: 293.
Источник
Урок посвящен изучению темы «Аммиак». Вы узнаете о свойствах соединений азота, в которых он проявляет степень окисления -3, в какие химические реакции и при каких условиях вступает аммиак.
Аммиак был впервые выделен в чистом виде Дж. Пристли в 1774 году, который назвал его «щелочной воздух» (англ. alkaline air). Через одиннадцать лет, в 1785 году К. Бертолле установил точный химический состав аммиака. С того времени в мире начались исследования по получению аммиака из азота и водорода.
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
I. Строение молекулы аммиака
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.
Вид химической связи: ковалентная полярная, три одинарные σ – сигма связи N-H.
II. Физические свойства аммиака
При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
III. Получение аммиака
В лаборатории | В промышленности |
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: NH4Cl + NaOH = NH3↑ + NaCl + H2O (NH4)2SO4 + Ca(OH)2 = 2NH3↑ + CaSO4+ 2H2O Внимание! Гидроксид аммония неустойчивое основание, разлагается: NH4OH ↔ NH3↑ + H2O При получении аммиака держите пробирку – приёмник дном кверху, так как аммиак легче воздуха: | Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж Условия:
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода) |
IV. Химические свойства аммиака
Для аммиака характерны реакции:
- C изменением степени окисления атома азота (реакции окисления)
- Без изменения степени окисления атома азота (присоединение)
1. Реакции с изменением степени окисления атома азота (реакции окисления)
N-3 → N0 → N+2
NH3 – сильный восстановитель
- Взаимодействие с кислородом
1.Горение
Опыт: “Горение аммиака”(при нагревании)
4NH3 + 3O2 → 2N2 + 6H20
2. Каталитическое окисление амииака (катализатор Pt – Rh, температура)
4NH3 + 5O2 → 4NO + 6H2O
Видео – эксперимент: “Окисление аммиака в присутствии оксида хрома”
- Взаимодействие с оксидами металлов
2NH3 + 3CuO = 3Cu + N2 + 3H2O
- Взаимодействие с сильными окислителями
2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
- Аммиак – непрочное соединение, при нагревании разлагается
2NH3↔ N2 + 3H2
2. Реакции без изменения степени окисления атома азота (присоединение –Образование иона аммония NH4+ по донорно-акцепторному механизму)
Видео – эксперимент: “Растворение аммиака в воде”
V. Применение аммиака
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3. Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка. В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды по методу Сольве. В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
VI. Соли аммония
1. Составление формул солей аммония
Соли аммония – это сложные вещества, в состав которых входят ионы аммония NH4+, соединённые с кислотными остатками.
Например,
NH4Cl – хлорид аммония
(NH4)2SO4 – сульфат аммония
NH4NO3 – нитрат аммония
(NH4)3PO4 – ортофосфат аммония
(NH4)2HPO4 – гидроортофосфат аммония
NH4H2PO4 – дигидроортофосфат аммония
2. Физические свойства
Кристаллические вещества, хорошо растворимые в воде.
3. Получение
1 способ: Аммиак + кислота: NH3 + HNO3 → NH4NO3
2 способ: Аммиачная вода + кислота: 2NH4OH + H2SO4 → (NH4)2SO4+ 2Н2O
4. Химические свойства
Общие свойства
1. Сильные электролиты (диссоциируют в водных растворах полностью)
NH4Cl → NH4+ + Cl-
2. Взаимодействие с кислотами (реакция обмена)
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
2NH4+ + CO32- + 2H+ + 2Cl- → 2NH4+ + 2Cl- + Н2O + CO2
CO32- + 2H+ → Н2O + CO2
Взаимодействие с солями (реакция обмена)
(NH4)2SO4 + Ba(NO3)2 → BaSO4↓ + 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3- → BaSO4↓ + 2NH4+ + 2NO3-
Ba2+ + SO42- → BaSO4↓
Спецефические свойства
1. Разложение при нагревании
a) если кислота летучая: NH4Cl → NH3 + HCl (при нагревании)
NH4HCO3 → NH3 + Н2O + CO2
б) если анион проявляет окислительные свойства: NH4NO3 → N2O + 2Н2O (при нагревании)
(NH4)2Cr2O7 → N2 + Cr2O3 + 4Н2O (при нагревании)
2. Качественная реакция на NH4+ – ион аммония
При нагревании со щелочами выделяется газ аммиак
NH4Cl + NaOH → NaCl + NH3 + Н2O (при нагревании)
3. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4Cl + Н2O → NH4OH + HCl
NH4+ + Н2O → NH4OH + H+
5. Применение
- Нитрат аммония (аммиачная селитра) NH4NO3 применяют как азотное удобрение и для изготовления взрывчатых веществ — аммонитов;
- Сульфат аммония (NH4)2SO4 — как дешёвое азотное удобрение;
- Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 — в пищевой промышленности при производстве мучных кондитерских изделий в качестве химического разрыхлителя, при крашении тканей, в производстве витаминов, в медицине;
- Хлорид аммония NH4Cl — в гальванических элементах (сухих батареях), при пайке и лужении, в текстильной промышленности, как удобрение, в ветеринарии.
VII. Закрепление
Задание №1. Заполните таблицу – запишите молекулярные, полные и краткие ионные уравнения для следующих солей аммония:
Соли | Химические свойства, общие с другими солями (1 – 3) | Специфические свойства (1 – 2) |
1. Хлорид аммония | ||
2. Карбонат аммония | ||
3. Сульфид аммония | ||
4. Сульфат аммония | ||
5. Нитрат аммония |
Задание №2.
Ответьте на вопрос: Гидрокарбонат аммония иногда применяют при выпечке кондитерских изделий. Какие свойства гидрокарбоната при этом используют? Ответ подтвердите уравнениями реакций.
Задание №3. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
Задание №4. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
VIII. Тренажеры
Тренажёр №1: “Горение аммиака”
Тренажёр №2:“Химические свойства аммиака”
ЦОРы
Опыт: “Получение аммиака”
Опыт: “Горение аммиака”
Видео – Эксперимент: “Окисление аммиака в присутствии оксида хрома”
Анимация: “Донорно-акцепторнорный механизм”
Видео – Эксперимент: “Качественная реакция на аммиак”
Видео – Эксперимент: “Взаимодействие аммиака с хлороводородом (дым без огня)”
Видео – Эксперимент: “Взаимодействие аммиака с концентрированными кислотами”
Видео – Эксперимент: “Фонтан”
Видео – Эксперимент: “Растворение аммиака в воде”
Опыт: “Разложение карбоната аммония”
Опыт: “Качественная реакция на ион аммония”
Опыт:“Разложение дихромата аммония”
Источник
Продажа
Производство
Доставка
Газообразный
Жидкий
Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуяион аммония NH4+. Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также более низкую плотность, вязкость (вязкость жидкого аммиака в 7 раз меньше вязкости воды), проводимость и диэлектрическую проницаемость. Это в некоторой степени объясняется тем, что прочность этих связей в жидком аммиаке существенно ниже, чем у воды, а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами. Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м³, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак практически не проводит электрический ток. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый аммиак — бесцветные кубические кристаллы.
Химические свойства
- Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как нуклеофил или комплексообразователь. Так, он присоединяет протон, образуя ион аммония:
NH3 + H+ → NH4+
- Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
NH3 + H2O → NH4+ + OH−; Ko=1,8×10−5
- Взаимодействуя с кислотами даёт соответствующие соли аммония:
NH3 + HNO3 → NH4NO3
- Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды. Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
2NH3 + 2К = 2KNH2 + Н2
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы ОН− и NH2−, а также молекулы Н2O и NH3 изоэлектронны. Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:
NaNH2 + H2O → NaOH + NH3CaNH + 2H2O → Ca(OH)2 + NH3↑Zn3N2 + 6H2O → 3Zn(OH)2 + 2NH3↑
и в спиртах:
KNH2 + C2H5OH → C2H5OK + NH3
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
MNH2 → M+ + NH2−
Фенолфталеин в этих растворах окрашивается в красный цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
- При нагревании аммиак проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
4NH3 + 3O2 → 2N2 + 6H204NH3 + 5O2 → 4NO + 6H2O
На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:
3CuO + 2NH4Cl → 3Cu + 3H2O +2HCl + N2
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
2NH3 + NaClO → N2H4 + NaCl + H2O
- Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
- С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
NH3 + CH3Cl → CH3NH3Cl (гидрохлорид метиламмония)
- С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов(восстановительное аминирование).
- При 1000 °C аммиак реагирует с углём, образуя HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
CH4 + NH3 + 1,5O2 → HCN + 3H2O
История названия
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского словаамониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы, в чём проявлется его сходство с водой:
2NH3 → NH4+ + NH2−
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)².
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов. В жидком аммиаке NH3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например Na4Pb9.
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)6] обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH3.
Растворенный в NH3 металл постепенно реагирует с образованием амида:
2Na + 2NH3 → 2NaNH2 + H2
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H2O.
Металлоаммиачные растворы обладают металлической электропроводностью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окруженные молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Комплексообразование
Благодаря своим электронодонорным свойствам, молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металловприводит к образованию их аминокомплексов:
CuSO4 + 4NH3 → [Cu(NH3)4]SO4Ni(NO3)2 + 6NH3 → [Ni(NH2)6](NO3)2
Комплексообразование обычно сопровождается изменением окраски раствора, так в первой реакции голубой цвет (CuSO4) переходит в темно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной (Ni(NO3)2) в сине-фиолетовую. Наиболее прочные комплексы с NH3 образуют хром и кобальт в степени окисления +3.
Биологическая роль
Аммиак является конечным продуктом азотистого обмена в организме человека и животных. Он образуется при метаболизме белков, аминокислот и других азотистых соединений. Он высоко токсичен для организма, поэтому большая часть аммиака в ходе орнитинового цикла конвертируется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину). Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак.
Аммиак может также использоваться печенью для обратного процесса — ресинтеза аминокислот из аммиака и кетоаналогов аминокислот. Этот процесс носит название «восстановительное аминирование». Таким образом из щавелевоуксусной кислоты получается аспарагиновая, из α-кетоглутаровой — глутаминовая и т. д.
Физиологическое действие
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени. Запах аммиака ощущается при концентрации 37 мг/м³.
Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения составляет 20 мг/м³. Следовательно, если чувствуется запах аммиака, то работать без средств защиты уже опасно. Раздражение зева проявляется при содержании аммиака в воздухе 280 мг/м³, глаз — 490 мг/м³. При действии в очень высоких концентрациях аммиак вызывает поражение кожи: 7—14 г/м³ — эритематозный, 21 г/м³ и более — буллёзныйдерматит. Токсический отёк лёгких развивается при воздействии аммиака в течение часа с концентрацией 1,5 г/м³. Кратковременное воздействие аммиака в концентрации 3,5 г/м³ и более быстро приводит к развитию общетоксических эффектов. Предельно допустимая концентрация аммиака в атмосферном воздухе населённых пунктов равна: среднесуточная 0,04 мг/м³; максимальная разовая 0,2 мг/м³.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м³) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Южно-Казахстанской области .
Применение
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн. тонн. В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717)
В медицине 10% раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусы насекомых, обработка рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5–1 с). Внутрь (только в разведении) для индукции рвоты. При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипяченой воде и моют руки.
Поскольку является слабым основанием при взаимодействии нейтрализует кислоты.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Получение
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо. Однако скорость реакции при низких температурах ничтожно мала, а при высоких увеличивается скорость обратной реакции. Проведение реакции при очень высоких давлениях требует создания специального, выдерживающего высокое давление оборудования, а значит и больших капиталовложений. Кроме того, равновесие реакции даже при 700 °C устанавливается слишком медленно для практического её использования.
Применение катализатора (пористое железо с примесями Al2O3 и K2O) позволило ускорить достижение равновесного состояния. Интересно, что при поиске катализатора на эту роль пробовали более 20 тысяч различных веществ.
Учитывая все вышеприведённые факторы, процесс получения аммиака проводят при следующих условиях: температура 500 °C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30 %. В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза. Это оказывается более экономичным, чем дости
