Какие свойства присущи воздуху растворимость в воде

Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха.
Количество воздуха, способного к растворению в воде – снижается при повышении температуры и повышается при повышении давления.
Деаэрация.
При нагревании пресной воды начинают формироваться воздушные пузырьки. Как известно, вода не может удерживать растворенный воздух при повышении температуры. При 1 баре и температуре 100 0C (2120F) вода закипает и тогда уже водяной пар формирует пузырьки. Если быстро охладить воду, а потом снова ее нагреть, пузырьки не появятся до тех пор пока вода не закипит. Вода деаэрирована.
Растворимость.
Растворимость воздуха может быть выражена через соотношение:
Sa = ma/ mw
где
Sa = массовая доля растворимого воздуха в воде
ma = масса воздуха (кг)
mw = масса воды (кг)
Закон Генри.
Процесс растворения воздуха в воде подчиняется закону Генри, который гласит: “При постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором (равна давлению в растворе).” – В символьном виде закон может быть записан как:
c = k H pg
где
c = концентрация газа в растворе
k H = коэффициент Генри
pg = парциальное давление газа над раствором
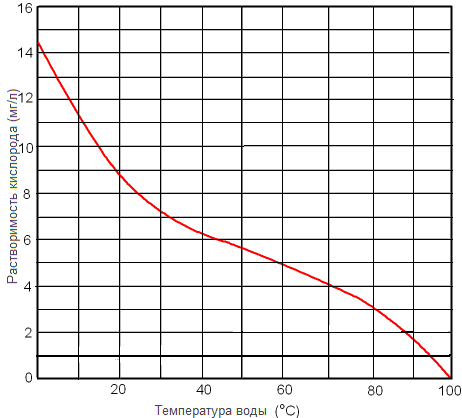
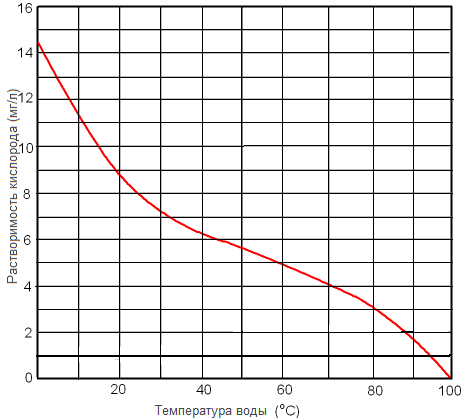
Растворимость кислорода в воде выше растворимости азота. Воздух, растворенный в воде содержит приблизительно 35,6 % кислорода по сравнению с 21% долей в обычном воздухе.
Пример – Расчет количества воздуха, растворенного в воде.
Количество воздуха, растворенного в воде может быть посчитано, исходя из закона Генри.
Коэффициенты Генри при температуре окружающей среды 25oC (77oF)
* Кислород – O2 : 756.7 атм/(моль/л)
* Азот – N2 : 1600 атм/(моль/л)
Молярные веса
* Кислород – O2 : 31.9988 г/моль
* Азот – N2 : 28.0134 г/моль
Относительное содержание (по объему) в воздухе:
* Кислород – O2 : ~ 0.21
* Азот – N2 : ~ 0.79
Объем кислорода, растворенного в воде при атмосферном давлении может быть посчитан как :
co = (1 атм) 0.21 / (756.7 атм/(моль/л)) (31.9988 г/моль)
= 0.0089 г/л
~ 0.0089 г/кг
Объем азота, растворенного в воде при атмосферном давлении может быть посчитан как:
cn = (1 атм) 0.79 / (1600 атм/(моль/л)) (28.0134 г/моль)
= 0.0138 г/л
~ 0.0138 г/кг
Поскольку воздух-это сумма кислорода и азота :
ca = (0.0089 г/л) + (0.0138 г/л)
= 0.0227 г/л
~ 0.023 г/кг
Таблица. Количество (масса) воздуха, растворенного в воде при различных давлениях и температуре 25oC (77oF):
Абсолютное давление (атм) | 1 | 2 | 3 | 4 | 5 | 6 |
| Объем растворенного в воде воздуха при 250C (г/кг) | 0,023 | 0,045 | 0,068 | 0,091 | 0,114 | 0,136 |
Рисунок. Растворимость кислорода в пресной воде при 1 атм в зависимости от температуры.
Деаэрация
Для максимальной деаэрации вода должна быть нагрета до 2120F (1000C) при атмосферном давлении. Это обычное инженерное решение для паровых систем, где пресная вода подается в систему через нагретый деаэратор наверху конденсатоприемника.
Также обычным решением является установка деаэрационных устройств с горячей стороны теплообменника в отопительных системах для интенсификации удаления растворенного воздуха из системы.
Поскольку максимум деаэрации приходится на минимум статического давления и максимум температуры в системе, то наилучший результат деаэрации достигается в верхних точках систем относительно уровня земли и/или на входе насоса.
Источник
Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Рабочие среды / / Воздух (Атмосфера) / / Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха.
Количество воздуха, способного к растворению в воде – снижается при повышении температуры и повышается при повышении давления. Деаэрация.При нагревании пресной воды начинают формироваться воздушные пузырьки. Как известно, способность воды удерживать растворенный воздух падает при повышении температуры. При 1 баре и температуре 100 0C (2120F) вода закипает, при этом содержание растворенного воздуха падает практически до нуля, и тогда уже водяной пар формирует пузырьки. Если быстро охладить воду, а потом снова ее нагреть, пузырьки не появятся до тех пор пока вода не закипит, потому что вода деаэрирована. (Существует, кроме того, масса практических методик деаэрации воды, не связанных с нагреванием. В целом – деаэрация – это удаление растворенного воздуха из жидкости.) Растворимость.
Закон Генри.
Пример – Расчет количества воздуха, растворенного в воде.
Таблица. Количество (масса) воздуха, растворенного в воде при различных давлениях и температуре 25oC (77oF):
Рисунок. Растворимость кислорода в пресной воде мг/л при 1 атм в зависимости от температуры.
Деаэрация – основные принципы и правила установки деаэраторов.
| ||||||||||||||
Поиск в инженерном справочнике DPVA. Введите свой запрос: | ||||||||||||||
Поиск в инженерном справочнике DPVA. Введите свой запрос:
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста.
Вложите в письмо ссылку на страницу с ошибкой, пожалуйста.
Коды баннеров проекта DPVA.ru
Начинка: KJR Publisiers
Консультации и техническая
поддержка сайта: Zavarka Team
Free xml sitemap generator
Источник
Воздух – это смесь газов. Окружает планету, образует атмосферу и содержится во всём, что существует. Он есть в воде, земле, растениях, животных, горах, камнях и необходим для жизни живых организмов. Физические, химические и гигиенические свойства формируют климат в регионах частей Земли, влияют на жизнедеятельность растений и животных.
Основные свойства воздуха
- Прозрачен.
- Не имеет цвета и запаха.
- Не имеет формы, занимает всё пространство.
- Упругость.
- Проводит звук и солнечные лучи.
- Сохраняет тепло.
- При нагревании расширяется, при охлаждении сжимается.
- Подвижен.
Физические свойства
- Температурные. Регулирует теплообмен.
- Влажность. Определяет насыщение газов кислородом, содержание водяного пара.
- Атмосферное давление. Масса атмосферного столба, который давит на поверхность планеты и на всё, что расположено внутри воздушного океана.
- Подвижность. Формирует ветра и обновление газового состава.
- Солнечная радиация. Определяет процент радиоактивных веществ и газов, содержащихся в атмосфере. Основной показатель формирования климата планеты.
- Электрическая активность. Количество электрических зарядов, содержащихся в воздушном пространстве.
Химический состав воздуха
Воздушная оболочка Земли формируется из смеси газов:
- Азот. Основной компонент атмосферы. Не участвует в дыхании, не поддерживает горение. Обеспечивает жизнедеятельность водорослей и некоторых растений.
- Кислород. Жизненно необходимый элемент. Является необходимым в формировании биологических процессов организмов животных, растений. Служит окислителем и основным компонентом горения веществ.
- Углекислый газ. Поглощается деревьями и преобразуется в кислород.
 В небольших количествах атмосфера содержит озон, водород, неон, другие газы. По количеству содержания вредных примесей определяют чистоту воздуха. Подробнее – в статье о составе воздуха.
В небольших количествах атмосфера содержит озон, водород, неон, другие газы. По количеству содержания вредных примесей определяют чистоту воздуха. Подробнее – в статье о составе воздуха.
Теплопроводность воздуха
Окружающий воздух практически не проводит тепло. Особенность задерживать тепловой заряд широко используется человеком и животными. Ограничивая подвижность потока, воздушная прослойка задерживает теплообмен организмов, создаёт комфортный микроклимат.
При нагревании с воздухом происходит расширение и он поднимается, становится разреженным. Изменяется его химический состав и влажность. Водяной пар распадается на отдельные газы, становится более летучим.
При охлаждении воздух сжимается и он опускается. Незначительное содержание твёрдых частиц в газах окисляется и насыщается водяными парами. Воздух становится тяжелее и плотнее.
Применение и использование свойств воздуха
Воздушную оболочку планеты активно используют животные и птицы. Способность задерживать тепло помогает животным выживать и регулировать тепловые процессы организма. Шерсть, обитателей северных широт, имеет полую структуру.
Особое строение пера и движение воздушных масс птицы используют для полётов и планирования над землёй.
 Наполненный атмосферой пузырь, удерживает рыб в толще воды и способствует перемещению из глубин водоёмов к поверхности.
Наполненный атмосферой пузырь, удерживает рыб в толще воды и способствует перемещению из глубин водоёмов к поверхности.
Подвижность используется растениями для опыления и распространения семян на большие площади.
Человек использует свойства атмосферы в широких спектрах своей жизнедеятельности:
- Теплопроводность обеспечивает обогрев и терморегуляцию организма.
- Способность тёплых воздушных потоков подниматься используют в полётах.
- Упругость и сжатие применяют во всех промышленных системах. Его закачивают в автомобильные шины. Нагнетая воздушное давление, работают пневматические инструменты, оружие.
- Кислород участвует в процессах горения. Все двигатели внутреннего сгорания потребляют большие объёмы кислорода и его соединений.
Более подробная информация об использовании и значении воздуха живыми организмами здесь.
Сравнение свойств воды и воздуха
Основную роль воздушный океан играет в дыхании всех живых существ Земли. Содержание его в воде используется всеми подводными животными и растениями.
Вода и воздух имеют похожие параметры. Она так же прозрачна и безвкусна, так же реагирует на нагрев и охлаждение. Основным отличием воды является способность растворять вещества и её большая плотность. Вода имеет большую массу и теплопроводность, проводит заряды электричества. Способность извлекать необходимые компоненты из воды, без применения специального оборудования, человеку и млекопитающим не под силу.
Оценка статьи:
Загрузка…
Источник
В обычной неассоциированной жидкости, например в такой, как бензин, молекулы свободного скользят одна вокруг другой. В воде же они скорее катятся, чем скользят. Молекулы воды, как известно, соединены между собой водородными связями, поэтому прежде чем произойдет какое-либо смещение, нужно разорвать хотя бы одну из этих связей. Эта особенность и определяет вязкость воды.
Диэлектрической постоянной воды называется ее способность нейтрализовать притяжение, существующее между электрическими зарядами. Растворение твердых веществ в воде – сложный процесс, который обусловливается взаимодействием частиц растворенного вещества и частиц воды.
При изучении строения веществ с помощью рентгеновских лучей было установлено, что большинство твердых тел имеет кристаллическое строение, т. е. частицы вещества расположены в пространстве в определенном порядке. Частицы одних веществ расположены так, будто бы они находятся в углах крошечного куба, частицы других – в углах, центре и в середине сторон тетраэдра, призмы, пирамиды и пр. Каждая из этих форм является мельчайшей ячейкой более крупных кристаллов аналогичной формы. У одних веществ в узлах их кристаллической решетки находятся молекулы (у большинства органических соединений), у других (например, у неорганических солей) – ионы, т. е. частицы, состоящие из одного или нескольких атомов, имеющих положительные или отрицательные заряды. Силами, удерживающими ионы в определенном, ориентированном в пространстве порядке кристаллической решетки, являются силы электростатического притяжения разноименно заряженных ионов, составляющих кристаллическую решетку.
Если, например, растворить в воде хлористый натрий, то положительно заряженные ионы натрия и отрицательно заряженные ионы хлора будут отталкиваться друг от друга.
Это отталкивание происходит потому, что у воды высокая диэлектрическая постоянная, т. е. выше, чем у любой другой жидкости. Она уменьшает силу взаимного притяжения между противоположно заряженными ионами в 100 раз. Причину сильно нейтрализующего действия воды нужно искать в расположении ее молекул. Водородный атом в них не делит поровну свой электрон с тем атомом кислорода, к которому он прикреплен. Этот электрон всегда ближе к кислороду, чем к водороду. Поэтому водородные атомы заряжены положительно, а кислородные – отрицательно.
Когда какое-либо вещество, растворяясь, распадается на ионы, кислородные атомы притягиваются к положительным ионам, а водородные – к отрицательным. Молекулы воды, окружающие положительный ион, направляют к нему свои кислородные атомы, а молекулы, которые окружают отрицательный ион, устремляются к нему своими атомами водорода. Таким образом молекулы воды образуют как бы решетку, которая отделяет ионы друг от друга и нейтрализует их притяжение (рис. 12). Чтобы оторвать друг от друга ионы, находящиеся в кристаллической решетке, и перевести их в раствор, необходимо преодолеть силу притяжения этой решетки. При растворении солей такой силой является притяжение ионов решетки молекулами воды, характеризуемое так называемой энергией гидратации. Если при этом энергия гидратации по сравнению с энергией кристаллической решетки будет достаточно велика, то ионы будут отрываться от последней и перейдут в раствор.
Взаимосвязь между молекулами воды и ионами, оторванными от решетки, в растворе не только не ослабевает, а становится еще теснее.

Рис. 12. Разрушение ионной решетки кристалла NaCl полярными молекулами воды при растворении.
Как уже отмечалось, в растворе ионы окружаются и разобщаются молекулами воды, которые, ориентируясь на них своими противоположными по заряду частями, образуют так называемую гидратную оболочку (рис. 13). Величина этой оболочки различна у разных ионов и зависит от заряда иона, его размера и, кроме того, от концентрации ионов в растворе.
В продолжение нескольких лет физико-химики изучали воду в основном как растворитель электролитов. В результате получено много сведений об электролитах, но очень мало о самой воде. Как ни странно, но только в последние годы появились работы, посвященные изучению отношения воды к веществам, которые в ней практически не растворяются.
Наблюдалось немало поразительных явлений. Например, однажды труба, по которой шел природный газ при t = 19°С, оказалась забитой, мокрым снегом с водой. Стало ясным, что дело здесь не в температуре, а в других свойствах воды. Возник ряд вопросов: почему вода замерзла при столь высокой температуре, как вода могла соединиться с веществами, которые в ней нерастворимы.
Эта тайна еще не была раскрыта, когда обнаружилось, что даже такие благородные газы, как аргон и ксенон, которые не вступают ни в какие химические реакции, могут связываться с водой, образуя некоторое подобие соединений.

Рис. 13. Разъединение ионов Na+ и С1- полярными молекулами воды, образующими вокруг них гидратную оболочку.
Интересные результаты по растворимости в воде метана были получены в Иллинойсе. Молекулы метана не образуют ионов в воде и не воспринимают водородных связей; притяжение между ними и молекулами воды очень слабое. Однако метан все же, хотя и плохо, растворяется в воде, и его диссоциированные молекулы образуют с ней соединения – гидраты, в которых несколько молекул воды присоединены к одной молекуле метана. При этой реакции высвобождается в 10 раз больше тепла, чем при растворении метана в гексане (метан растворяется в гексане лучше, чем в воде).
Факт растворения метана в воде представляет большой интерес. Ведь по объему молекула метана вдвое больше молекулы воды. Чтобы метан растворился в воде, между ее молекулами должны образоваться довольно большие «дырки». Для этого требуется значительная затрата энергии, большая чем для испарения воды (примерно 10 000 калорий на каждый моль). Откуда же появляется столько энергии? Силы притяжения между молекулами метана и воды слишком слабы, они не могут дать столько энергии. Поэтому существует другая возможность: структура поды изменяется в присутствии метана. Предположим, что молекула растворенного метана окружена оболочкой из 10-20 молекул воды. При образовании таких ассоциаций молекул выделяется теплота. В пространстве, занятом молекулой метана, исчезают силы взаимного притяжения между молекулами воды, а значит, и внутреннее давление. В таких условиях, как мы видели, вода замерзает при температуре выше нуля.
Вот почему молекулы, находящиеся в промежутке между метаном и водой, могут кристаллизоваться, что и произошло в описанном выше случае. Замороженные гидраты могут поглощаться раствором и выделяться из него. Эта теория известна как теория айсбергов. Практически, как показывают исследования, все непроводящие вещества, которые подвергались испытанию, образуют устойчивые кристаллические гидраты. В то же время у электролитов такая тенденция выражена слабо. Все это ведет к совершенно новому пониманию растворимости.
Считалось, что растворение электролитов происходит в результате действия сил притяжения. Теперь же доказано, что растворение неэлектролитов происходит не благодаря силам притяжения между этими веществами и водой, а в результате недостаточного притяжения между ними. Вещества, не распадающиеся на ионы, соединяются с водой, так как они устраняют внутреннее давление и тем самым способствуют появлению кристаллических образований.
Чтобы лучше понять образование таких гидратов, целесообразно рассмотреть их молекулярную структуру.
Доказано, что образующиеся гидраты имеют кубическую структуру (решетку) в отличие от гексагональной структуры льда. Дальнейшие работы исследователей показали что гидрат может иметь две кубические решетки: в одной из них промежутки между молекулами равны 12, в другой – 17 А. В меньшей решетке 46 молекул воды, в большей 136. Дырки молекул газа в меньшей решетке имеют 12-14 граней, а в большей – 12-16, к тому же они разнятся по своим размерам и заполняются молекулами различной величины, причем могут быть заполнены не все дырки. Такая модель с большой степенью точности объясняет действительное строение гидратов.
Роль таких гидратов в жизненных процессах трудно переоценить. Эти процессы происходят в основном в промежутках между молекулами воды и протеина. Вода при этом имеет сильную тенденцию к кристаллизации, так как в протеиновой молекуле содержится много неионных, или неполярных, групп. Всякий такой гидрат образуется при меньшей плотности, чем лед, поэтому его образование может вести к значительному разрушительному расширению.
Итак, вода – это своеобразное и сложное вещество с определенными и разнообразными химическими свойствами. Она имеет стройную и в то же время меняющуюся физическую структуру.
Развитие всей живой и в значительной части неживой природы неразрывно связано с характерными особенностями воды.
Источник