Какие свойства предельных одноатомных спиртов определяются наличием

- Спирты – это производные углеводородов, у которых один атом (или более) замещены на функциональную группу –ОН.
Примеры спиртов: СН3ОН (метиловый спирт), СН3-СН2-ОН (этиловый спирт).
- Фенолы – это соединения, в которых содержится ароматическое ядро и непосредственно связанная с ним группа –ОН.
Примеры фенолов: С6Н5-ОН (фенол), СН3-С6Н4-ОН (крезол).
Общая формула этих веществ – R-OH.
Спирты
Классификация спиртов
Существует несколько классификаций спиртов по различным критериям. По характеру органических радикалов подразделяют на:
- предельные – CnH2n+1OH;
- непредельные – CnH2n-1OH и CnH2n-3OH;
- ароматические – CnH2n-7OH;
- циклические.
По числу функциональных групп –ОН:
- одноатомные;
- двухатомные;
- многоатомные (трехатомные, четырехатомные, пятиатомные и шестиатомные).
А также по названию углеродного атома, связанного с группой –ОН:
- первичные (R-CH2-OH);
- вторичные (R-CH(R)-OH);
- третичные (C(R)3-OH).
Органические соединения, которые содержат гидроксильные группы, непосредственно связанные с атомами углерода ароматического кольца называют фенолами, и это уже другой самостоятельный класс соединений.
Физические свойства одноатомных и многоатомных спиртов
Одноатомные спирты – это вещества, имеющие одну группу –ОН, а многоатомные – несколько. Физические свойства спиртов объясняются способностью образовывать межмолекулярные водородные свойства. Они имеют высокую температуру кипения, жидкое агрегатное состояние и растворимость в воде. С увеличением углеродной цепи температура возрастает, а растворимость уменьшается. Простые спирты характеризуются специфическим запахом.
Химические свойства одноатомных спиртов
Они определяются присутствием группы –ОН, а также участием α-углеродного атома первичных и вторичных спиртов.
I. Кислотные свойства
Спирты проявляют кислотные свойства, но кислотами не являются, т.к. не реагируют с гидроксидами, оксидами и солями металлов. Константа кислот меньше константы воды. Разница обусловлена влиянием радикалов – чем больше частично отрицательный заряд на группе –ОН, тем сильнее кислород удерживает свой водород и тем меньше кислотные свойства. По гомологическому ряду кислотные свойства убывают.
- Взаимодействие спиртов с щелочными и щелочноземельными металлами
2 R-OH + 2 Me → 2 R-OMe + H2
- Взаимодействие с карбоновыми кислотами
R-COOH + R’-OH → R-COOR’ + H2O
- Взаимодействие с магнийорганическими соединениями
R-OH + CH3-MgCl → R-O-MgCl + CH4
- Взаимодействие с неорганическими кислотами
R-OH + HO-NO2 → R-O-NO2 + H2O
II. Основные свойства
Основные свойства проявляются себя в реакциях с сильными кислотами, образуя оксониевые соли с дальнейшими превращениями в галогенпроизводные. R-OH + HBr → R-Br + H2O
- Взаимодействие с галогенпроизводными (фосфор)
R-OH + PBr3 → R-Br + H3PO3
- Взаимодействие с галогенпроизводными (сера)
R-OH + SOCl2 → R-Cl + SO2 + HCl
III. Реакции замещения
Для спиртов характерны реакции замещения атома водорода в функциональной группе –ОН.
- Этерификация Образование сложных эфиров провоцирует взаимодействие одноатомных спиртов с различными кислотами. Катализатором реакции служат сильные неорганические кислоты.
СН3-С(О)-СН2-ОН + СН3-СН2-ОН → СН3-С(О)-О-СН2-СН3 + Н2О
Эта реакция обратима и для смещения равновесия в сторону сложного эфира необходимо провести нагревание в присутствии концентрированной серной кислоты.
- Взаимодействие спиртов с галогеноводородами Эта реакция также обратима.
R-OH + HCl → R-Cl + H2O
IV. Реакции отщепления
Для спиртов характерны реакции отщепления группы –ОН или водорода этой группы и водорода соседнего углеродного атома.
- Дегидратация спиртов
Данная реакция имеет два типа.
- Межмолекулярная дегидратация.
Одна молекула воды образуется в результате отщепления атома водорода от одной молекулы спирта и гидроксильной группы от другой. В ходе данной реакции образуется простой эфир. Катализатор – концентрированная серная кислота. Реакция проводится при высоких температурах.
R-OH + R’-OH → R-O-R’ + H2O
- Внутримолекулярная дегидратация.
Одна молекула отщепляется только от одной молекулы спирта. Эта реакция протекает в присутствии концентрированной серной кислоты и при нагревании.
CH3-CH2-OH → CH2=CH2 + H2O
При дегидратации несимметричных спиртов действует правило Зайцева.
- Межмолекулярная дегидратация.
- Дегидрирование спиртов
Эта реакция зависит от типа одноатомного спирта.
- Дегидрирование первичных спиртов
Проводится в присутствии меди и при нагревании. Образуется альдегид.
CH3-CH2-OH → CH3-CHO + H2
- Дегидрирование вторичных спиртов
СН3-СН(ОН)-СН3 → СН3-С(О)-СН3 + Н2
- Дегидрирование третичных спиртов
Третичные спирты не подвергаются данному типу реакций.
- Дегидрирование первичных спиртов
Дегидратация, подразумевает отщепление молекул воды.
Различают:
- межмолекулярную дегидратацию
При межмолекулярной дегидратации спиртов молекула воды образуется при отщеплении атома водорода от одной молекулы спирта и гидроксильной группы — от другой молекулы.
В результате этой реакции образуются соединения, относящиеся к классу простых эфиров (R-O-R):
2 C2H5OH = C2H5 – O – C2H5 + H2O (в присутсвии серной кислоты при нагревании)
- внутримолекулярную дегидратацию.
Внутримолекулярная дегидратация спиртов происходит так, что одна молекула воды отщепляется от одной молекулы спирта. Реакции протекает при более жестких условиях, заключающихся в необходимости использования заметно более сильного нагревания по сравнению с межмолекулярной дегидратацией. При этом из одной молекулы спирта образуется одна молекула алкена и одна молекула воды:
С2H5OH = C2H4 + H2
Для молекулы метанола реакция дегидратации невозможно, потому что молекула содержит один атом углерода. При дегидратации метанола возможно образование только простого эфира (CH3-O-CH3).
В случае дегидратации несимметричных спиртов внутримолекулярное отщепление воды будет протекать в соответствии с правилом Зайцева, т.е. водород будет отщепляться от наименее гидрированного атома углерода:
C4H9OH = C4H8 + H2O (реакция протекает в присутствии серной кислоты при нагревании до образовании бутена – 1)
V. Окисление
- Горение
Спирты хорошо горят и выделяют при этом тепло.
2 СН3-ОН + 3 О2 → 2 СО2 + 4 Н2О + Q
- Окисление
Эти реакции протекают в присутствии меди, хрома и других катализаторов.
Первичные спирты образуют альдегиды.
СН3-СН2-ОН + CuO → CH3CHO + Cu+ + H2O
Вторичные спирты при таких же условиях образуют кетоны.
СН3-СН2-СН(ОН)-СН3 + CuO → CH3-CH2-C(O)-CH3 + Cu+ + H2O
Третичные спирты не вступают в реакции окисления.
Химические свойства двухатомных спиртов (гликолей)
I. Кислотные свойства
Кислотные свойства гликолей выше, чем у одноатомных, что обусловлено отрицательным индуктивным эффектом одной группы –ОН на другую. Они способны реагировать с щелочными металлами, их оксидами и гидроксидами, но не могут с солями.
Один или оба атома водорода могут замещаться на атом металла в зависимости от условий.
II. Взаимодействие с гидроксидами тяжелых металлов
Эта реакция служит качественной реакцией на многоатомность, т.е. она характерна и для трехатомных спиртов.
III. Реакция этерификации
Сложные эфиры образуются при взаимодействии двухатомных спиртов с кислотами.
C6H5-ONa + CH3COCl → C6H5-OCO-CH3 + NaCl
Реакция обратима и катализируется сильными неорганическими кислотами.
Химические свойства трехатомных спиртов (алкантриолей)
Главнейшим представителем является глицерин. Он входит в состав жиров и липидов. Кислотные свойства алкантриолей выше, чем у двухатомных спиртов.
Взаимодействие глицерина с азотной кислотой:
HO-CH2-CH(OH)-CH2-OH + HO-NO2 → NO2-O-CH2-CH(O-NO2)-CH2-O-NO2 + 3 H2O
В результате реакции образуется тринитроглицерин – это масляная жидкость с большой взрывчатой силой.
Спирты применяют в органическом синтезе, при изготовлении биотоплива, растворителей, как душистое вещество в парфюмерии, как основу в алкогольной продукции и т.д.
Фенол
Фенол – это простейшее соединение класса фенолы, которое характеризуется непосредственно связью функциональной группы –ОН с бензольным кольцом. У атома кислорода есть неподеленная электронная пара, с помощью которой она проявляет положительный мезомерный эффект.
Физические свойства фенолов
Фенолы – это кристаллические вещества. Имеют плохую растворимость в холодной и хорошую в горячей воде и водных растворах щелочей. Обладают специфическим запахом. Характерна высокая температура плавления и кипения из-за способности создавать водородные связи.
Химические свойства фенолов
Электронная плотность на кислороде фенола уменьшается, а в ядре – увеличивается, вследствие строения соединения. Полярность связи О-Н увеличивается и возможны реакции замещения атома водорода под действием щелочей.
I. Кислотные свойства
Кислотные свойства фенолов выше, чем у спиртов. Но в отличии от них, фенолы – это слабые кислоты.
- Пропускание углекислого газа через соли фенола
C6H5-ONa + CO2 + H2O → C6H5-OH + NaHCO3
- Образование сложных эфиров
C6H5-OH + CH3-COCl → C6H5-O-CO-CH3 + HCl
II. Реакция галогенирования
Функциональная группа –ОН – заместитель первого рода, поэтому она обогащается бензольное кольцо электронной плотностью. Это значит, что заместители пойдут в орто- и параположения, относительно группы –ОН.
III. Реакция нитрования
При взаимодействии фенола с азотной кислотой образуется смесь из орто- и паранитрофенолов.
А при взаимодействии фенола с нитрующей смесью образуется 2,4,6 –тринитрофенола – это опасное взрывчатое вещество.
IV. Реакция присоединения
Фенолы – это ненасыщенные соединения, поэтому для них характерны реакции присоединения.
V. Качественные реакции
Качественной реакцией на фенолы служит взаимодействие его с кислотами Льюиса. В результате образуется комплекс фиолетового цвета.
Фенолы нашли широкое применение в получении фенилформальдегидных смол, синтетических волокон, красителей и лекарств. Пикриновая кислота – это опасное взрывчатое средство.
Источник
Вещества, образованные от предельных углеводородов и содержащие гидроксильную группу (-ОН), называются насыщенными или предельными одноатомными спиртами. Названия спиртов совпадают с названиями алканов в гомологическом ряду с суффиксом «-ол».

Строение
Общая формула предельных одноатомных спиртов – CnH2n+1-OH. Гидроксил является функциональной группой и определяет физические и химические свойства спиртов.
Основные одноатомные спирты (гомологический ряд метанола):
- метанол или метиловый спирт – CH3OH;
- этанол или этиловый спирт – C2H5OH;
- пропанол – C3H7OH;
- бутанол – C4H9OH;
- пентанол – C5H11OH.
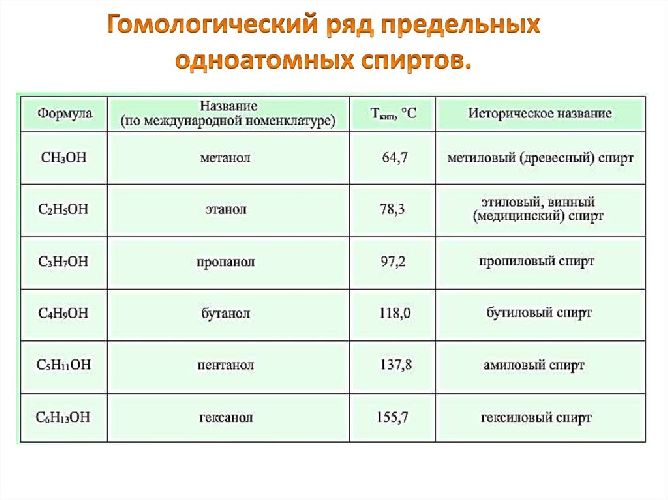
Рис. 1. Гомологический ряд одноатомных спиртов.
Насыщенным спиртам свойственна структурная и межклассовая изомерия. В зависимости от расположения гидроксильной группы в молекуле вещества различают:
- первичные спирты – гидроксил прикреплён к первому атому углерода;
- вторичные спирты – гидроксил находится у второго атома углерода;
- третичные спирты – гидроксил соединён с третьим атом углерода.
Начиная с бутанола, наблюдается изомерия углеродного скелета. В этом случае название спирта записывается с двумя цифрами: первая указывает на положение метильной группы, вторая – гидроксила.
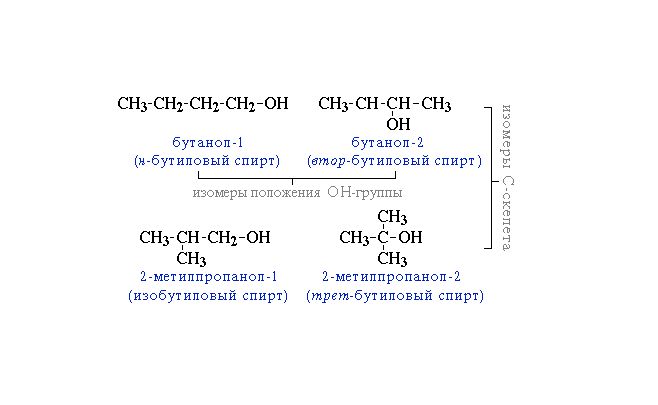
Рис. 2. Изомерия углеродного скелета насыщенных спиртов.
Одноатомные спирты образуют межклассовые изомеры с простыми эфирами – этиловый спирт (CH3CH2-OH), диметиловый эфир (CH3-O-CH3).
Несмотря на то, что пропанол содержит три атома углерода, он может образовывать только два изомера по гидроксильной группе – пропанол-1 и пропанол-2.
Свойства
В зависимости от количества атомов углерода меняется агрегатное состояние одноатомных спиртов. Если в молекуле до 15 атомов углерода, то это жидкость, больше 15 – твёрдое вещество. Хорошо смешиваются с водой первые два спирта из гомологического ряда – метанол и этанол, а также структурный изомер пропанол-2.
Все спирты плавятся и кипят при высоких температурах.
Активность спиртов объясняется наличием О-Н и С-О связей, которые легко разрываются. Основные химические свойства одноатомных спиртов приведены в таблице.
Реакция | Описание | Уравнение |
С металлами | Реагируют только со щелочными и щелочноземельными металлами с разрывом связи О-Н | 2C2H5OH + 2К → 2С2Н5ОК + Н2 |
С кислородом | Горят в присутствии перманганата или дихромата калия (KMnO4, K2Cr2O7) | C2H5OH + 3O2 → 2CO2 + H2O |
C галогеноводородами | Гидроксильная группа вытесняется галогеном | C2H5OH + HBr → C2H5Br + H2O |
С кислотами | Реагируют с минеральными и органическими кислотами с образованием сложных эфиров | C2H5OH + CH3COOH → CH3COOC2H5 |
С оксидами металлов | Качественная реакция с образование альдегида | C2H5OH + CuO → CH3COH + H2O + Cu |
Дегидратация | Протекает в присутствии сильной кислоты при высокой температуре | C2H5OH → C2H4 + H2O |
С карбоновыми кислотами | Реакция этерификации – образование сложных эфиров | C2H5OH + CH3COOH → CH3COOC2H5 + H2O |

Рис. 3. Качественная реакция одноатомных спиртов.
Одноатомные спирты имеют широкое применение в промышленности. Наиболее активно применяется этанол. Его используют для изготовления парфюмерии, уксусной кислоты, лекарств, лаков, красителей, растворителей и других веществ.
Что мы узнали?
Из урока химии узнали, что предельные или насыщенные одноатомные спирты являются производными предельных углеводородов с одной гидроксильной группой (гидроксилом). Это жидкости или твёрдые вещества в зависимости от количества атомов углерода. Одноатомные спирты образуют изомеры по гидроксильной, метильной группе и с простыми эфирами. Предельные одноатомные спирты реагируют со щелочными металлами, кислотами, оксидами. Используются для изготовления лекарств, растворителей, кислот.
Тест по теме
Оценка доклада
Средняя оценка: 4.6. Всего получено оценок: 194.
Источник
Спирты – органические соединения, в состав молекул которых входит одна или несколько гидроксильных групп, соединенных с углеводородным радикалом.
По числу гидроксильных групп в молекуле спирты делятся на одноатомные, двухатомные трехатомные и т. д.
| Одноатомные спирты: | Двухатомный спирт: | Трехатомный спирт: | |
| CH3—OH метанол (метиловый спирт) | CH3CH2—OH этанол (этиловый спирт) | HO—CH2—CH2—OH этандиол-1,2 (этиленгликоль) | пропантриол-1,2,3 (глицерин) |
Одноатомные спирты
Общая формула одноатомных спиртов – R—OH.
По типу углеводородного радикала спирты делятся на предельные, непредельные и ароматические.
| Предельный спирт: | Непредельный спирт: | Ароматический спирт: |
| CH3CH2CH2—OH пропанол-1 (пропиловый спирт) | CH2=CH—CH2—OH пропенол-2,1 (аллиловый спирт) | C6H5—CH2—OH фенилметанол (бензиловый спирт) |
Общая формула предельных одноатомных спиртов – CnN2n+1—OH.
Органические вещества, содержащие в молекуле гидроксильные группы, непосредственно связанные с атомами углерода бензольного кольца называются фенолами. Например, C6H5—OH – гидроксобензол (фенол).
По типу атома углерода, с которым связана гидроксильная группа, различают первичные (R—CH2—OH), вторичные (R—CHOH—R’) и третичные (RR’R”C—OH) спирты.
CnN2n+2O – общая формула и предельных одноатомных спиртов, и простых эфиров.
Предельные одноатомные спирты изомерны простым эфирам – соединениям с общей формулой R—O—R’.
| г о м о л о г и | CH3OH метанол | |||||
| CH3CH2OH этанол | CH3OCH3 диметиловый эфир | |||||
| CH3CH2CH2OH пропанол-1 | пропанол-2 | CH3OCH2CH3 метилэтиловый эфир | ||||
| CH3(CH2)3OH бутанол-1 | бутанол-2 | 2-метил-пропанол-2 | 2-метил-пропанол-1 | CH3OCH2CH2CH3 метилпропиловый эфир | CH3CH2OCH2CH3 диэтиловый эфир | |
| и з о м е р ы | ||||||
Для спиртов характерна структурная изомерия (изомерия углеродного скелета, изомерия положения заместителя или гидроксильной группы), а также межклассовая изомерия.
Алгоритм составления названий одноатомных спиртов
- Найдите главную углеродную цепь – это самая длинная цепь атомов углерода, с одним из которых связана функциональная группа.
- Пронумеруйте атомы углерода в главной цепи, начиная с того конца, к которому ближе функциональная группа.
- Назовите соединение по алгоритму для углеводородов.
- В конце названия допишите суффикс -ол и укажите номер атома углерода, с которым связана функциональная группа.
Физические свойства спиртов во многом определяются наличием между молекулами этих веществ водородных связей:
С этим же связана и хорошая растворимость в воде низших спиртов.
Простейшие спирты – жидкости с характерными запахами. С увеличением числа атомов углерода температура кипения возрастает, а растворимость в воде падает. Температура кипения у первичных спиртов больше, чем у вторичных спиртов, а у вторичных – больше, чем у третичных. Метанол крайне ядовит.
Химические свойства спиртов
- Горение:
C2H5OH + 3O2 2CO2 +3H2O + Q
- Реакции с щелочными и щелочноземельными металлами (“кислотные” свойства):
Атомы водорода гидроксильных групп молекул спиртов, также как и атомы водорода в молекулах воды, могут восстанавливаться атомами щелочных и щелочноземельных металлов (“замещаться” на них).2Na + 2H—O—H 2NaOH + H2
2Na + 2R—O—H 2RONa + H2Атомы натрия легче восстанавливают те атомы водорода, у которых больше положительный частичный заряд (+). И в молекулах воды, и в молекулах спиртов этот заряд образуется за счет смещения в сторону атома кислорода, обладающего большой электроотрицательностью, электронных облаков (электронный пар) ковалентных связей.
Молекулу спирта можно рассматривать как молекулу воды, в которой один из атомов водорода замещен углеводородным радикалом. А такой радикал, богатый электронными парами, легче, чем атом водорода, позволяет атому кислорода оттягивать на себя электронную пару связи RO.
Атом кислорода как бы “насыщается”, и за счет этого связь O—H оказывается менее поляризованной, чем в молекуле воды (+ на атоме водорода меньше, чем в молекуле воды).
В результате атомы натрия труднее восстанавливают атомы водорода в молекулах спиртов, чем в молекулах воды, и реакция идет намного медленнее.
Иногда, основываясь на этом, говорят, что кислотные свойства спиртов выражены слабее, чем кислотные свойства воды.
Из-за влияния радикала кислотные свойства спиртов убывают в ряду
метанол первичные спирты вторичные спирты третичные спирты
С твердыми щелочами и с их растворами спирты не реагируют.
- Реакции с галогеноводородами:
C2H5OH + HBr C2H5Br + H2O
- Внутримолекулярная дегидратация (t > 140oС, образуются алкены):
C2H5OH C2H4 + H2O
- Межмолекулярная дегидратация (t oС, образуются простые эфиры):
2C2H5OH C2H5OC2H5 + H2O
- Окисление (мягкое, до альдегидов):
CH3CH2OH + CuO CH3—CHO + Cu + H2O
Это качественная реакция на спирты: цвет осадка изменяется с черного на розовый, ощущается своеобразный “фруктовый” запах альдегида).
Получение спиртов
- Щелочной гидролиз галогеналканов (лабораторный способ): C2H5Cl + NaOH C2H5OH + NaCl.
- Гидратация алкенов: C2H4 + H2O C2H5OH.
- Брожение глюкозы : C6H12O6 2C2H5OH + 2CO2.
- Синтез метанола: CO + 2H2 CH3OH
Многоатомные спирты
Примерами многоатомных спиртов является двухатомный спирт этандиол (этиленгликоль)
HO—CH2—CH2—OH
и трехатомный спирт пропантриол-1,2,3 (глицерин)
HO—CH2—CH(OH)—CH2—OH.
Это бесцветные сиропообразные жидкости, сладкие на вкус, хорошо растворимы в воде. Этиленгликоль ядовит.
Химические свойства многоатомных спиртов по большей части сходны с химическими свойствами одноатомных спиртов, но кислотные свойства из-за влияния гидроксильных групп друг на друга выражены сильнее.
Качественной реакцией на многоатомные спирты является их реакция с гидроксидом меди(II) в щелочной среде, при этом образуется ярко-синие растворы сложных по строению веществ. Например, для глицерина состав этого соединения выражается формулой Na2[Cu(C3H6O3)2].
Фенолы
Важнейшим представителем фенолов является фенол (гидроксобензол, старые названия – гидроксибензол, оксибензол) C6H5—OH.
Физические свойства фенола: твердое бесцветное вещество с резким запахом; ядовит; при комнатной температуре заметно растворим в воде, водный раствор фенола называют карболовой кислотой.
Химические свойства
- Кислотные свойства. Кислотные свойства фенола выражены сильнее, чем у воды и предельных спиртов, что связано с большей полярностью O—H связи и с большей устойчивостью образующегося при ее разрыве фенолят-иона. В отличие от спиртов, фенолы реагируют не только с щелочными и щелочноземельными металлами, но и с растворами щелочей, образуя феноляты:
2C6H5OH + 2Na 2C6H5ONa + H2 фенолят натрия C6H5OH + NaOH C6H5ONa + H2O
Однако кислотные свойства фенола выражены слабее, чем у карбоновых кислот и, тем более, у сильных неорганических.
- Замещение в бензольном кольце. Наличие гидроксильной группы в качестве заместителя в молекуле бензола приводит к перераспределению электронной плотности в сопряженной -системе бензольного кольца, при этом увеличивается электронная плотность у 2-го, 4-го и 6-го атомов углерода (орто– и пара-положения) и уменьшается у 3-го и 5-го атомов углерода (мета-положение).
а) Реакция с бромной водой (качественная реакция):
Образуется 2,4,6-трибромфенол – осадок белого цвета.
б) Нитрование (при комнатной температуре):
C6H5—OH + HNO3(разб.) H2O + O2N—C6H4—OH (смесь орто– и пара-изомеров)
По вторй реакции образуется 2,4,6-тринитрофенол (пикриновая кислота).
- Поликонденсация фенола с формальдегидом (по этой реакции происходит образование фенолформальдегидной смолы:
- Качественная реакция с хлоридом железа(III). Образуется комплексное соединение фиолетового цвета.
Задачи и тесты по теме “Тема 4. “Спирты. Фенолы”.”
Рекомендации к теме
Изучив тему, Вы должны усвоить понятия: функциональная группа, спирты, фенолы, одноатомные спирты, многоатомные спирты, предельные спирты, ароматические спирты.
Проверьте, знаете ли вы общие формулы одноатомных предельных спиртов и простых эфиров. Проверьте, знаете ли вы формулы метанола, этанола, фенола, этиленгликоля, глицерина. Проверьте, знаете ли вы правила номенклатуры одноатомных предельных спиртов; объяснение растворимости спиртов в воде и значительно более высокие температуры кипения по сравнению с соответствующими углеводородами; в чём выражаются кислотные свойства спиртов и фенолов; качественные реакции на многоатомные спирты, фенол, этанол.
Проверьте, умеете ли Вы производить расчеты по уравнениям реакций с учетом выхода продукта.
Пример. Определите объем этилена, который можно получить при дегидратации 92 г этилового спирта, если выход продукта составляет 50 %.
Ответ: 22,4 л
Убедившись, что все необходимое усвоено, переходите к выполнению заданий. Желаем успехов.
Рекомендованная литература:
- О. С. Габриелян и др. Химия 10 кл. М., Дрофа, 2002;
- Г. Е. Рудзитис, Ф. Г. Фельдман. Химия 10 кл. М., Просвещение, 2001.
- Г. Г. Лысова. Опорные конспекты и тесты по органической химии. М., ООО “Глик плюс”, 1999.
Источник
