Какие свойства предельных одноатомных спиртов определяются

Химический свойства предельных одноатомных спиртов
В химических реакциях гидроксисоединений возможно разрушение одной из двух связей:
С–ОН с отщеплением ОН-группы О–Н с отщеплением водорода. Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления (элиминирования), когда образуется двойная связь.Полярный характер связей С–О и О–Н способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму. При разрыве связи О–Н с отщеплением протона Н+ проявляются кислотные свойства гидроксисоединения, а при разрыве связи С–О – свойства основания и нуклеофильного реагента.
Таким образом, гидроксисоединения могут вступать в многочисленные реакции, давая различные классы соединений. Вследствие доступности гидроксисоединений, в особенности спиртов, каждая из этих реакций является одним из лучших способов получения определенных соединений.
1. Кислотные свойства гидроксисоединений
Одноатомные спирты реагируют с активными металлами (Na, K, Mg, Al и др), образуя соли – алкоголяты (алкоксиды):
2R–OH + 2Na→ 2RO–Na+ + H22C2H5OH + 2K → 2C2H5O–K+ + H2
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла:
C2H5OК + H2O→ C2H5OH + КOH
Спирты – более слабые кислоты, чем вода, т.к. алкильный радикал, проявляя +I-эффект, повышает электронную плотность на атоме кислорода и уменьшает полярность связи О–Н. Поэтому при взаимодействии спиртов со щелочами алкоголяты практически не образуются:
(равновесие этой реакции сдвинуто влево,
т.к. соли спиртов в воде гидролизуются)Кроме того, спирты способны вытеснять углеводороды, которые можно рассматривать как еще более слабые кислоты, из их солей (например, из реактивов Гриньяра RMgHal):
R–OH + R’MgBr →R’H + Mg(OR)Br
Кислотность одноатомных спиртов убывает в ряду:
CH3OH > первичный > вторичный > третичный.
2. Образование сложных эфиров
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
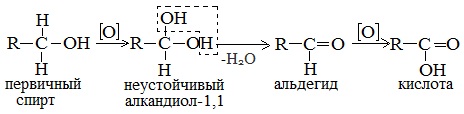
Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным.3. ОкислениеОкислители – KMnO4, K2Cr2O7+H2SO4, O2+катализатор. Легкость окисления спиртов уменьшается в ряду:первичные > вторичные > третичные.
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
При окислении вторичных спиртов образуются кетоны.Предельное окисление происходит при горении, например:2CH3OH + 3O2 → 2CO2 + 4H2O4. Реакции замещения ОН-группы
Замещение гидроксила ОН на галоген происходит в реакции спиртов с галогеноводородами в присутствии катализатора – сильной минеральной кислоты (например, конц. H2SO4). При этом спирты проявляют свойства слабых оснований.
Механизм реакции – нуклеофильное замещение SN.Нуклеофил – хлорид-анион Cl:– – замещает группу HO:–
Данная реакция является одним из способов получения галогеноуглеводородов.При межмолекулярной дегидратации спиртов также происходит нуклеофильное замещение: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы.
5. Реакции дегидратации спиртов
Отщепление воды от молекул спирта (дегидратация спиртов) в зависимости от условий происходит как внутримолекулярная илимежмолекулярная реакция.
Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при нагревании выше 140 °С.
Например:В тех случаях, когда возможны 2 направления реакции, например:
дегидратация идет преимущественно в направлении I, т.е. по правилу Зайцева – с образованием более замещенного алкена (водород отщепляется от менее гидрогенизированного атома углерода).
Межмолекулярная дегидратация спиртов происходит при температуре ниже 140 °С с образованием простых эфиров:
Источник
Химические свойства спиртов ROH определяются наличием полярных связей , и неподеленных электронных пар на атоме кислорода.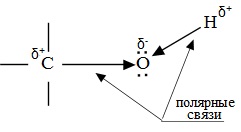 В химических реакциях спиртов возможно разрушение одной из двух связей: C–OH (с отщеплением гидроксильной группы)
В химических реакциях спиртов возможно разрушение одной из двух связей: C–OH (с отщеплением гидроксильной группы)
O–H (с отщеплением водорода)
Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления (элиминирования), когда образуется двойная связь.
Полярный характер связей С–О и О–Н способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму. При разрыве связи О–Н с отщеплением протона (Н+) проявляются кислотные свойства гидроксисоединения, а при разрыве связи С–О — свойства основания и нуклеофильного реагента.
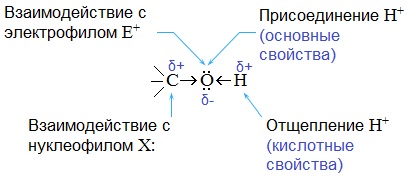
С разрывом связи О–Н идут реакции окисления, а по связи С–О – восстановления.
Различают два основных типа реакций спиртов с участием функциональной группы –ОН:
1) Реакции с разрывом связи О-Н:
а) взаимодействие спиртов со щелочными металлами с образованием алкоголятов;
б) реакции спиртов с органическими и минеральными кислотами с образованием сложных эфиров;
в) окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений.
2) Реакции сопровождающиеся разрывом связи С-О:
а) каталитическая дегидратация с образованием алкенов (внутримолекулярная дегидратация) или простых эфиров (межмолекулярная дегидратация);
б) замещение группы –ОН галогеном, например при действии галогеноводородов с образованием алкилгалогенидов.
Спирты – амфотерные соединения.
Реакции замещения
Кислотно-основные свойства Кислотные свойства уменьшаются в ряду, а основные возрастают:
Кислотные свойства
1. Взаимодействие со щелочными и щелочноземельными металлами (Li, Na, K, Ca, Ba, Sr)
Реакции с разрывом связи О-Н
При действии на спирты активных металлов в безводной среде атом водорода гидроксильной группы замещается на металл:
Образующиеся соединения (соли спиртов) называются алкоголятами — производные метилового спирта – метилатами, производные этилового спирта – этилатами.
Видеоопыт «Взаимодействие спиртов с металлическим натрием»
Алкоголяты химически не стабильны и при действии воды они полностью гидролизуются с образованием исходного спирта и щелочи:
Эта реакция показывает, что спирты по сравнению с водой являются более слабыми кислотами (сильная кислота вытесняет слабую). При взаимодействии с растворами щелочей спирты не образуют алкоголяты.
Спирты не взаимодействуют с водными растворами щелочей.
Основные свойства
2.Взаимодействие с галогенводородными кислотами
Реакции с разрывом связи С-О
Замещение гидроксила ОН на галоген происходит в реакции спиртов с галогеноводородами в присутствии катализатора – сильной минеральной кислоты (например, конц. H2SO4). При этом спирты проявляют свойства слабых оснований:
Видеоопыт «Взаимодействие этилового спирта с бромоводородом»
Реакции этерификации
Реакции с разрывом связи О-Н
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
Отличительной особенностью этой реакции является то, что атом Н отщепляется от спирта, а группа ОН – от кислоты:
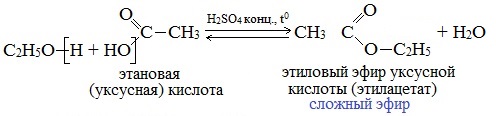
Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным.
Реакции отщепления
1. Дегидратация (отщепление воды)
Реакции с разрывом связи С-О
При действии на спирты водоотнимающих реагентов, например, концентрированной серной кислоты, происходит отщепление воды – дегидратация.
Она может протекать по двум направлениям: с участием одной молекулы спирта (внутримолекулярная дегидратация, приводящая к образованию алкенов) или с участием двух молекул спирта (межмолекулярная дегидратация, приводящая к получению простых эфиров).
При переходе от первичных спиртов к третичным увеличивается склонность к отщеплению воды и образованию алкенов и уменьшается способность образовывать простые эфиры.
а) Межмолекулярная дегидратация спиртов с образованием простых эфиров R-O-R’. Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов: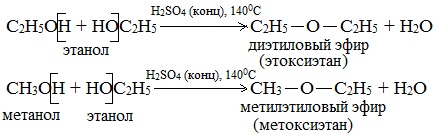
б) Внутримолекулярная дегидратация спиртов с образованием алкенов. Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта:
Такие реакции отщепления называются реакциями элиминирования.
Первый член гомологического ряда алканолов – метанол СН3ОН – не вступает в реакции внутримолекулярной дегидратации.
Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева:
2. Дегидрирование
Реакции с разрывом связей О-Н и С-Н
а) При дегидрировании первичных спиртов образуются альдегиды:
Реакция происходит при пропускании нагретых до 3000С паров спирта без доступа воздуха над металлическими катализаторами (Cu или металлы платиновой группы – Pd, Pt, Ni). Ni является типичным катализатором дегидрирования или гидрирования, т.е. отщепления или присоединения водорода.
В организме человека этот процесс происходит под действием (алкогольдегидрогеназы).
б) При дегидрировании вторичных спиртов образуются кетоны:
Третичные спирты не подвергаются дегидрированию.
Реакции окисления
Для спиртов характерны реакции горения с образованием углекислого газа и воды, а также реакции окисления, приводящие к получению альдегидов, кетонов и карбоновых кислот.
В лабораторных условиях для окисления спиртов обычно используют подкисленные растворы перманганата или дихромата калия, оксид меди и т.д.
1. Горение (полное окисление)
Спирты горят на воздухе с выделением большого количества тепла. С увеличением массы углеводородного радикала – пламя становится всё более коптящим.
Видеоопыт «Горение спиртов»
При сгорании спиртов выделяется большое количество тепла:
Благодаря высокой экзотермичности реакции горения этанола, он считается перспективным и экологически чистым заменителем бензинового топлива в двигателях внутреннего сгорания. В этом случае энергия химических связей переходит в тепловую энергию, а затем в механическую, что позволяет двигаться автомобилям. В лабораторной практике этанол применяется как горючее для «спиртовок».
2. Неполное окисление
1). В присутствии окислителей [O] – K2Cr2O7 или KMnO4 спирты окисляются до карбонильных соединений:
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
При окислении вторичных спиртов образуются кетоны.
Например:
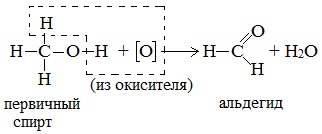
Видеоопыт «Окисление этилового спирта раствором перманганата калия»
Видеоопыт «Окисление этилового спирта кристаллическим перманганатом калия»
Видеоопыт «Каталитическое окисление этанола»
Видеоопыт «Окисление этанола (тест на алкоголь)»
Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой).
Качественные реакции на спирты
1. Окисление спиртов дихроматом (Na2Cr2O7) или перманганатом (КMnО4)
Качественная реакция на первичные и вторичные спирты!
В кислой среде
Окисление Na2Cr2O7
Для первичных и вторичных одноатомных спиртов качественной реакцией является взаимодействие их с раствором дихромата натрия. Для повышения скорости реакции ее проводят при нагревании, для создания кислой среды добавляют серную кислоту.
Первичные спирты окисляются дихроматом натрия до альдегидов.
Растворы дихроматов имеют оранжевый цвет и содержат хром в степени окисления +6. В кислой среде они переходят в растворы солей хрома в степени окисления +3 и приобретают зеленый цвет.
На изменении цвета соединений хрома также основана работа алкотестеров, когда пары спирта, содержащиеся в выдыхаемом водителем воздухе, восстанавливают дихромат в стеклянной трубочке.
Вторичные спирты окисляются дихроматом натрия до кетонов.
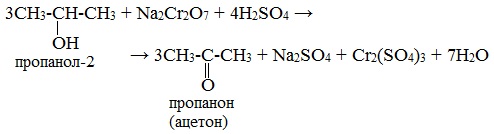
Третичные спирты в реакции с дихроматами не вступают.
Окисление KМnO4
Т.к. перманганат калия в кислой среде более сильный окислитель, чем дихромат, то окисление спирта не останавливается на стадии альдегида и продолжается дальше до карбоновой кислоты.
Раствор перманганата калия содержит марганец в степени окисления +7 и имеет розово-фиолетовый цвет. Если спирт взять в достаточном количестве, то произойдет обесцвечивание раствора. В кислой среде марганец перейдет в степень окисления +2.
Также как и дихроматом натрия, перманганатом калия вторичные спирты могут окисляться до кетонов. Далее возможна деструкция, т.е. разрушение органической молекулы и получение смеси веществ, которые не имеют практического применения.
В жёстких условиях с перманганатом калия третичные спирты окисляются с расщеплением связей С-С и образованием смеси веществ.
Метиловый спирт окисляется перманганатом калия до углекислого газа.
2. Окисление спиртов оксидом меди (II)
Качественная реакция на первичные спирты!
Первичные спирты окисляются оксидом меди (II) до альдегидов.
Видеоопыт «Окисление этилового спирта оксидом меди (II)»
Видеоопыт «Качественная реакция на этанол»
Вторичные спирты окисляются оксидом меди (II) до кетонов.
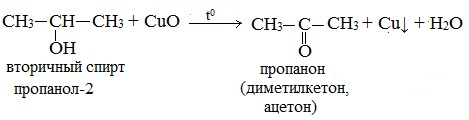
Третичные спирты оксидом меди (II) не окисляются.
Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования.
Предельные одноатомные спирты
Источник
Вещества, образованные от предельных углеводородов и содержащие гидроксильную группу (-ОН), называются насыщенными или предельными одноатомными спиртами. Названия спиртов совпадают с названиями алканов в гомологическом ряду с суффиксом «-ол».

Строение
Общая формула предельных одноатомных спиртов – CnH2n+1-OH. Гидроксил является функциональной группой и определяет физические и химические свойства спиртов.
Основные одноатомные спирты (гомологический ряд метанола):
- метанол или метиловый спирт – CH3OH;
- этанол или этиловый спирт – C2H5OH;
- пропанол – C3H7OH;
- бутанол – C4H9OH;
- пентанол – C5H11OH.
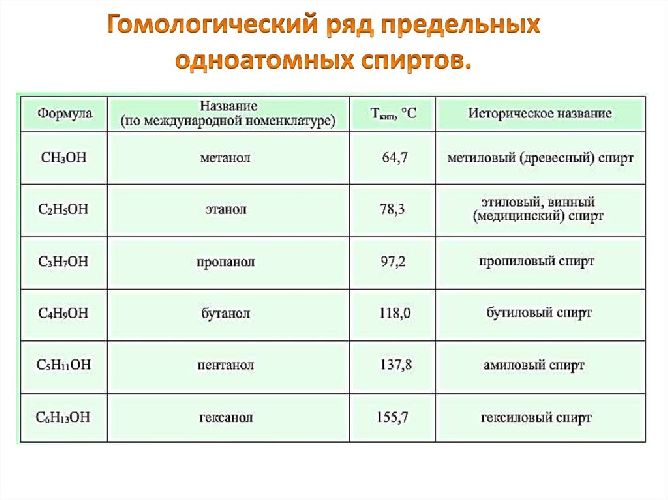
Рис. 1. Гомологический ряд одноатомных спиртов.
Насыщенным спиртам свойственна структурная и межклассовая изомерия. В зависимости от расположения гидроксильной группы в молекуле вещества различают:
- первичные спирты – гидроксил прикреплён к первому атому углерода;
- вторичные спирты – гидроксил находится у второго атома углерода;
- третичные спирты – гидроксил соединён с третьим атом углерода.
Начиная с бутанола, наблюдается изомерия углеродного скелета. В этом случае название спирта записывается с двумя цифрами: первая указывает на положение метильной группы, вторая – гидроксила.
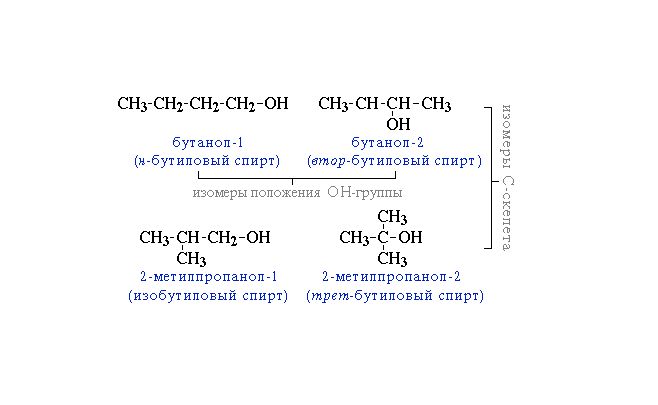
Рис. 2. Изомерия углеродного скелета насыщенных спиртов.
Одноатомные спирты образуют межклассовые изомеры с простыми эфирами – этиловый спирт (CH3CH2-OH), диметиловый эфир (CH3-O-CH3).
Несмотря на то, что пропанол содержит три атома углерода, он может образовывать только два изомера по гидроксильной группе – пропанол-1 и пропанол-2.
Свойства
В зависимости от количества атомов углерода меняется агрегатное состояние одноатомных спиртов. Если в молекуле до 15 атомов углерода, то это жидкость, больше 15 – твёрдое вещество. Хорошо смешиваются с водой первые два спирта из гомологического ряда – метанол и этанол, а также структурный изомер пропанол-2.
Все спирты плавятся и кипят при высоких температурах.
Активность спиртов объясняется наличием О-Н и С-О связей, которые легко разрываются. Основные химические свойства одноатомных спиртов приведены в таблице.
Реакция | Описание | Уравнение |
С металлами | Реагируют только со щелочными и щелочноземельными металлами с разрывом связи О-Н | 2C2H5OH + 2К → 2С2Н5ОК + Н2 |
С кислородом | Горят в присутствии перманганата или дихромата калия (KMnO4, K2Cr2O7) | C2H5OH + 3O2 → 2CO2 + H2O |
C галогеноводородами | Гидроксильная группа вытесняется галогеном | C2H5OH + HBr → C2H5Br + H2O |
С кислотами | Реагируют с минеральными и органическими кислотами с образованием сложных эфиров | C2H5OH + CH3COOH → CH3COOC2H5 |
С оксидами металлов | Качественная реакция с образование альдегида | C2H5OH + CuO → CH3COH + H2O + Cu |
Дегидратация | Протекает в присутствии сильной кислоты при высокой температуре | C2H5OH → C2H4 + H2O |
С карбоновыми кислотами | Реакция этерификации – образование сложных эфиров | C2H5OH + CH3COOH → CH3COOC2H5 + H2O |

Рис. 3. Качественная реакция одноатомных спиртов.
Одноатомные спирты имеют широкое применение в промышленности. Наиболее активно применяется этанол. Его используют для изготовления парфюмерии, уксусной кислоты, лекарств, лаков, красителей, растворителей и других веществ.
Что мы узнали?
Из урока химии узнали, что предельные или насыщенные одноатомные спирты являются производными предельных углеводородов с одной гидроксильной группой (гидроксилом). Это жидкости или твёрдые вещества в зависимости от количества атомов углерода. Одноатомные спирты образуют изомеры по гидроксильной, метильной группе и с простыми эфирами. Предельные одноатомные спирты реагируют со щелочными металлами, кислотами, оксидами. Используются для изготовления лекарств, растворителей, кислот.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
Средняя оценка: 4.6. Всего получено оценок: 204.
Источник
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов

Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
- слабые кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- отрыв воды (элиминирование) – дегидратация
- окисление
- образование сложных эфиров — этерификация
1. Кислотные свойства
Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды.
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому спирты не взаимодействуют с растворами щелочей.
Многоатомные спирты также не реагируют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
Например, этанол взаимодействует с калием с образованием этилата калия и водорода.
Видеоопыт взаимодействия спиртов (метанола, этанола и бутанола) с натрием можно посмотреть здесь.
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
Например, этилат калия разлагается водой:
CH3OH > первичные спирты > вторичные спирты > третичные спирты
Многоатомные спирты также реагируют с активными металлами:
Видеоопыт взаимодействия глицерина с натрием можно посмотреть здесь.
1.3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).
Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди:
Видеоопыт взаимодействия этиленгликоля с гидроксидом меди (II) можно посмотреть здесь.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
Например, этанол реагирует с бромоводородом.
Видеоопыт взаимодействия этилового спирта с бромоводородом можно посмотреть здесь.
третичные > вторичные > первичные > CH3OH.
Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами.
Например, этиленгликоль реагирует с бромоводородом:
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
Например, при взаимодействии этанола с аммиаком образуется этиламин.
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):
Многоатомные спирты вступают в реакции этерификации с органическими и неорганическими кислотами.
Например, этиленгликоль реагирует с уксусной кислотой с образованием ацетата этиленгликоля:
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат:
Например, глицерин под действием азотной кислоты образует тринитрат глицерина (тринитроглицерин):
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140оС) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен:
В качестве катализатора этой реакции также используют оксид алюминия.
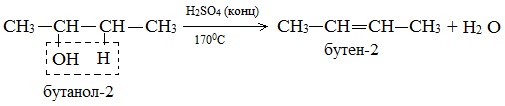
Отщепление воды от несимметричных спиртов проходит в соответствии с правилом Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
Например, в присутствии концентрированной серной кислоты при нагревании выше 140оС из бутанола-2 в основном образуется бутен-2:
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
Например, при дегидратации этанола при температуре до 140оС образуется диэтиловый эфир:
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Первичный спирт → альдегид → карбоновая кислота
Метанол → формальдегид → углекислый газ
Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол < первичные спирты < вторичные спирты < третичные спирты
Продукты окисления многоатомных спиртов зависят от их строения. При окислении оксидом меди многоатомные спирты образуют карбонильные соединения.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, этанол окисляется оксидом меди до уксусного альдегида
Видеоопыт окисления этанола оксидом меди (II) можно посмотреть здесь.
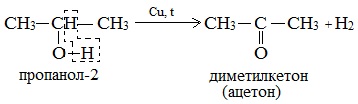
Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона
Третичные спирты окисляются только в жестких условиях.
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, при окислении пропанола-1 образуется пропаналь
Видеоопыт каталитического окисления этанола кислородом можно посмотреть здесь.
Например, пропанол-2 окисляется кислородом при нагревании в присутствии меди до ацетона
Третичные спирты окисляются только в жестких условиях.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот, вторичные спирты окисляются до кетонов, метанол окисляется до углекислого газа.
При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси.
Третичные спирты окисляются только в жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов. При этом происходит разрыв углеродной цепи и могут образоваться углекислый газ, карбоновая кислота или кетон, в зависимости от строения спирта.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Первичный спирт R-СН2-ОН | R-COOH/ R-CHO | R-COOK/ R-CHO |
| Вторичный спирт R1-СНОН-R2 | R1-СО-R2 | R1-СО-R2 |
Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ
Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота
Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
Например, уравнение сгорания метанола:
2CH3OH + 3O2 = 2CO2 + 4H2O
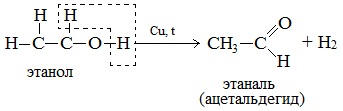
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола и первичных спиртов образуются альдегиды, при дегидрировании вторичных спиртов образуются кетоны.
Например, при дегидрировании этанола образуется этаналь
Например, при дегидрировании этиленгликоля образуется диальдегид (глиоксаль)
Источник

