Какие свойства предельных одноатомных спиртов
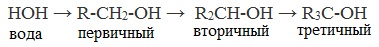
Химические свойства спиртов ROH определяются наличием полярных связей ![]() , и неподеленных электронных пар на атоме кислорода.
, и неподеленных электронных пар на атоме кислорода.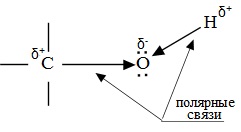 В химических реакциях спиртов возможно разрушение одной из двух связей: C–OH (с отщеплением гидроксильной группы)
В химических реакциях спиртов возможно разрушение одной из двух связей: C–OH (с отщеплением гидроксильной группы)
O–H (с отщеплением водорода)
Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления (элиминирования), когда образуется двойная связь.
Полярный характер связей С–О и О–Н способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму. При разрыве связи О–Н с отщеплением протона (Н+) проявляются кислотные свойства гидроксисоединения, а при разрыве связи С–О — свойства основания и нуклеофильного реагента.
С разрывом связи О–Н идут реакции окисления, а по связи С–О – восстановления.
Различают два основных типа реакций спиртов с участием функциональной группы –ОН:
1) Реакции с разрывом связи О-Н:
а) взаимодействие спиртов со щелочными металлами с образованием алкоголятов;
б) реакции спиртов с органическими и минеральными кислотами с образованием сложных эфиров;
в) окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений.
2) Реакции сопровождающиеся разрывом связи С-О:
а) каталитическая дегидратация с образованием алкенов (внутримолекулярная дегидратация) или простых эфиров (межмолекулярная дегидратация);
б) замещение группы –ОН галогеном, например при действии галогеноводородов с образованием алкилгалогенидов.
Спирты – амфотерные соединения.
Реакции замещения
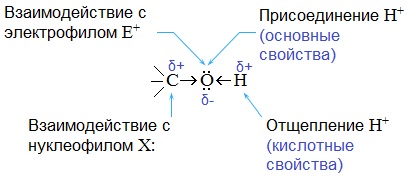
Кислотно-основные свойства 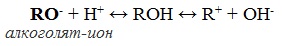 Кислотные свойства уменьшаются в ряду, а основные возрастают:
Кислотные свойства уменьшаются в ряду, а основные возрастают: 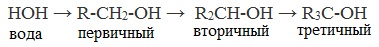
Кислотные свойства
1. Взаимодействие со щелочными и щелочноземельными металлами (Li, Na, K, Ca, Ba, Sr)
Реакции с разрывом связи О-Н
При действии на спирты активных металлов в безводной среде атом водорода гидроксильной группы замещается на металл:
![]()
Образующиеся соединения (соли спиртов) называются алкоголятами — производные метилового спирта – метилатами, производные этилового спирта – этилатами.
Видеоопыт «Взаимодействие спиртов с металлическим натрием»
Алкоголяты химически не стабильны и при действии воды они полностью гидролизуются с образованием исходного спирта и щелочи:
![]()
Эта реакция показывает, что спирты по сравнению с водой являются более слабыми кислотами (сильная кислота вытесняет слабую). При взаимодействии с растворами щелочей спирты не образуют алкоголяты.
![]()
Спирты не взаимодействуют с водными растворами щелочей.
Основные свойства
2.Взаимодействие с галогенводородными кислотами
Реакции с разрывом связи С-О
Замещение гидроксила ОН на галоген происходит в реакции спиртов с галогеноводородами в присутствии катализатора – сильной минеральной кислоты (например, конц. H2SO4). При этом спирты проявляют свойства слабых оснований:
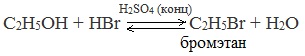
![]()
Видеоопыт «Взаимодействие этилового спирта с бромоводородом»
Реакции этерификации
Реакции с разрывом связи О-Н
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
Отличительной особенностью этой реакции является то, что атом Н отщепляется от спирта, а группа ОН – от кислоты:
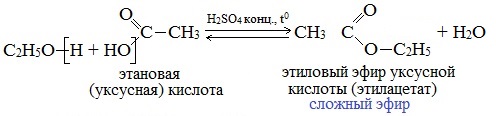
Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным.
Реакции отщепления
1. Дегидратация (отщепление воды)
Реакции с разрывом связи С-О
При действии на спирты водоотнимающих реагентов, например, концентрированной серной кислоты, происходит отщепление воды – дегидратация.
Она может протекать по двум направлениям: с участием одной молекулы спирта (внутримолекулярная дегидратация, приводящая к образованию алкенов) или с участием двух молекул спирта (межмолекулярная дегидратация, приводящая к получению простых эфиров).
При переходе от первичных спиртов к третичным увеличивается склонность к отщеплению воды и образованию алкенов и уменьшается способность образовывать простые эфиры.
а) Межмолекулярная дегидратация спиртов с образованием простых эфиров R-O-R’. Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов: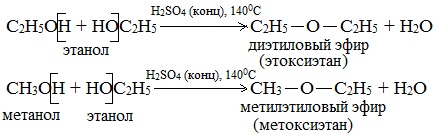
б) Внутримолекулярная дегидратация спиртов с образованием алкенов. Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта:
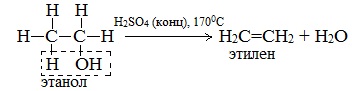
Такие реакции отщепления называются реакциями элиминирования.
Первый член гомологического ряда алканолов – метанол СН3ОН – не вступает в реакции внутримолекулярной дегидратации.
Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева:
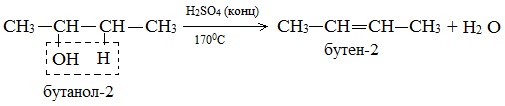
2. Дегидрирование
Реакции с разрывом связей О-Н и С-Н
а) При дегидрировании первичных спиртов образуются альдегиды:
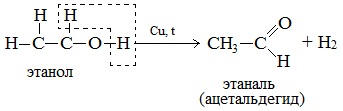
Реакция происходит при пропускании нагретых до 3000С паров спирта без доступа воздуха над металлическими катализаторами (Cu или металлы платиновой группы – Pd, Pt, Ni). Ni является типичным катализатором дегидрирования или гидрирования, т.е. отщепления или присоединения водорода.
В организме человека этот процесс происходит под действием (алкогольдегидрогеназы).
б) При дегидрировании вторичных спиртов образуются кетоны:
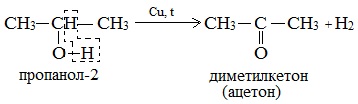
Третичные спирты не подвергаются дегидрированию.
Реакции окисления
Для спиртов характерны реакции горения с образованием углекислого газа и воды, а также реакции окисления, приводящие к получению альдегидов, кетонов и карбоновых кислот.
В лабораторных условиях для окисления спиртов обычно используют подкисленные растворы перманганата или дихромата калия, оксид меди и т.д.
1. Горение (полное окисление)
Спирты горят на воздухе с выделением большого количества тепла. С увеличением массы углеводородного радикала – пламя становится всё более коптящим.
Видеоопыт «Горение спиртов»
![]()
При сгорании спиртов выделяется большое количество тепла:
![]()
Благодаря высокой экзотермичности реакции горения этанола, он считается перспективным и экологически чистым заменителем бензинового топлива в двигателях внутреннего сгорания. В этом случае энергия химических связей переходит в тепловую энергию, а затем в механическую, что позволяет двигаться автомобилям. В лабораторной практике этанол применяется как горючее для «спиртовок».
2. Неполное окисление
1). В присутствии окислителей [O] – K2Cr2O7 или KMnO4 спирты окисляются до карбонильных соединений:
![]()
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
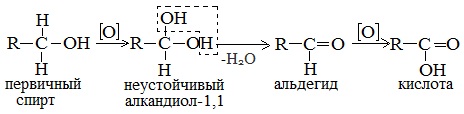
При окислении вторичных спиртов образуются кетоны.
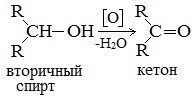
Например:
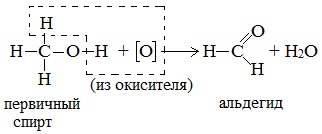
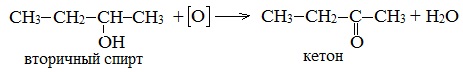
Видеоопыт «Окисление этилового спирта раствором перманганата калия»
Видеоопыт «Окисление этилового спирта кристаллическим перманганатом калия»
Видеоопыт «Каталитическое окисление этанола»
Видеоопыт «Окисление этанола (тест на алкоголь)»
Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой).
Качественные реакции на спирты
1. Окисление спиртов дихроматом (Na2Cr2O7) или перманганатом (КMnО4)
Качественная реакция на первичные и вторичные спирты!
В кислой среде
Окисление Na2Cr2O7
Для первичных и вторичных одноатомных спиртов качественной реакцией является взаимодействие их с раствором дихромата натрия. Для повышения скорости реакции ее проводят при нагревании, для создания кислой среды добавляют серную кислоту.
Первичные спирты окисляются дихроматом натрия до альдегидов.
Растворы дихроматов имеют оранжевый цвет и содержат хром в степени окисления +6. В кислой среде они переходят в растворы солей хрома в степени окисления +3 и приобретают зеленый цвет.
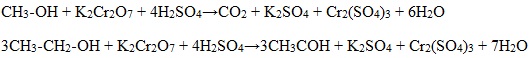
На изменении цвета соединений хрома также основана работа алкотестеров, когда пары спирта, содержащиеся в выдыхаемом водителем воздухе, восстанавливают дихромат в стеклянной трубочке.
Вторичные спирты окисляются дихроматом натрия до кетонов.
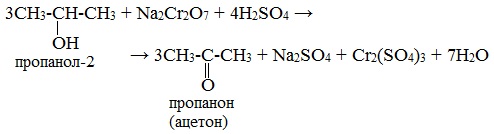
Третичные спирты в реакции с дихроматами не вступают.
Окисление KМnO4
Т.к. перманганат калия в кислой среде более сильный окислитель, чем дихромат, то окисление спирта не останавливается на стадии альдегида и продолжается дальше до карбоновой кислоты.

Раствор перманганата калия содержит марганец в степени окисления +7 и имеет розово-фиолетовый цвет. Если спирт взять в достаточном количестве, то произойдет обесцвечивание раствора. В кислой среде марганец перейдет в степень окисления +2.
Также как и дихроматом натрия, перманганатом калия вторичные спирты могут окисляться до кетонов. Далее возможна деструкция, т.е. разрушение органической молекулы и получение смеси веществ, которые не имеют практического применения.
В жёстких условиях с перманганатом калия третичные спирты окисляются с расщеплением связей С-С и образованием смеси веществ.
Метиловый спирт окисляется перманганатом калия до углекислого газа.
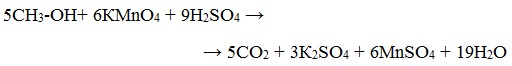
2. Окисление спиртов оксидом меди (II)
Качественная реакция на первичные спирты!
Первичные спирты окисляются оксидом меди (II) до альдегидов.
Видеоопыт «Окисление этилового спирта оксидом меди (II)»
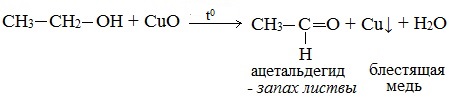
Видеоопыт «Качественная реакция на этанол»
Вторичные спирты окисляются оксидом меди (II) до кетонов.
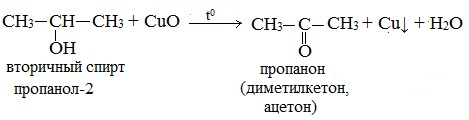
Третичные спирты оксидом меди (II) не окисляются.
Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования.
Предельные одноатомные спирты
Источник
Вещества, образованные от предельных углеводородов и содержащие гидроксильную группу (-ОН), называются насыщенными или предельными одноатомными спиртами. Названия спиртов совпадают с названиями алканов в гомологическом ряду с суффиксом «-ол».

Строение
Общая формула предельных одноатомных спиртов – CnH2n+1-OH. Гидроксил является функциональной группой и определяет физические и химические свойства спиртов.
Основные одноатомные спирты (гомологический ряд метанола):
- метанол или метиловый спирт – CH3OH;
- этанол или этиловый спирт – C2H5OH;
- пропанол – C3H7OH;
- бутанол – C4H9OH;
- пентанол – C5H11OH.
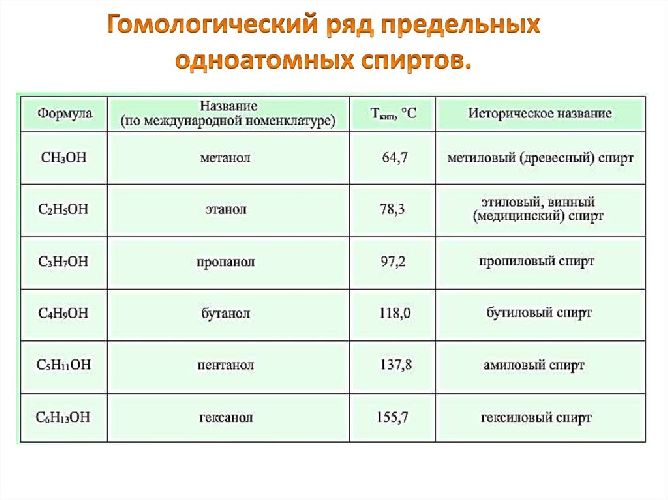
Рис. 1. Гомологический ряд одноатомных спиртов.
Насыщенным спиртам свойственна структурная и межклассовая изомерия. В зависимости от расположения гидроксильной группы в молекуле вещества различают:
- первичные спирты – гидроксил прикреплён к первому атому углерода;
- вторичные спирты – гидроксил находится у второго атома углерода;
- третичные спирты – гидроксил соединён с третьим атом углерода.
Начиная с бутанола, наблюдается изомерия углеродного скелета. В этом случае название спирта записывается с двумя цифрами: первая указывает на положение метильной группы, вторая – гидроксила.
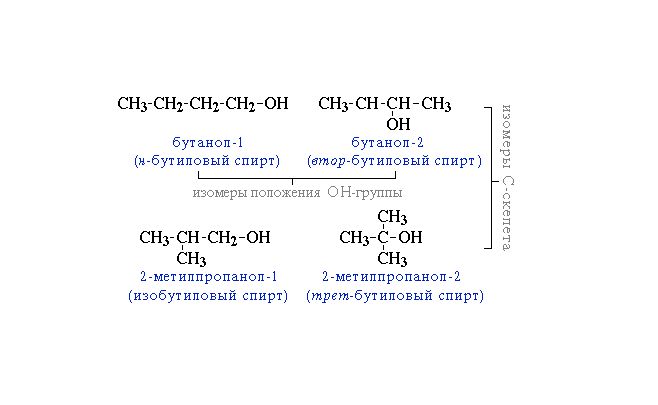
Рис. 2. Изомерия углеродного скелета насыщенных спиртов.
Одноатомные спирты образуют межклассовые изомеры с простыми эфирами – этиловый спирт (CH3CH2-OH), диметиловый эфир (CH3-O-CH3).
Несмотря на то, что пропанол содержит три атома углерода, он может образовывать только два изомера по гидроксильной группе – пропанол-1 и пропанол-2.
Свойства
В зависимости от количества атомов углерода меняется агрегатное состояние одноатомных спиртов. Если в молекуле до 15 атомов углерода, то это жидкость, больше 15 – твёрдое вещество. Хорошо смешиваются с водой первые два спирта из гомологического ряда – метанол и этанол, а также структурный изомер пропанол-2.
Все спирты плавятся и кипят при высоких температурах.
Активность спиртов объясняется наличием О-Н и С-О связей, которые легко разрываются. Основные химические свойства одноатомных спиртов приведены в таблице.
Реакция | Описание | Уравнение |
С металлами | Реагируют только со щелочными и щелочноземельными металлами с разрывом связи О-Н | 2C2H5OH + 2К → 2С2Н5ОК + Н2 |
С кислородом | Горят в присутствии перманганата или дихромата калия (KMnO4, K2Cr2O7) | C2H5OH + 3O2 → 2CO2 + H2O |
C галогеноводородами | Гидроксильная группа вытесняется галогеном | C2H5OH + HBr → C2H5Br + H2O |
С кислотами | Реагируют с минеральными и органическими кислотами с образованием сложных эфиров | C2H5OH + CH3COOH → CH3COOC2H5 |
С оксидами металлов | Качественная реакция с образование альдегида | C2H5OH + CuO → CH3COH + H2O + Cu |
Дегидратация | Протекает в присутствии сильной кислоты при высокой температуре | C2H5OH → C2H4 + H2O |
С карбоновыми кислотами | Реакция этерификации – образование сложных эфиров | C2H5OH + CH3COOH → CH3COOC2H5 + H2O |

Рис. 3. Качественная реакция одноатомных спиртов.
Одноатомные спирты имеют широкое применение в промышленности. Наиболее активно применяется этанол. Его используют для изготовления парфюмерии, уксусной кислоты, лекарств, лаков, красителей, растворителей и других веществ.
Что мы узнали?
Из урока химии узнали, что предельные или насыщенные одноатомные спирты являются производными предельных углеводородов с одной гидроксильной группой (гидроксилом). Это жидкости или твёрдые вещества в зависимости от количества атомов углерода. Одноатомные спирты образуют изомеры по гидроксильной, метильной группе и с простыми эфирами. Предельные одноатомные спирты реагируют со щелочными металлами, кислотами, оксидами. Используются для изготовления лекарств, растворителей, кислот.
Тест по теме
Оценка доклада
Средняя оценка: 4.6. Всего получено оценок: 193.
Источник
Одноатомные спирты (алкоголи) – это производные алканов, молекула которых имеет одну функциональную гидроксильную группу. Она связана с насыщенным атомом углерода.
В учебниках химии можно встретить определение спиртов – это обширный класс химических соединений, выполняющих важнейшие функции в живых организмах. Рассматриваемые вещества широко применяются в промышленном производстве и повседневной жизни.
Описание и общая формула одноатомных спиртов
В таких спиртах атом водорода замещается гидроксильной группой ОН. Они имеют формулу CnH2n+1OH.
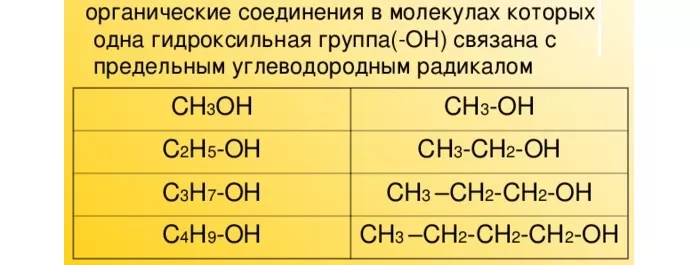
В современной номенклатуре их названия связаны с гомологическим рядом предельных алканов с суффиксом –ол (этанол, пропанол, бутанол, пропанол, гексанол и проч).
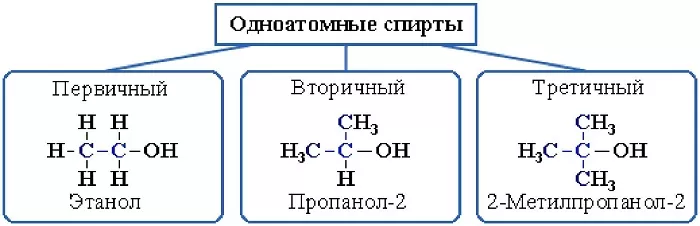
В зависимости от размещения группы ОН, существует классификация алкоголей:
первичные –группа ОН присоединена к первому атому С;
вторичные – гидроксильная группа присоединена ко второму атому этого элемента;
третичные – группа ОН присоединена к третьему атому углерода.
Изомерия одноатомных спиртов
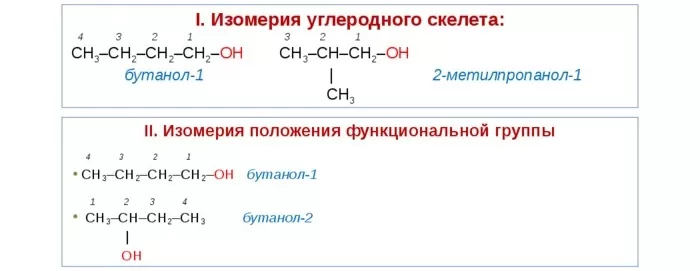
Для этих веществ характерны разные виды изомерии:
Структурная – изменение расположения ОН начиная с соединений, содержащих 3 атома углерода. Так, существует пропанол 1 (н-пропиловый) и пропанол-2 (изопропиловый).
Изомерия углеродного звена – изменение положения гидроксильной группы, начиная с веществ, молекула которых содержит 4 углеродных атома. Так, бутанолу соответствует четыре разных изомера.
Межклассовая изомерия (с эфирами). Этиловому алкоголю с формулой СН3CH2–OH соответствует диметиловый эфир CH3–O–CH3.
Пространственная, или зеркальная изомерия.
Физические свойства
Вещества с количеством атомов углерода до 15 являются летучими жидкостями с резким запахом. Соединения с числом атомов углерода свыше 15 являются твердыми веществами.

Начальный член гомологического ряда (метанол) чрезвычайно токсичен для человека.
Чем выше спирт, тем и выше его температура кипения. Различия между каждым членом гомологического ряда составляет примерно 20 градусов. По мере увеличения размера молекулы и ее массы снижается и их воспламеняемость. Следовательно, легче всех воспламеняется метанол.
Соединения, имеющие в составе молекулы 9 атомов углерода, растворяются в воде (метанол и этанол – в каком угодно соотношении). Хорошо растворяются в растворителях.
Химические свойства
Рассматриваемые вещества ведут себя и как основания, и как кислоты.
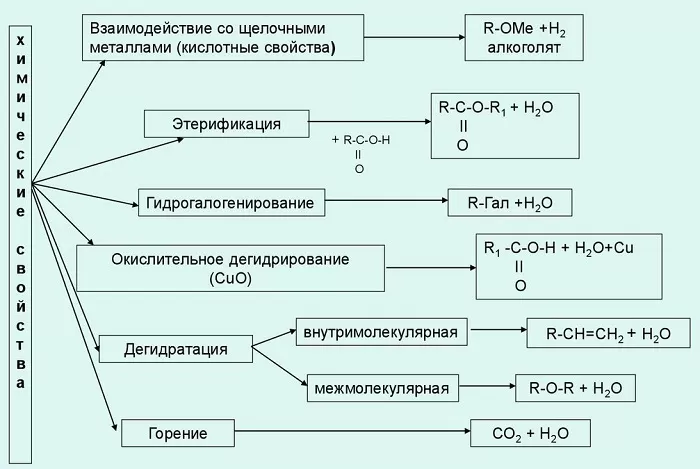
Основные химические свойства одноатомных спиртов:
Взаимодействие с щелочными металлами. При этом образуются алкоголяты или алкоксиды. В воде эти вещества подвергаются гидролизу, образуя спирт и основание.
Взаимодействие с кислотами (органическими и неорганическими). По-другому они называются реакциями этерификации, поскольку конечный их продукт – сложный эфир.
Реакция с хлористым тионилом дает в итоге галогеналкан.
В результате внутримолекулярного обезвоживания получают алкены.
При межмолекулярной дегидратации образуются простые эфиры.
Химическая реакция одноатомного алкоголя с перманганатом калия дает альдегид. Дальнейшим окислением альдегида можно получить одноатомную карбоновую кислоту.
Получение

Известно несколько методов получения простых спиртов:
1. Гидратация алкенов (с присоединением молекулы воды):
CH2 = CH2 + H2O → CH3CH2OH.
2. Гидролиз алкилгалогенидов (с добавлением водных растворов щелочей):
CH3CH2Сl + NaOH → CH3CH2OH + NaCl.
3. Восстановление кетонов:
CH3-C(O)-CH3 + Н2
→ CH3-CH(CH)-CH3.
4. Этанол получают путем разложения глюкозы:
C6H12O6 → 2C2H5OH + 2CO2.
5. Восстановление карбоновых кислот и сложных эфиров.
6. Присоединение металлорганических химических соединений к кетонам и альдегидам.
Применение одноатомных спиртов
Одноатомные спирты широко применяются как исходный реагент для получения альдегидов, кетонов, карбоновых кислот и эфиров. Все эти вещества широко применяются в производстве и быту.

Вот примеры использования наиболее распространенных спиртов:
Метанол является прекрасным органическим растворителем. Его применяют в производстве лаков и красок, органических смол.
Этанол широко используется в медицине как антисептик и растворитель. В пищевой промышленности его используют для получения алкогольных напитков. Он является основой для получения сложных эфиров, уксуса.
Бутанол применяется как растворитель и основа для получения веществ с приятным ароматом.
Бензиловый спирт является основой для получения душистых веществ.
Рассмотренные в статье вещества имеют широкое применение в промышленности. Без них невозможно получение многих веществ, использующихся в быту.
Источник
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов

Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
- слабые кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- отрыв воды (элиминирование) – дегидратация
- окисление
- образование сложных эфиров — этерификация
1. Кислотные свойства
Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды.
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
![]()
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому спирты не взаимодействуют с растворами щелочей.
Многоатомные спирты также не реагируют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
![]()
Например, этанол взаимодействует с калием с образованием этилата калия и водорода.
![]()
Видеоопыт взаимодействия спиртов (метанола, этанола и бутанола) с натрием можно посмотреть здесь.
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
Например, этилат калия разлагается водой:
CH3OH > первичные спирты > вторичные спирты > третичные спирты
Многоатомные спирты также реагируют с активными металлами:

Видеоопыт взаимодействия глицерина с натрием можно посмотреть здесь.
1.3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).
Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди:
Видеоопыт взаимодействия этиленгликоля с гидроксидом меди (II) можно посмотреть здесь.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и об

