Какие свойства окислителя или восстановителя проявляет сера

Сера
Элемент сера 16S, как и кислород 8О, находится в главной подгруппе VI группы периодической системы элементов. Однако химия серы существенно отличается от химии кислорода. Это обусловлено следующими причинами:
1. В отличие от кислорода сера проявляет и окислительные, и восстановительные свойства.
2. В отличие от кислорода, имеющего постоянную валентность II и степень окисления в соединениях -2, сера – элемент с переменной валентностью и с переменной степенью окисления.
Характеристика элемента
16S1s22s22p63s23p4
Аr = 32,066
ЭО – 2,5
Изотопы: 32S (95,084 %); 34S (4,16 %); 33S и 36S (
Кларк в земной коре 0,05 % по массе. Формы нахождения:
1) самородная сера (свободная S);
2) S2- (H2S и сульфиды металлов);
3) S+6 (сульфаты Ва и Са);
4) в составе белков, витаминов.
Сера – типичный неметалл, р-элемент. Устойчивые С.О. в соединениях -2, +4, +6.
Отличительное свойство – способность образовывать прочные гомоатомные связи-S-S-S- что приводит к существованию линейных и циклических цепей.
Важнейшие S-содержащие вещества
S-2 | S0 | S+4 | S+6 |
восстановители | окислительно – восстановительная двойственность | окислители | |
H2S сероводород CS2 – сероуглерод | S, свободная сера, большое число аллотропов | SO2 сернистый ангидрид | SO3 |
Свободная сера
Аллотропные модификации серы: ромбическая – S8. Твердое кристаллическое вещество ли монно-желтого цвета; нерастворимо в воде, хорошо растворимо в сероуглероде, ацетоне, бензоле.
Моноклинная – S8. Существует при температуре около 950С. Отличается от ромбической взаимной ориентацией октаэдров в кристаллической решетке.
Пластическая. Длинные зигзагообразные цепи.
Получение серы
1. Извлечение самородной серы из ее месторождений
2. Переработка природных газов, содержащих H2S (окисление при недостатке О2).
3. В лаборатории серу получают взаимодействием SО2 и H2S в водном растворе:
SО2 + 2H2S = 3S↓ + 2H2О
Химические свойства серы
При обычной температуре твердофазная сера малореакционноспособна. Однако при нагревании, и особенно в расплавленном состоянии, сера ведет себя как очень химически активное вещество
Сера – окислитель:
S + 2e- = S2-
Для завершения октета на внешнем слое атомы серы принимают недостающие 2 электрона и в состоянии S2- образуют ионные и ковалентные связи с водородом, металлами и некоторыми неметаллами.
1) Сера непосредственно соединяется с большинством Me (кроме Pt, Au), образуя сульфиды. С некоторыми Me реакция протекает при обычной температуре, например:
S + Сu = CuS
S + 2Ag = Ag2S
S + Hg = HgS
С железом и многими другими Me сера реагирует при нагревании:
S + Fe = FeS
S + Н2 = H2S сероводород
2S + С = CS2 сероуглерод
3S + 2Р = P2S3 сульфид фосфора (III)
Сера – восстановитель:
S – 4e- = S+4; S – 6e- = S+6
В соединениях с более ЭО элементами атомы серы находятся в положительно заряженном состоянии.
Непосредственно сера не взаимодействует с азотом и йодом.
Практически важными являются реакции соединения серы с кислородом. При обычных условиях сера горит на воздухе, окисляясь кислородом до диоксида серы:
S + O2 = SO2
Высший оксид SO3 образуется при окислении серы или SO2 кислородом в присутствии катализаторов:
2S + 3O2 = 2SO3 триоксид серы (оксид серы (VI)).
Сера непосредственно соединяется с фтором (при обычной температуре) и с хлором (расплавленная сера):
S + 3F2 = SF6 гексафторид серы
2S + Cl2 = S2CI2 дитиодихлорид серы
S2Cl2 + Cl2 = 2SCI2 дихлорид серы
Сильные окислители (HNO3, H2SO4 конц., К2Сr2O7 и др.) окисляют свободную серу до SO2 или H2SO4:
S + 2HNO3(разб.) = H2SO4 + 2NO↑
S + 6HNO3(конц.) = H2SO4 + 6NO2↑ + 2Н2O
S + 2H2SO4(конц.) = 3SO2↑ + 2Н2O
S + К2Сr2O7 = Сr2O3 + K2SO4
Диспропорционирование серы в растворах щелочей
3S+ 6NaOH = 2Na2S + Na2SO3 + 3Н2O
Источник
Сера – элемент VIa группы 3 периода периодической таблицы Д.И. Менделеева. Относится к
группе халькогенов – элементов VIa группы.
Сера – S – простое вещество имеет светло-желтый цвет. Использовалась еще до нашей эры в составе священных курений при
религиозных обрядах.

Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных
электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.

Природные соединения
- FeS2 – пирит, колчедан
- ZnS – цинковая обманка
- PbS – свинцовый блеск (галенит), Sb2S3 – сурьмяный блеск, Bi2S3 – висмутовый блеск
- HgS – киноварь
- CuFeS2 – халькопирит
- Cu2S – халькозин
- CuS – ковеллин
- BaSO4 – барит, тяжелый шпат
- CaSO4 – гипс
В местах вулканической активности встречаются залежи самородной серы.

Получение
В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S,
SO2.
H2S + O2 = S + H2O (недостаток кислорода)
SO2 + C = (t) S + CO2
Серу можно получить разложением пирита
FeS2 = (t) FeS + S
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
H2S + H2SO4 = S + H2O
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
На воздухе сера окисляется, образуя сернистый газ – SO2. Реагирует со многими неметаллами, без нагревания –
только со фтором.
S + O2 = (t) SO2
S + F2 = SF6
S + Cl2 = (t) SCl2
S + C = (t) CS2

При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
K + S = (t) K2S
Al + S = (t) Al2S3
Fe + S = (t) FeS
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
S + H2SO4 = (t) SO2 + H2O
S + HNO3 = (t) H2SO4 + NO2 + H2O
Сера вступает в реакции диспропорционирования с щелочами.
S + KOH = (t) K2S + K2SO3 + H2O
Сера вступает в реакции с солями. Например, в кипящем водном растворе сера может реагировать с сульфитами с образованием тиосульфатов.
Na2SO3 + S → (t) Na2S2O3

Сероводород – H2S
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные
ванны).

Получение
Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.
Al2S3 + H2O = (t) Al(OH)3↓ + H2S↑
FeS + HCl = FeCl2 + H2S↑

Химические свойства
- Кислотные свойства
- Восстановительные свойства
- Качественная реакция
Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит
от соотношения основания и кислоты).
MgO + H2S = (t) MgS + H2O
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
2KOH + H2S = K2S + 2H2O
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Ca + H2S = (t) CaS + H2
Сероводород – сильный восстановитель (сера в минимальной степени окисления S2-). Горит в кислороде синим пламенем, реагирует с кислотами.
H2S + O2 = H2O + S (недостаток кислорода)
H2S + O2 = H2O + SO2 (избыток кислорода)
H2S + HClO3 = H2SO4 + HCl

Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
H2S + Pb(NO3)2 = PbS↓ + HNO3
Оксид серы – SO2
Сернистый газ – SO2 – при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся
спички).

Получение
В промышленных условиях сернистый газ получают обжигом пирита.
FeS2 + O2 = (t) FeO + SO2
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота,
распадающаяся на сернистый газ и воду.
K2SO3 + H2SO4 = (t) K2SO4 + H2O + SO2↑
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2 + H2O
- Кислотные свойства
- Восстановительные свойства
- Как окислитель
С основными оксидами, основаниями образует соли сернистой кислоты – сульфиты.
K2O + SO2 = K2SO3
NaOH + SO2 = NaHSO3
2NaOH + SO2 = Na2SO3 + H2O

Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
Fe2(SO4)3 + SO2 + H2O = FeSO4 + H2SO4
SO2 + O2 = (t, кат. – Pt) SO3
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
CO + SO2 = CO2 + S
H2S + SO2 = S + H2O
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Получение
SO2 + H2O ⇄ H2SO3
Химические свойства
- Диссоциация
- Кислотные свойства
- Окислительные свойства
- Восстановительные свойства
Диссоциирует в водном растворе ступенчато.
H2SO3 = H+ + HSO3-
HSO3- = H+ + SO32-
В реакциях с основными оксидами, основаниями образует соли – сульфиты и гидросульфиты.
CaO + H2SO3 = CaSO3 + H2O
H2SO3 + 2KOH = 2H2O + K2SO3 (соотношение кислота – основание, 1:2)
H2SO3 + KOH = H2O + KHSO3 (соотношение кислота – основание, 1:1)
С сильными восстановителями сернистая кислота принимает роль окислителя.
H2SO3 + H2S = S↓ + H 2O
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.
H2SO3 + Br2 = H2SO4 + HBr

Оксид серы VI – SO3
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
Получение
В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора
(оксид ванадия – Pr, V2O5).
SO2 + O2 = (кат) SO3
В лабораторных условиях разложением солей серной кислоты – сульфатов.
Fe2(SO4)3 = (t) SO3 + Fe2O3
Химические свойства
- Кислотные свойства
- Окислительные свойства
Является кислотным оксидом, соответствует серной кислоте. При реакции с основными оксидами и основаниями образует ее соли – сульфаты и
гидросульфаты. Реагирует с водой с образованием серной кислоты.
SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке – средняя соль)
SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке – кислая соль)
SO3 + Ca(OH)2 = CaSO4 + H2O

SO3 + Li2O = Li2SO4
SO3 + H2O = H2SO4
SO3 – сильный окислитель. Чаще всего восстанавливается до SO2.
SO3 + P = SO2 + P2O5
SO3 + H2S = SO2 + H2O
SO3 + KI = SO2 + I2 + K2SO4

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник

Строение атома и свойства серы
Сера — элемент шестой группы третьего периода периодической системы Менделеева. Поэтому строение атома серы изображается так:
Строение атома серы указывает на то, что это неметалл, т. е. атом серы способен и к приёму электронов и к отдаче электронов:
Задание 15.1. Составить формулы соединений серы, содержащие атомы серы с данными степенями окисления.
Простое вещество «сера» — твёрдый хрупкий минерал жёлтого цвета, нерастворимый в воде. В природе встречается как самородная сера, так и её соединения: сульфиды, сульфаты. Сера как активный неметалл легко реагирует с водородом, кислородом, почти со всеми металлами и неметаллами:
Задание 15.2. Назовите полученные соединения. Определите, какие свойства (окислителя или восстановителя) проявляет сера в этих реакциях.
Как типичный неметалл простое вещество сера может быть и окислителем, и восстановителем:
Иногда эти свойства проявляются в одной реакции:
Поскольку атом-окислитель и атом-восстановитель одинаковые, их можно «сложить», т. е. на оба процесса нужно три атома серы.
Задание 15.3. Расставьте остальные коэффициенты в этом уравнении.
Сера может реагировать с кислотами — сильными окислителями:
Таким образом, являясь активным неметаллом, сера образует множество соединений. Рассмотрим свойства сероводорода, оксидов серы и их производных.
Сероводород
H2S — сероводород, сильно ядовитый газ с противным запахом тухлых яиц. Правильнее сказать, белки яиц при гниении разлагаются, выделяя сероводород.
Задание 15.4. Исходя из степени окисления атома серы в сероводороде, предcкажите, какие свойства будет проявлять этот атом в окислительно-восстановительных реакциях.
Поскольку сероводород — восстановитель (атом серы имеет низшую степень окисления), он легко окисляется. Кислород воздуха окисляет сероводород даже при комнатной температуре:
Сероводород горит:
Сероводород немного растворим в воде, причём его раствор проявляет свойства очень слабой кислоты (сероводородной H2S). Она образует соли сульфиды:
Вопрос. Как, имея сульфид, получить сероводород?
Сероводород в лабораториях получают, действуя на сульфиды более сильными (чем H2S) кислотами, например:
Сернистый газ и сернистая кислота
SO2— сернистый газ с резким удушливым запахом. Ядовит. Растворяется в воде, образуя сернистую кислоту:
Эта кислота средней силы, но очень неустойчива, существует только в растворах. Поэтому при действии на её соли — сульфиты — другими кислотами можно получить сернистый газ:
При кипячении полученного раствора эта кислота разлагается полностью.
Задание 15.5. Определите степень окисления серы в сернистом газе, сернистой кислоте, сульфите натрия.
Поскольку степень окисления +4 для серы является промежуточной, все перечисленные соединения могут быть и окислителями и восстановителями:
Например:
Задание 15.6. Расставьте коэффициенты в этих схемах методом электронного баланса. Укажите, какие свойства проявляет атом серы со степенью окисления +4 в каждой из реакций.
Восстановительные свойства сернистого газа применяются на практике. Так, при восстановлении теряют цвет некоторые органические соединения, поэтому оксид серы IV и сульфиты применяют при отбеливании. Сульфит натрия, растворённый в воде, замедляет коррозию труб, так как легко поглощает кислород из воды, а именно кислород является «виновником» коррозии:
Окисляясь в присутствии катализатора, сернистый газ превращается в серный ангидрид SO3:
Серный ангидрид и серная кислота
Серный ангидрид SO3 — бесцветная жидкость, бурно реагирующая с водой:
Серная кислота H2SO4 — сильная кислота, которая в концентрированном виде активно поглощает влагу из воздуха (это свойство применяется при осушении различных газов) и из некоторых сложных веществ:
Кроме того, концентрированная серная кислота, являясь сильным окислителем, окисляет углерод:
Поэтому, попадая на кожу, концентрированная серная кислота вызывает тяжёлые ожоги, а попадая на ткани, бумагу и другие вещества, обугливает их.
Являясь окислителем (+6 — высшая степень окисления для серы!), концентрированная серная кислота реагирует почти со всеми металлами (кроме железа и благородных металлов) без выделения водорода:
Задание 15.7. Уравняйте эти схемы методом электронного баланса. Укажите, какой атом является окислителем в каждом случае.
Но разбавленная серная кислота и её соли — сульфаты — окислительных свойств (за счёт атома серы) практически не проявляют:
Задание 15.8. Определите, какой атом является окислителем в данной реакции.
Растворы серной кислоты проявляют все свойства сильных кислот.
Задание 15.9. Составьте уравнения реакций, отражающие эти свойства. (При затруднении см. урок 2.2.)
Качественной реакцией на SO42– является образование белого осадка BaSO4, нерастворимого в кислотах:
Серная кислота имеет разнообразное применение: её используют при получении стиральных порошков, лекарств, красителей, удобрений и других необходимых веществ.
Выводы
Изложенное выше можно отразить в шутливом стишке: «Сера, сера, буква S, 32 атомный вес, сера в воздухе горит, образует ангидрид (какой кислоты?), ангидрид плюс вода — получилась кислота (какая?)».
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Источник
Тема урока: «Сера».
Цели урока:
- Охарактеризовать серу в свете трёх форм
существования этого химического элемента: в
форме атомов, простого вещества, а следовательно,
и её аллотропию, а также формы некоторых
соединений серы. - Химические свойства серы рассмотреть в свете
окислительно-восстановительных реакций. - Закрепить навыки работы на электронной доске (слайд
2).
План урока:
- Повторение строения и свойств кислорода
- Строение, свойства серы в сравнении с
кислородом и на основании положения в ПСХЭ Д.И.
Менделеева. - Сера – простое вещество.
- Физические свойства серы. Аллотропные
видоизменения серы. - Химические свойства серы (слайд 3).
I. Показываем на экране элементы 6
группы главной подгруппы. (Электронный учебник
«Общая и неорганическая химия 10–11 классы»)
II. Беседа с классом по следующим
вопросам:
- Какие элементы располагаются в 6-А группе?
- Сколько форм существования элемента?
- Какие это элементы? (слайд4)
III. Переходим к следующему этапу.
Используем презентацию (Приложение
1).
Повторяем строение атома кислорода на
основании положения в ПСХЭ Д.И. Менделеева.
Прежде чем приступить к изучению серы, повторим
строение и свойства кислорода.
Используем интерактивную доску.
Откроем сохранённый документ, созданный на
прошлом уроке. Открывается схема строения
кислорода.
Заполняет отвечающий ученик на
интерактивной доске.

Атом кислорода располагается во 2 периоде, 6А
группе, порядковый номер 8
Физический смысл данных показателей: 8
электронов вращаются на двух электронных слоях,
на внешнем слое 6 электронов. Электронный уровень
не завершен. До завершения недостаёт два
электрона. У атома кислорода самый маленький
радиус, поэтому кислород почти всегда принимает
электроны, проявляя степень окисления –2
(исключение фтор). Кислород сильный окислитель. (слайд
5)
IV. Переходим к изучению новой темы. На
интерактивной доске записываем тему урока.
1. Строение, свойства серы на основании
положения в ПСХЭ Д.И. Менделеева.
Беседа с учащимися по следующим вопросам:
1). Какое положение занимает сера в ПСХЭ Д.И.
Менделеева?
2). Каков физический смысл данных показателей
серы?
3). На интерактивной доске и в тетрадях заполните
схему строения атома серы по аналогии с
кислородом.
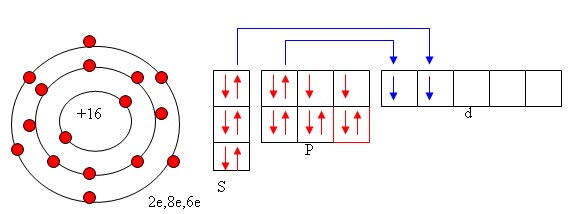
Ответ: 3 период, 6А группа, порядковый номер 16.
Заряд ядра +16, 16 электронов вращаются на 3
электронных уровнях, на внешнем уровне 6
электронов, как и у атома кислорода до завершения
недостаёт 2 электрона. Сера может принять два
электрона, проявляя степень окисления –2 (H2+
S–2). У кислорода два электронных уровня, а у
серы три. Радиус серы больше радиуса кислорода.
Сера может предоставить более
электроотрицательному элементу 2 электрона,
проявляя при этом степень окисления +2 (S+2O–2)
(слайд 6)
Проблемный вопрос: Может ли атом серы
проявлять другие степени окисления?
Для ответа на этот вопрос распределим
электроны по уровням, подуровням, по орбиталям.
Это задание выполняет один из учащихся на
электронной доске, а остальные учащиеся в
тетрадях.
Учащийся объясняет распределение электронов.
На первом уровне один подуровень и одна орбиталь,
заполненная полностью. На втором уровне два
подуровня и четыре орбитали, заполненные
полностью. На третьем уровне три подуровня и
девять орбиталей. Появляется d-подуровень, он в
спокойном состоянии атома не заполнен. Внешний
электронный слой заполнен так же, как и у
кислорода. Есть две орбитали, имеющие пары
электронов. В возбуждённом состоянии может
происходить разъединение пары электронов. При
разъединении одной пары электрон перескакивает
на d-подуровень, образуется четыре не спаренных
электрона, которые сера может предоставлять
более электроотрицательным атомам, проявляя при
этом степень окисления +4 (S+4O–22).
При разъединении ещё одной пары электронов
образуется 6 неспаренных электронов, которые так
же сера может предоставлять более
электроотрицательным атомам, проявляя при этом
степень окисления +6.(S+6 O–23).
Вывод: Сера может быть и окислителем и
восстановителем со степенями окисления: –2, 0, +2,
+4, +6. Например:
По отношению к кислороду, сера проявляет
восстановительные свойства. По отношению к
водороду, металлам и менее электроотрицательным
неметаллам сера проявляет окислительные
свойства.
Долее перейдём ко второй форме существования
серы.
2. Сера, как простое вещество. (слайд
7)
Сера образует молекулы с чётным числом атомов. S2,
S4, S6, S8. При обычных условиях
устойчивая молекула S8, имеющая структуру
короны.
Из таких молекул построены две аллотропные
кристаллические модификации серы: РОМБИЧЕСКАЯ И
МОНОКЛИННАЯ. Ромбическая лимонно-жёлтая
кристаллическая сера . При температуре 95*С
ромбическая переходит в моноклинную. При
температуре 119*С она плавится, около 160*С кольца
молекул S8 разрываются, образуя бесконечные
спирали. Моноклинная переходит в
тёмно-коричневую смолообразную пластическую
серу.
Все формы через определённое время переходят в
ромбическую.
Сера не растворяется в воде. Кристаллы серы в
воде тонут, порошок плавает на поверхности, так
как мелкие кристаллики серы водой не смачиваются
и поддерживаются на плаву мелкими пузырьками
воздуха. (Демонстрация опыта)
В качестве закрепления используем электронный
учебник.
Просмотр фрагментов электронного учебника
«Репетитор» (демонстрация опыта) и просмотр
фрагментов электронного учебника
«Неорганическая химия» (строение серы).
Переходим к изучению следующего раздела.
3. Химические свойства серы.(слайд 8)
1) Взаимодействие с металлами. (слайд 9)
При обычных условиях сера вступает в реакцию с
щелочными и щёлочноземельными металлами, медью,
ртутью, серебром. Реакция серы с ртутью
используется для сбора ртути. Такой процесс
называют демеркуризацией.
При нагревании сера реагирует и с другими
металлами (Zn, Al, Fe ) и только золото не
взаимодействует с ней ни при каких условиях.
Электронный учебник «Неорганическая химия».
Смотрим демонстрацию опыта «взаимодействие серы
с металлами».
Рассматриваем на интерактивной доске несколько
реакций взаимодействия серы с металлами с
использованием метода электронного баланса
- Взаимодействие с ртутью
Hg0 + S0 = Hg+2 S–2
Hg0 – 2e ––> Hg+2
1 восстановитель
окисления
S0 + 2e ––> S–2
1
окислитель
восстановления
- Взаимодействие с натрием
2Na0 + S0 = Na+2 S–2
Na0 – e ––> Na+
2
восстановитель
окисления
S0 + 2e ––> S+2
1
окислитель
Восстановления
2) Взаимодействие с водородом. (слайд10)
S0 + H02 ––> H+ 2S–2
S0 + 2e ––> S–2
1
окислитель
Восстановления
H02 – 2e ––> 2H+
1
восстановитель
Окисления
С металлами, с водородом сера проявляет
окислительные свойства.
3) Взаимодействие с углеродом. (слайд11)
S0 + C0 = C+4S–22
S0 + 2e ––> S–2
2
окислитель
Восстановления
C0 – 4е ––> C+4
1
восстановитель
Окисления
C менее электроотрицательными неметаллами,
сера проявляет окислительные свойства.
4) Взаимодействие с кислородом. (слайд12)
S0 + О02 = S+4О–22
S0 – 4e ––> S+4
восстановитель
Окисления
О02 + 4е ––> 2O–2
окислитель
Восстановления
По отношению к сильным окислителям сера
проявляет восстановительные свойства.
Заканчиваем урок общими выводами, которые
выделены в презентации.
Выводы: (слайд13)
- Сера имеет 3 электронных уровня. Радиус серы
больше радиуса кислорода. Сера может быть
окислителем и восстановителем. - Молекулы серы с чётным числом атомов: S2, S4,S6
S8 - Вступает в реакции с металлами, неметаллами и со
сложными веществами. - По отношению к металлам, водороду и менее
электроотрицательным неметаллам сера является
окислителем со степенью окисления –2. - По отношению к фтору, кислороду, более
электроотрицательным неметаллами, сложным
веществам – сера является восстановителем со
степенями окисления.ок.+2,+4,+6
Источник
