Какие свойства может проявлять фосфор

Каждый человек знаком с 15 элементом таблицы Менделеева – фосфором, ведь каждый в своей жизни хотя бы раз пользовался спичками, имеющими фосфор в своем составе. Более того, все люди содержат фосфор в своем организме, не в чистом виде, разумеется, а в виде химических соединений, но тем не менее. Особенно много фосфора находится в наших костях и зубах, чей химический состав почти полностью совпадает с формулой минерала фосфорита Ca3(PO4)2.Также фосфорсодержащие белки находятся в наших мышцах, нервах и мозговой ткани, именно поэтому фосфор особенно полезен для мозга. О физических и химических свойствах этого важного химического элемента, о его применении и влиянии на человека читайте далее.
История открытия фосфора
В 1669 гамбургский купец и по совместительству алхимик Хенниг Брандт в очередной раз пытался осуществить мечту всех средневековых алхимиков – найти легендарный философский камень, якобы превращающий все металлы в золото и дарующий бессмертие. Увы, философский камень и в этот раз найти не удалось, но, тем не менее, Хеннигу посчастливилось сделать другое не менее важное открытие в химии. На этот раз в качестве эксперимента немецкий алхимик решил выпаривать воду из… человеческой мочи. В результате череды сложных химических манипуляций над собственной мочой в реторте у алхимика образовалось неведомое до того светящееся вещество – фосфор.
К слову, само слово «фосфор» с древнегреческого переводится как «несущий свет». Именно такое название он получил за свою удивительную способность светиться в темноте. Первооткрыватель фосфора алхимик Хенниг Брандт быстро понял свою выгоду от этого открытия и за большие деньги показывал светящийся фосфор разным знатным и богатым господам, нажив при этом большое состояние (развлечений в то время в Европе было не так уж и много, так что научно-популярные представления предприимчивого алхимика пользовались большим спросом).

Впрочем, Хенинг Брандт был не первым, кто добыл фосфор опытным путем. Еще до него, в XII веке это удалось сделать арабскому алхимику Алхиду Бехилу, все также благодаря химическим манипуляциям с мочой и глиной, но его открытие затерялось, и именно повторное открытие фосфора немецким алхимиком принесло широкую популярность этому химическому элементу.
Первое время после открытия фосфор вызывал лишь любопытство своим свечением и только в конце XIX века ученые поняли, что фосфор также является чрезвычайно важным полезным микроэлементом для жизнедеятельности человеческого организма.
Физические свойства фосфора
Как и азот, фосфор способен образовывать двухатомные молекулы Р2.. Однако подобные молекулы фосфора могут быть устойчивыми лишь при очень высокой температуре – около 1000 С. В обычных же условиях атомы фосфора соединяются в молекулы других составов. Например, белый фосфор состоит из четырехатомных молекул Р4. Между собой атомы белого фосфора соединены в виде простейшего многогранника тетраэдра.
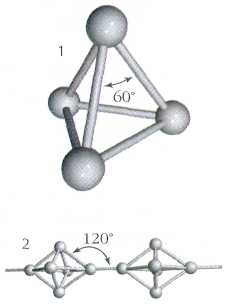
Так схематически выглядит строение молекулы белого фосфора, состоящей из четырех атомов.
Сам белый фосфор являет собой практически бесцветное твердокристаллическое вещество, моментально окисляемое кислородом воздуха, при этом во время окисления фосфора идет дым, а в воздухе появляется явный чесночный запах. Своим внешним видом белый фосфор похож на воск, такой же мягкий и легкоплавкий, при этом светится в темноте и является чрезвычайно опасным, так как очень ядовит и огнеопасен.
Помимо белого фосфора физики также различают красный фосфор, черный фосфор, желтый фосфор и металлический фосфор, каждый из них имеет свои особенные физические свойства.
Так если белый фосфор нагревать до температуры 300 С без доступа воздуха и в присутствии катализаторов (ими может быть йод или натрий), то он превратится в красный фосфор. В отличие от белого фосфора его красный собрат не светится в темноте и не является ядовитым и опасным, к слову именно его используют при производстве спичек.

Красный фосфор это аморфное вещество, состоящее из полимерных молекул Px, он нерастворим в воде и других органических растворителях, а при нагревании без доступа воздуха не возгорается.
Если белый фосфор поместить под очень большое давление (в сотни атмосфер) то из него получится черный фосфор, который своими свойствами напоминает металл: он блестит и проводит электрический ток. Если еще больше увеличить давление, то черный фосфор превратится в металлический, его кристаллическая решетка будет такой же плотной как у металлов. Металлический фосфор очень хорошо проводит электрический ток.

Так выглядят разные виды фосфора.
Хотя фосфор и является одним из самых распространенных химических элементов на нашей планете, в чистом виде в природных условиях его не бывает, добыть чистый фосфор возможно лишь в химической лаборатории. Однако фосфор входит в состав многих важных химических и биологических соединений: фосфолипидов, фосфидов (соединения фосфора и металлов), фосфинов (соединений водорода с фосфором), фосфорной кислоты и так далее.
Химические свойства фосфора
Как мы писали выше, фосфор занимает 15 место в периодической таблице Менделеева и входит в одну группу с азотом, мышьяком и сурьмой. Хотя на валентном уровне он и имеет целых 5 электронов, однако 5 связей образуются довольно редко.

Фосфор – очень химически активный элемент, особенно белый фосфор. Как следствие он может вступать в самые разнообразные химические реакции, выступая как в качестве окислителя (с элементами, расположенными ниже и левее в таблице Менделеева), так и восстановителя (с элементами, расположенными выше и правее в таблице Менделеева).
При взаимодействии с кислородом воздуха образуются оксиды – ангидриды соответствующих кислот:
4P +3O2 > 2P2O3
4P + 5O2 > 2P2O5
При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
2P + 3Cl2 > 2PCl3
2P + 5Cl2 > 2PCl5
При взаимодействии фосфора с серой образуются сульфиды:
2P + 3S > P2S3
2P + 5S > P2S5
При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
2P + 3Ca > Ca3P2
2P + 3Mg > Mg3P2
Применение фосфора
Научившись добывать фосфор в чистом виде человек нашел ему самое разнообразное применение, причем не только созидательное, но порой и очень разрушительное. Так еще во время первой мировой войны немецкими химиками был использован желтый фосфор в качестве начинки зажигательных боеприпасов и отравляющих газов.

Впоследствии применение таких газов на поле боя было запрещено Женевской конвенцией. Увы, такая наша глупая человеческая природа – использовать научные открытия в разрушительных целях, как впрочем, и открытие энергии расщепления атома было применено для создания атомной бомбы, и лишь потом для атомной энергетики.
Но вернемся к фосфору, в мирных целях этот химический элемент активно используется в сельском хозяйстве для создания эффективных удобрений для растений. Фосфор входит в состав некоторых лекарственных препаратов, к примеру, в антибиотик фосфомицин, в состав моющих средств, наконец, из безопасного красного фосфора делают спички.
Фосфор имеет свое применение и в металлургии, в качестве сверхпрочных и антикоррозийных покрытий (черный и металлический фосфор). А многие фосфиды (соединения фосфора и металлов) обладают отличными полупроводниковыми свойствами и активно задействуются в микроэлектронике.
Получения фосфора
Для получения белого фосфора в чистом виде химики прокалывают природные фосфаты вместе с коксом и песком в электрической печи. Впрочем, вместо фосфатов можно использовать и другие неорганические соединения фосфора, например, метафосфорную кислоту. Красный и черный фосфор получают уже из белого фосфора путем разных манипуляций над последним (нагревание, увеличение давления).

Действие фосфора, его функции и роль в организме человека
Теперь давайте ответим на вопрос, какая роль фосфора в организме человека. А она очень большая, так как фосфор принимает участие во всех обменных процессах, происходящих в нашем организме. Основная масса фосфора находится в костях и зубах. Совместно с кальцием фосфор формирует правильную структуру костной ткани, и если пропорция содержания кальция и фосфора будет нарушена, то кости могут стать хрупкими, увеличится риск переломов.
Помимо костей и зубов фосфор имеет влияние и на самое главное – мыслительное деятельность человека, ведь он содержится в нашей мозговой ткани и нервах. От фосфора зависит работа нервной системы, с его помощью осуществляется метаболизм липидов и протеинов, биосинтез всех необходимых органических веществ. Наконец фосфор входит в состав ДНК и РНК, участвует в ферментивных процессах, поддерживающих кислотно-щелочной баланс в организме.
Фосфор для ребенка
Особенно необходим фосфор для растущего детского организма, ведь у ребенка идет активное формирование костей скелета, развиваются клетки головного мозга. Поэтому очень важно чтобы малыш получал фосфор в необходимых количествах и при этом регулярно, ведь значительная его часть вымывается из организма с мочой.
Поэтому важно знать, какие продукты содержат фосфор.
Продукты, содержащие фосфор
К счастью фосфор содержится во многих доступных продуктах питания: орехах, морепродуктах (особенно в рыбе), в сыре, капусте, моркови, чесноке, куриных яйцах (особенно в желтке). Особенно много фосфора имеется в яблоках, грецких орехах, говяжьей печени, гречке и икре рыб семейства осетровых.

Теперь вы знаете, какие продукты могут увеличить содержание фосфора в вашем организме и организме ваших детей.
Суточная норма фосфора
Суточная норма фосфора для взрослого человека составляет 1200-1600 мг. Также стоит учесть, что для людей занимающихся интенсивными физическими нагрузками, а также для беременных и кормящих матерей суточная норма фосфора выше и составляет приблизительно 3000-3800 мг.
Детям требуется от 300 до 1800 мг фосфора каждый день, в зависимости от их возраста.
Недостаток (дефицит) фосфора в организме
Недостаток или дефицит фосфора в человеческом организме может быть обусловлен разными причинами:
- приемом некоторых лекарств, которые понижают кислотность,
- диетами с пониженным содержанием белков,
- алкогольными или наркотическими зависимостями,
- эндокринными заболеваниями,
- заболеваниями почек.
Симптомами недостатка фосфора является общее недомогание, слабость, апатичность, депрессия, физическое и умственное истощение. Если у вас проявляются эти симптомы, то лучше чем скорее обратится к врачу, чтобы он прописал вам правильное лечение.
Избыток фосфора в организме и симптомы отравления им
Избыток фосфора в человеческом организме может быть столь же вредным, как и его недостаток. Обычно причиной избытка фосфора является злоупотребление человеком мясной пищей. Когда фосфора становится слишком много, нарушается его пропорция содержания с кальцием. Кальция становится меньше чем нужно, его вытесняет фосфор, от чего кости человека становятся более хрупкими, может возникнуть остеопороз (снижение плотности костей, повышение их хрупкости).
Также переизбыток фосфора может привести к возникновению проблем с зубами, нарушению работы нервной системы, почек и щитовидных желез. Чтобы предотвратить все это важно вести здоровый образ жизни, правильно питаться (не одним лишь хлебом и мясом, а обязательно фруктами, овощами), избегать вредных привычек.
Фосфор, видео
И в завершение, образовательное видео по теме нашей статьи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник
Полный курс химии вы можете найти на моем сайте CHEMEGE.RU. Чтобы получать актуальные материалы и новости ЕГЭ по химии, вступайте в мою группу в ВКонтакте или на Facebook. Если вы хотите подготовиться к ЕГЭ по химии на высокие баллы, приглашаю на онлайн-курс “40 шагов к 100 баллам на ЕГЭ по химии“.
Создать карусель Добавьте описание
Фосфор
Положение в периодической системе химических элементов
Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение фосфора
Электронная конфигурация фосфора в основном состоянии:
Создать карусель Добавьте описание
Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние.
Электронная конфигурация фосфора в возбужденном состоянии:
Создать карусель Добавьте описание
При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V.
Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III.
Степени окисления атома фосфора – от -3 до +5. Характерные степени окисления -3, 0, +1, +3, +5.
Физические свойства и нахождение в природе
Фосфор образует различные простые вещества (аллотропные модификации).
Создать карусель Добавьте описание
Создать карусель Добавьте описание
Создать карусель Добавьте описание
Белый фосфор
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего).
Покрытие бумаги раствором белого фосфора в сероуглероде
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C.
Плавление белого фосфора
Создать карусель Добавьте описание
Создать карусель Добавьте описание
Создать карусель Добавьте описание
Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.
Создать карусель Добавьте описание
Черный фосфор
Известны также такие модификации, как желтый фосфор и металлический фосфор. Желтый фосфор – это неочищенный белый фосфор. При очень высоком давлении фосфор переходит в новую модификацию – металлический фосфор, который очень хорошо проводит электрический ток.
Создать карусель Добавьте описание
Создать карусель Добавьте описание
Соединения фосфора
Типичные соединения фосфора:
Создать карусель Добавьте описание
Создать карусель Добавьте описание
Способы получения фосфора
1. Белый фосфор получают из природных фосфатов, прокаливая их с коксом и песком в электрической печи:
Фосфор. Химия фосфора
2. Вместо фосфатов можно использовать другие неорганические соединения фосфора, например, метафосфорную кислоту.
Создать карусель Добавьте описание
3. Красный и черный фосфор получают из белого фосфора.
Создать карусель Добавьте описание
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
Фосфор проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому фосфор реагирует с металлами и неметаллами.
1.1. При взаимодействии с кислородом воздуха образуются оксиды – ангидриды соответствующих кислот:
Горение белого фосфора
Горение красного фосфора
Создать карусель Добавьте описание
Создать карусель Добавьте описание
Создать карусель Добавьте описание
1.3. При взаимодействии фосфора с серой образуются сульфиды:
Создать карусель Добавьте описание
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
Создать карусель Добавьте описание
Еще пример: натрий взаимодействует с фосфором с образованием фосфида натрия:
Фосфор. Химия фосфора
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Например, азотная кислота окисляет фосфор до фосфорной кислоты:
Создать карусель Добавьте описание
Фосфор. Химия фосфора
Реакция красного фосфора с бертолетовой солью.
Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
Красный фосфор + бертолетова соль
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Например, фосфор реагирует с гидроксидом калия:
Создать карусель Добавьте описание
Или с гидроксидом кальция:
Фосфор. Химия фосфора
Источник
Фосфор – элемент главной подгруппе V группы периодической системы Д.И. Менделеева.

Электронная конфигурация атома фосфора $1s^22s^2p^63s^2 3p^3,hspace{0.4cm}$ это р-элемент. В возбужденном состоянии валентные электроны 3s-подуровня распариваются и переходят на свободный 3d-подуровень: $1s^22s^2p^63s^1 3p^3 3d^1$
В возбужденном состоянии фосфор проявляет валентность V, в основном – III. Характерные степени окисления фосфора в соединениях –3, +3, +5; наиболее устойчивой является степень окисления +5. В соединениях фосфор может входить как в состав катионов, так и в состав анионов, например: $Ca_3P^{-3}_2, H_3P^{+5}O_4$
АЛЛОТРОПНЫЕ МОДИФИКАЦИИ ФОСФОРА
Фосфор может существовать в виде нескольких аллотропных модификаций, наиболее устойчивыми из которых являются белый, красный и черный фосфор.
Определение
Аллотропия – свойство некоторых химических элементов, позволяющее им существовать в двух или более различных физических формах.
БЕЛЫЙ ФОСФОР
Молекула белого фосфора (наиболее активного аллотропа) имеет молекулярную кристаллическую решетку, в узлах которой находятся четырехатомные молекулы $P_4 $тетраэдрического строения.
Белый фосфор мягкий, как воск, плавится и кипит без разложения, обладает чесночным запахом. На воздухе белый фосфор быстро окисляется (светится зеленоватым цветом). Он нерастворим в воде, но хорошо растворяется в сероуглероде ($CS_2$). Воспламеняется при 35$^circ C$ или от трения, поэтому его хранят и режут под слоем воды. Обладает очень высокой химической активностью. При нагревании без доступа воздуха до 250–300 $^circ C$ превращается в красный фосфор.
Ядовит (даже в малых дозах, ПДК = 0,03 мг/м3, смертельная доза – 0,15 г ). Противоядием служит сильно разбавленный раствор сульфата меди (II). Он обезвреживает фосфор, переводя его в фосфид меди.
КРАСНЫЙ ФОСФОР
Красный фосфор – это неорганический полимер; макромолекулы $P_n$ могут иметь как циклическое, так и ациклическое строение.Красный фосфор – твёрдое порошкообразное вещество тёмно-красного цвета, нерастворимое в воде и сероуглероде По свойствам резко отличается от белого фосфора: не ядовит, не светится в темноте, не растворяется в сероуглероде и других органических растворителях, не обладает высокой химической активностью. При комнатной температуре медленно переходит в белый фосфор; при нагревании до 200 $^circ C$ под давлением превращается в черный фосфор.
ЧЕРНЫЙ ФОСФОР

Черный фосфор по виду похож на графит: имеет металлический блеск. По структуре – это неорганический полимер, молекулы которого имеют слоистую структуру.
Полупроводник. Не ядовит. Химическая активность значительно ниже, чем у белого фосфора. На воздухе устойчив. При нагревании переходит в красный фосфор.
Известны также и другие модификации – фиолетовый и коричневый фосфор. Эти разновидности элемента пока ещё не находят широкого практического применения
ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА
Наиболее активным в химическом отношении является белый фосфор (но на практике предпочитают работать с красным фосфором). Он может проявлять в реакциях свойства как окислителя, так и восстановителя, например:
| Р – окислитель | Р – восстановитель |
|---|---|
| при взаимодействии с менее электроотрицательными элементами (металлами) | при взаимодействии с более электроотрицательными элементами (неметаллами) |
$3Ca + 2P to Ca_3P_2$ | $4P + 3O_{2textrm{(нед)}} to 2P_2O_3$ $4P + 5O_{2textrm{(изб)}} to 2P_2O_5$ |
$3Na + P to Na_3P$ | $6P + 5N_2 to 2P_2N_5$ |
| $3Mg + 2P = Mg_3P_2$ | $2P + 3Cl_{2textrm{(нед)}} to 2PCl_3$ $2P + 5Cl_{2textrm{(изб)}} to 2PCl_5$ |
| $Cu + Pne$ | $2P + 3I_2 to 2PI_3$ |
1) При взаимодействии с водой фосфор диспропорционирует (является и окислителем и восстановителем одновременно) с образованием фосфина и фосфорноватистой кислоты:
$4P^0 + 6H_2O rightarrow P^{-3}H_3 + 3H_3P^{+1}O_2$
$P^0 +3bar{e} rightarrow P^{-3}hspace{1 cm}textrm{окислитель (процесс восстановление)}$
$P^0 -bar{e} rightarrow P^{+1}hspace{1 cm}textrm{восстановитель (процесс окисление)}$
2) С растворами щелочей фосфор образует фосфин и гипофосфиты:
$4P^0 + 3KOH + 3H2O rightarrow P^{-3}H_3 + 3KH_2P^{+1}O_2$
$P^0 +3bar{e} rightarrow P^{-3}hspace{1 cm}textrm{окислитель (процесс восстановление)}$
$P^0 -bar{e} rightarrow P^{+1}hspace{1 cm}textrm{восстановитель (процесс окисление)}$
3) Фосфор не реагирует с большинством кислот, однако сильные кислоты-окислители (азотная, серная, хлорная) превращают фосфор в (орто)фосфорную кислоту:
$3P^0 + 5HN^{+5}O_3textrm{(разб.)} + 2H_2O rightarrow 3H_3P^{+ 5}O_4 + 5N^{+2}O$
$P^0 -5bar{e} rightarrow P^{+5}hspace{1 cm}textrm{восстановитель (процесс окисление)}$
$N^{+5} +3bar{e} rightarrow N^{+2}hspace{1 cm}textrm{окислитель (процесс восстановление)}$
$P^0_{textrm{(кр.)}} + 5HN^{+5}O_{3textrm{(конц.)}} rightarrow H_3P^{+5}O_4 + 5N^{+4}O_2 + H_2O$
$P^0 -5bar{e} rightarrow P^{+5}hspace{1 cm}textrm{восстановитель (процесс окисление)}$
$N^{+5} +1bar{e} rightarrow N^{+4}hspace{1 cm}textrm{окислитель (процесс восстановление)}$
$2P^0 + 5H_2S^{+6}O_{4textrm{(конц.)}} rightarrow 2H_3P^{+5}O_4 + 5S^{+4}O_2 + 2H_2O$
$P^0 -5bar{e} rightarrow P^{+5}hspace{1 cm}textrm{восстановитель (процесс окисление)}$
$S^{+6} +2bar{e} rightarrow S^{+4}hspace{1 cm}textrm{окислитель (процесс восстановление)}$
4) Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
$6P + 5KClO_3 rightarrow 5KCl + 3P_2O_5$
$P^0 -5bar{e} rightarrow P^{+5}hspace{1 cm}textrm{восстановитель (процесс окисление)}$
$Cl^{+5} +6bar{e} rightarrow Cl^{-1}hspace{1 cm}textrm{окислитель (процесс восстановление)}$
ПРИМЕНЕНИЕ ФОСФОРА
Белый фосфор используют:
для изготовления зажигательных снарядов, светящихся в темноте составом и для создания так называемых «дымовых завес», т.к. при горении фосфора образуется густой дым ($P_2O_5$);
для получения препаратов, которые используют для уничтожения насекомых-вредителей;
для производства фосфорной кислоты;
природные соединения фосфора: апатиты и фосфориты используются в производстве минеральных удобрений.
Красный фосфор используют в производстве спичек: входит в состав массы, наносимой на боковую сторону спичечной коробки.
Черный фосфор применяют очень редко.
Получение фосфора
Фосфор в промышленности получают из фосфата кальция $Ca_3(PO_4)_2,hspace{0.5 cm}$ который выделяют из фосфоритов и фторапатитов. Метод получения основан на реакции восстановления $Ca_3(PO_4)_2hspace{0.5 cm}$ до фосфора:
$Ca_3(PO_4)_2 + 3SiO_2 + 5C rightarrow 2P + 5CO + 3CaSiO_3$
В качестве восстановителя соединений фосфора используют кокс (углерод). Для связывания соединений кальция в реакционную систему добавляют кварцевый песок $SiO_2$. Процесс проводят в электропечах (производство относят к электротермическим), без доступа воздуха. Из-за наличия примесей технический фосфор имеет желтый цвет, поэтому в промышленности его называют желтым фосфором.
НАХОЖДЕНИЕ В ПРИРОДЕ
В природе фосфор встречается в виде соединений (солей), важнейшими из которых являются:
фосфорит ($Ca_3(PO_4)_2$),
хлорапатит ($Ca_3(PO_4)_2 cdot CaCl_2$),
фторапатит ($Ca_3(PO_4)_2 cdot CaF_2$).
БИОЛОГИЧЕСКАЯ РОЛЬ ФОСФОРА
Фосфор известен как элемент жизни. Это не случайно: он играет важную роль в процессах накопления и освобождения энергии в клетках, задействован в передаче нервных импульсов.
Он входит в состав нуклеиновых кислот, участвующих в процессах роста и деления клеток, хранения и использования генетической информации (ДНК и РНК).
В составе костей скелета содержится примерно 85% от всего фосфора, находящегося в организме. Фосфор обеспечивает нормальную и здоровую структуру десен и зубов.
Источник
