Какие свойства металлов зависят от их кристаллического строения
Основные сведения о металлах и сплавах
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место.
Подтверждение этому: и в названиях эпох (золотой, серебряный, бронзовый, железный века), на которые греки делили историю человечества: и в археологических находках металлических изделий (кованые медные украшения, сельскохозяйственные орудия); и в повсеместном использовании металлов и сплавов в современной технике.
Причина этого – в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Железный век продолжается. Примерно 9/10 всех используемых человечеством металлов и сплавов – это сплавы на основе железа. Железа выплавляется в мире примерно в 50 раз больше, чем алюминия, не говоря уже о прочих металлах.
Было время, когда железо на земле ценилось значительно дороже золота. Советский историк Г. Арешян изучал влияние железа на древнюю культуру стран Средиземноморья. Он приводит такую пропорцию: 1 : 160 : 1280 : 6400. Это соотношение стоимостей меди, серебра, золота и железа у древних хеттов.
До настоящего времени основной материальной базой машиностроения служит черная металлургия, производящая стали и чугуны. Эти материалы имеют много положительных качеств и в первую очередь обеспечивают высокую конструкционную прочность деталей машин. Однако эти классические материалы имеют такие недостатки как большая плотность, низкая коррозионная стойкость. Потери от коррозии составляют 20% годового производства стали и чугуна. Поэтому, по данным научных исследований, через 20…40 лет все развитые страны перестроятся на массовое использование металлических сплавов на базе титана, магния, алюминия. Эти легкие и прочные сплавы позволяют в 2-3 раза облегчить станки и машины, в 10 раз уменьшить расходы на ремонт.
Кристаллическое строение металлов. Характерные свойства металлов. Виды кристаллических решеток, дефекты их строения.
Металлы – простые вещества, обладающие в обычных условиях характерными свойствами:
- специфический «металлический» блеск (хорошая отражательная способность и непрозрачность);
- высокая электропроводность;
- высокая теплопроводность;
- пластичность;
- отрицательный температурный коэффициент электропроводности (возрастание электросопротивления с повышением температуры).
Самыми распространенными в природе металлами являются алюминий, железо, кальций, натрий, калий, магний и титан.
Характерные свойства металлов обусловлены строением их атомов.
Из курса физики известно, что атом состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных частичек – электронов. В ядре атома находятся положительно заряженные частицы – протоны. Количество протонов равно количеству окружающих ядро электронов, т. е. атом в целом является электрически нейтральным.
Атом может терять или приобретать электроны. Тогда он превращается в электрически заряженный атом — ион. При избытке электронов ион заряжен отрицательно, при недостатке электронов — положительно.
Принадлежащие атому электроны разделяют на валентные (внешние), движущиеся по внешним орбитам, и внутренние, движущиеся по более близким к ядру орбитам.
Благодаря слабой связи внешних электронов с ядром в металлах всегда имеются электроны, подвергающиеся воздействию положительно заряженных ядер близлежащих атомов. Такие электроны называются свободными. Свободные электроны принадлежат не одному какому-либо ядру, а блуждают по всему металлу, вращаясь вокруг ядра то одного, то другого иона.
Наличием большого количества свободных электронов (называемых также коллективными или «электронный газ») и объясняются указанные выше характерные признаки металлов.
В отличие от металлов неметаллы, как правило, хрупки, лишены металлического блеска, имеют низкую тепло- и электропроводность. Электросопротивление неметаллов с повышением температуры понижается.
Все металлы в нормальных условиях являются твёрдыми телами (за исключением ртути) и представляют собой вещества, состоящие из большого числа мелких зёрен – кристаллов, упорядоченно расположенных друг относительно друга в пространстве. Этот порядок определяется понятием кристаллическая решётка.
Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Основными типами кристаллических решёток являются:
1) Объемно – центрированная кубическая (ОЦК) (см. рис.1 а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, Feα)
2) Гранецентрированная кубическая (ГЦК) (см. рис. 1 б), атомы располагаются в вершинах куба и по центру каждой из 6 граней (Cu, Al, Ag, Au, Feγ)
3) Гексагональная, в основании которой лежит шестиугольник:
простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости (цинк).
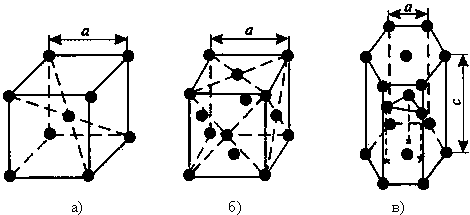
Рисунок 1 – Основные типы кристаллических решеток: а – объемно-центрированная кубическая;
б– гранецентрированная кубическая; в – гексагональная плотноупакованная
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропиейили полиморфизмом.
Примером аллотропического видоизменения в зависимости от температуры является железо (Fe): t<911°С – ОЦК – Feα; 911< t< 1392°С – ГЦК – Feβ; 1392< t> 1539°С – ОЦК – Feσ.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
В кристаллической решетке реальных металлов имеются различные дефекты (несовершенства), которые нарушают связи между атомами и оказывают влияние на свойства металлов. Различают точечные, линейные и поверхностные дефекты.
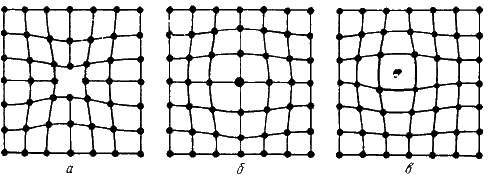
Одним из распространенных несовершенств кристаллического строения является наличие точечных дефектов: вакансий, дислоцированных атомов и примесей (рис. 2).

Рисунок 2 – Точечные дефекты
Вакансия – отсутствие атомов в узлах кристаллической решетки.
Дислоцированный атом – это атом, вышедший из узла решетки и занявший место в междоузлие.
Примесные атомы всегда присутствуют в металле, так как практически невозможно выплавить химически чистый металл. Они могут иметь размеры больше или меньше размеров основных атомов и располагаются в узлах решетки или междоузлиях.
Точечные дефекты вызывают незначительные искажения решетки, что может привести к изменению свойств тела (электропроводность, магнитные свойства), их наличие способствует процессам диффузии и протеканию фазовых превращений в твердом состоянии. При перемещении по материалу дефекты могут взаимодействовать.
Основными линейными дефектами являются дислокации.
Д  ислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. Простейшие виды дислокаций – краевые и винтовые.
ислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. Простейшие виды дислокаций – краевые и винтовые.
Рисунок 3 – Искажения в кристаллической решетке при наличии краевой дислокации
Плотность дислокации в значительной мере определяет пластичность и прочность материала. С увеличением плотности дислокаций возрастает внутреннее механическое напряжение, изменяются оптические свойства, повышается электросопротивление металла. Дислокации ускоряют старение и другие процессы, уменьшают химическую стойкость, поэтому в результате обработки поверхности кристалла специальными веществами в местах выхода дислокаций образуются ямки.
Источник
У металлов электроны на внешних оболочках имеют слабую связь с ядром, легко отрываются и могут свободно перемещаться между положительно заряженными ядрами. Следовательно, в металле положительно заряженные ионы окружены коллективизированными электронами. Так как эти электроны подвижны аналогично частицам газа, то используется термин «электронный газ».
Металлургический тип связи характерен тем, что нет непосредственного соединения атомов друг с другом, нет между ними прямой связи. Атомы в металлах размещаются закономерно, образуя кристаллическую решетку.
Кристаллическая решетка – это мысленно проведенные в пространстве прямые линии, соединяющие ближайшие атомы и проходящие через их центры, относительно которых они совершают колебательные движения. В итоге образуются фигуры правильной геометрической формы – кристаллическая решетка (рис. 1).

Рис. 1
Расстояния (а, b, с) между атомами, т.е. параметры кристаллической решетки, находятся в пределах 2…6A (1A=10-8 см). Каждый атом принадлежит 8 кристаллическим решеткам. В аморфных телах с хаотическим расположением атомов в пространстве, свойства в различных направлениях одинаковы, а в кристаллических телах расстояния между атомами в различных направлениях неодинаковы, поэтому различны и свойства. Тип кристаллической решетки (рис. 2) зависит от металла, температуры и давления. Это используется при термообработке металлов для упрочнения их.
Реальные металлы состоят из большого количества кристаллов, различно ориентированных в пространстве относительно друг друга. На границах зерен атомы кристаллов не имеют правильного расположения, здесь скапливаются примеси, дефекты и включения. Экспериментально установлено, что внутреннее кристаллическое строение зерен не является правильным. В решетках имеются различные дефекты (несовершенства), которые нарушают связь между атомами и оказывают влияние на свойства металлов.

Рис. 2 Виды кристаллических решеток
Имеются следующие несовершенства в кристаллических решетках:
1. Точечные (рис. 3):
а) Наличие вакансий, т.е. мест в решетке, не занятых атомами. Это происходит из-за смещения атомов от равновесного состояния. Число вакансий увеличивается с ростом температуры.
Рис. 3 Дефекты кристаллической решетки

б)
Дислоцированные атомы, т.е. атомы вышедшие из узла решетки и занявшие место в междоузлии. в) Примесные атомы, т.е. в основном металле имеются чужеродные примеси. Например, в чугуне основными атомами являются атомы железа, а примесными – атомы углерода, которые или занимают место основного атома, или внедряются внутрь ячейки.3. Линейные несовершенства (цепочки вакансий, дислокаций и т.д.). Линейные дефекты малы в двух направлениях и значительно большего размера в третьем.
Количество дефектов в металле оказывает существенное влияние на его прочность. На первом участке кривой (рис. 4) при минимуме дислокаций меньше возможностей для сдвига атомов по кристаллической решетке, поэтому будет максимум прочности металла (теоретическая, недостижимая прочность). Путем восстановления из хлористого или бромистого железа в лабораторных условиях выращивают «усы» кристаллов железа длиной до 10 см и диаметром 0,5 … 1 мкм, имеющие относительно высокую прочность на растяжение (бb = 1200 …1300 кгс / мм2). Для сравнения, высокопрочная сталь имеет прочность всего 150 …200 кгс / мм2, т.е. на порядок ниже, а прочность железных «усов» примерно в 100 раз выше, чем у обычного железа (минимум на кривой).
Повышение прочности с увеличением плотности дислокаций выше их критического значения объясняется тем, что имеются не только параллельные, но и взаимопересекающиеся (объемные) дислокации. Они препятствуют взаимному перемещению металла и, как результат, приводят к увеличению прочности металла.

Рис. 4 Влияние количества дефектов на прочность сплава (стали)
Все современные способы упрочнения металлов (легирование, закалка, прокатка, ковка, штамповка, волочение и т.д.) – это увеличение количества дефектов в металле. Наивысшая прочность, которую можно получить путем увеличения количества дефектов в металле, составляет около 1/3 от теоретически возможной (идеальной) прочности.
Кристаллизация металлов


Рис. 5 Кривые нагрева и охлаждения аморфного тела
При нагреве и охлаждении (рис. 5) аморфных тел (смола, стекло, пластмассы,…) при переходе из жидкого в твердое состояние качественных изменений не происходит. В твердом состоянии атомы в аморфном теле расположены так же хаотично, как и в жидком, имеют только меньшую степень перемещения. Из рис 1. 5 видим, что температура плавления Тпл равняется температуре кристаллизации Ткр, а переход из одного состояния в другое (из твердого в жидкое – точка Тпл, и из жидкого в твердое – точка Ткр) происходит скачкообразно.
По другому ведут себя металлы (рис. 1.6). На участке 1 – 2 происходит нагрев металла; кристаллическая решетка сохраняется, но атомы увеличивают амплитуду колебаний за счет поглощенной тепловой энергии. На горизонтальном участке 2 – 3 также подводится тепло, но температура Тпл не повышается, т. к. подводимое тепло целиком расходуется на разрушение кристаллической решетки. Атомы переходят в неупорядоченное (жидкое) состояние. После разрушения последнего участка кристаллов, после точки 3 начинается повышение температуры жидкого металла по линии 3 – 4.
При охлаждении (4 – 5) на горизонтальном участке 5 – 6 происходит кристаллизация, при которой выделяется тепло, поэтому процесс проходит при постоянной температуре Ткр. Кристаллизация металла происходит не при температуре t, величина, которая зависит от плавления Тпл, а при некотором переохлаждении природы металла, наличия примесей и от скорости охлаждения.
Кристаллизация начинается с того, что при понижении температуры до значения Ткр начинают образовываться мелкие кристаллики, называемые центрами кристаллизации (зародышами). При дальнейшем уменьшении энергии металла происходит рост кристаллов и в то же время в жидкости возникают новые центры кристаллизации, т.е. процесс кристаллизации состоит из двух одновременно происходящих процессов: зарождение новых центров кристаллов и роста кристаллов из ранее образованных центров. Мелкокристаллический металл более твердый и прочный, чем крупнокристаллический. Следовательно, подбором температуры переохлаждения t можно регулировать механические характеристики металла. Многое зависит от количества нерастворимых примесей, которые являются центрами кристаллизации. Чем больше этих частиц, тем меньше зерна металла. Полученная в конверторе или в мартене, сталь (0,5…3 тн) заливается в изложницу. Большой перепад температур (свыше 1500 С) будет между расплавленным металлом и атмосферой по высоте и ширине слитка. В результате на поверхности слитка, т.е. там, где имеется наибольший перепад температур, будет мелкозернистая структура, а в центре слитка при минимальном перепаде температур возникнут при кристаллизации крупные, а между ними – столбчатые кристаллы.
Источник

КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
СТРОЕНИЕ И СВОЙСТВА МАТЕРИАЛОВ
ВВЕДЕНИЕ
Получение материалов с заданным комплексом свойств, технологии обработки материалов являются основой современного производства, и уровнем своего развития во многом определяют научно-технический и экономический потенциал страны. Никакие эффективные экономические или управленческие решения в любых масштабах, начиная от цеха и заканчивая отраслью, невозможны без знания основ материаловедения. Именно поэтому дисциплина «Материаловедение и технология конструкционных материалов» включена в учебные планы всех специальностей, которые связаны с техникой и промышленностью.
Процесс создания новых машин и конструкций обычно состоит из трех крупных этапов: 1) разработка конструкции от принципиальной схемы до деталировки; 2) выбор материалов; 3) разработка технологии изготовления деталей, и всей машины в целом. В настоящее время разработка принципиально новых материалов производится редко и, в основном, для авиационно-космической техники. Как правило, поступают иначе: выбирают материал из числа уже существующих. Выбор основывают на комплексе свойств, обеспечивающих надежную и долговечную работу конструкции в заданных условиях эксплуатации. Важный этап выбора материала – оценка его стоимости и дефицитности. Материал должен быть по возможности дешевым с учетом всех затрат, включающих как стоимость самого материала, так и стоимость технологии изготовления из него деталей.
В настоящем учебном пособии рассмотрены физико-химические основы строения и свойств конструкционных металлических и неметаллических материалов, приводятся методы определения механических свойств материалов, излагаются основы термической обработки и поверхностного упрочнения деталей, и также представлены все основные технологические процессы. Особое внимание следует обратить на техническую терминологию (названия материалов и процессов) и инженерное или научное содержание этих терминов, т.к. вся техническая документация на производстве, начиная от технологических карт в цехе и заканчивая бизнес-планом всего предприятия, содержит множество технических терминов. Не понимая их содержания невозможно построить грамотную политику в экономике и управлении предприятием.
Основные типы кристаллических решеток.Металлы являются телами кристаллическими. Это означает, что атомы в занимаемом ими пространстве расположены строго упорядоченно. Если соединить атомы воображаемыми линиями в трех взаимно перпендикулярных направлениях, то получится пространственная кристаллическая решетка. Ее наименьшим структурным образованием является элементарная ячейка. Расстояния a, b и c между центрами атомов, находящихся в соседних узлах решетки, называют параметрами, или периодами решетки. Величина их в металлах 0,1 – 0,7 нм. На рис. 1.1 показаны три типа элементарных ячеек кристаллических решеток, наиболее характерные для металлов: объемно-центрированная кубическая–ОЦК (V, Fe, Cr), гранецентрированная кубическая – ГЦК (Ni, Al, Ag), гексагональная плотноупакованная – ГПУ (Zn, Mg, Ti).
Для характеристики кристаллических решеток вводят понятие координационного числа и коэффициента компактности. Координационным числом IК называется число атомов, находящихся на наиболее близком равном расстоянии от данного атома. Решетка ОЦК менее компактна IК = 8, чем решетки ГЦК и ГПУ для них IК = 12.
Если принять, что атомы в решетке представляют собой упругие соприкасающиеся шары (рис. 1.1), то не трудно видеть, что в решетке, помимо атомов, имеется значительное свободное пространство. Плотность кристаллической решетки, т. е. объем, занятый атомами, характеризуется коэффициентом компактности Q. Этот коэффициент равен отношению суммарного объема атомов, входящих в элементарную ячейку, к объему всей ячейки. Для простой кубической решетки Q = 52 %, для ГЦК и ГПУ Q = 74 %. Оставшийся объем ячейки приходится на поры.
Кристаллографические направления и плоскости.В кристаллографии ряды атомов называют атомными плоскостями. Положение атомных плоскостей в кристалле определяется отрезками, отсекаемыми этими плоскостями при их пересечении с осями координат X, Y, Z. Начало координат в этом случае условно совмещают с одним из узлов кристаллической решетки. За индексы плоскостей принято брать отрезки, обратные параметрам решетки a, b, c: h = 1/a, k = 1/b, l = 1/с. Эти числа заключают в круглые скобки и в общем случае называют индексами Миллера (h k l). Например: плоскость
кубической решетки пересекает только ось Y, отсекаемые отрезки равны (¥, 1, ¥), а обратные им величины соответственно – (0,1,0), индексы Миллера в этом случае имеют вид (010). Для плоскости, пересекающей оси X, Y, Z, индексы будут (111), (рис. 1.2, а,б).
Рис .1.1. Схемы кристаллических решеток ОЦК, ГЦК, ГПУ (вверху) и их изображение в виде плотноупакованных шаров (внизу)
Кристаллографические направления проходят через начало координат и узлы кристаллической решетки. Для определения индексов направлений находят координаты узла решетки на соответствующей координатной оси: например, координаты ближайшего атома вдоль оси OX выразятся через 1,0,0 – это и будут индексы Миллера для направления [100], (рис. 1.2, в).
Анизотропия в кристаллах. Свойства материалов зависят от природы атомов, силы взаимодействия между ними. Аморфные материалы характеризуются хаотическим расположением атомов, поэтому их свойства в различных направлениях одинаковы. Такие материалы называют изотропными. В кристаллических материалах свойства вдоль различных кристаллографических направлений зависят от числа атомов, расположенных на соответствующих направлениях. Например, вдоль диагоналей куба ОЦК решетки [111] размещается больше атомов, чем по направлению вдоль ребер куба [100], [010], [001]. Это явление различия свойств вдоль кристаллографических направлений называют анизотропией свойств. Анизотропия проявляется только в пределах одного
кристаллического зерна или монокристалла. Реальные металлы являются телами поликристаллическими, состоящими из огромного числа зерен, произвольно ориентированных друг к другу своими кристаллографическими направлениями, следовательно, недостаток свойств по одному направлению компенсируется избытком этого свойства по этому же направлению в других зернах. Поэтому реальные металлы являются изотропными телами, т. е. телами с примерно одинаковыми свойствами по всем направлениям.
а) б) в)
Рис. 1.2. Индексы кристаллографических плоскостей (а,б) и направлений (в) в ОЦК решетке
Аллотропия металлов. Некоторые металлы (железо, титан, олово) способны по достижении определенных температур изменять свое кристаллическое строение, т. е. перестраивать тип элементарной ячейки. Так, ОЦК железо, будучи нагрето до 911 °С, перестраивается в ГЦК железо.
Данное явление получило название аллотропии или полиморфизма, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными переходами. Разные аллотропические формы металлов обозначают буквами греческого алфавита: низкотемпературные модификации обозначают буквой a, последующие в порядке роста температуры – b, g. Наличие полиморфизма имеет важное практическое значение, так как сохраняется и в сплавах на основе таких металлов, например, a- и b-фазы в титановых сплавах.
Дата добавления: 2014-01-07; Просмотров: 2677; Нарушение авторских прав?
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Рекомендуемые страницы:
Читайте также:
Источник
