Какие свойства металлов относятся к химическим
Среди металлов традиционно выделяют несколько групп. Входящие в их состав представители характеризуются отличной от других металлов химической активностью. Такими группами являются:
- благородные металлы (серебро, золото, платина);
- щелочные металлы (металлы, образованные элементами (I)А группы периодической системы);
- щелочноземельные металлы (кальций, стронций, барий, радий).
Простые вещества, обладающие металлическими свойствами, в химических реакциях всегда являются восстановителями. Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются свойства восстановителя).
Ряд активности металлов
| (Li, K, Ba, Ca, Na, ) | (Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb) | H2 | (Cu, Hg, Ag, Pt, Au) |
активные металлы | металлы средней активности | неактивные металлы |
1. Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
2. Каждый металл способен вытеснять из растворов солей те металлы, которые в ряду активности стоят после него (правее).
3. Металлы, находящиеся в ряду активности левее водорода, способны вытеснять его из растворов кислот.
4. Щелочные и щелочноземельные металлы в любых водных растворах взаимодействуют прежде всего с водой.
Общие химические свойства металлов
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды.
Металл + кислород → оксид.
Например, при взаимодействии магния с кислородом образуется оксид магния:
2Mg0+O02→2Mg+2O−2.
Видеофрагмент:
Обрати внимание!
Серебро, золото и платина с кислородом не реагируют.
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и иодом), образуя галогениды.
Металл + галоген → галогенид металла.
Например, при взаимодействии натрия с хлором образуется хлорид натрия:
2Na0+Cl02→2Na+1Cl−1.
3. Металлы взаимодействуют с серой, образуя сульфиды.
Металл + сера → сульфид металла.
Например, при взаимодействии цинка с серой образуется сульфид цинка:
Zn0+S0→Zn+2S−2.
Видеофрагмент:
Взаимодействие цинка с серой
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
Например, при взаимодействии лития с азотом образуется нитрид лития:
6Li0+N02→2Li+13N−3.
При взаимодействии кальция с фосфором образуется фосфид кальция:
3Ca0+2P0→Ca+23P−32.
Взаимодействие со сложными веществами
1. Щелочные и щелочноземельные металлы взаимодействуют с водой при обычных условиях, образуя растворимое в воде основание (щёлочь) и водород.
Активный металл + вода → щёлочь + водород.
Например, при взаимодействии натрия с водой образуются гидроксид натрия и водород:
2Na0+2H+12O−2→2Na+1O−2H+1+H02.
Видеофрагмент:
Взаимодействие натрия с водой
Обрати внимание!
Некоторые металлы средней активности реагируют с водой при повышенной температуре, образуя оксид металла и водород.
Например, раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe_3O_4 и водород:
3Fe0+4H+12O−2→Fe+2O−2⋅Fe+32O−23+4H02.
2. Mеталлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот, образуя соль и водород.
Металл + кислота → соль + водород.
Например, при взаимодействии алюминия с серной кислотой образуются сульфат алюминия и водород:
2Al0+3H+12S+6O−24→Al+32(S+6O−24)3+3H02.
Видеофрагмент:
Реакция алюминия с серной кислотой
3. Металлы реагируют с солями менее активных металлов в растворе, образуя соль более активного металла и менее активный металл в свободном виде.
Более активный металл + соль → соль более активного металла + менее активный металл.
Например, при взаимодействии железа с сульфатом меди((II)) образуются сульфат железа((II)) и медь:
Fe0+Cu+2S+6O−24→Fe+2S+6O−24+Cu0.
Видеофрагмент:
Взаимодействие железа с сульфатом меди
Источник
В химических реакциях металлы выступают в роли восстановителей и повышают степень окисления, превращаясь из простых веществ в катионы.
Химические свойства металлов различаются в зависимости от химической активности металла. По активности в водных растворах металлы расположены в ряд напряжений.

В этот ряд, составленный русским химиком Н.Н. Бекетовым, включен также неметалл водород. Активность металлов убывает слева направо:
Запомнить! Металлы, стоящие в ЭХ ряду после водорода, называют неактивными металлами.
Металлы, расположенные в ЭХ ряду до алюминия называют сильноактивными или активными металлами.
Общие химические свойства металлов
1) Многие металлы вступают в реакцию с типичными неметаллами – галогенами, кислородом, серой. При этом образуются соответственно хлориды, оксиды, сульфиды и другие бинарные соединения:
с азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании;
с серой металлы образуют сульфиды – соли сероводородной кислоты;
с водородом самые активные металлы образуют ионные гидриды (бинарные соединения, в которых водород имеет степень окисления -1);
с кислородом большинство металлов образует оксиды – амфотерные и основные. Основной продукт горения натрия – пероксид $Na_2O_2$; а калий и цезий горят с образованием надпероксидов $MeO_2$.
2) Следует обратить внимание на особенности взаимодействие металлов с водой:

Активные металлы, находящиеся в ряду активности металлов до Mg (включительно), реагируют с водой с образованием щелочей и водорода:$Ca + 2H_2O = Ca(OH)_2 + H_2uparrow$
Активные металлы (например, натрий и литий), взаимодействуют с водой со взрывом.
Металлы средней активности окисляются водой при нагревании до оксида:
$6Cr + 6H_2O xrightarrow[]{t, ^circ C} 2Cr_2O_3 + 3H_2uparrow$
Неактивные металлы (Au, Ag, Pt) – не реагируют с водой.
$hspace{1.5cm} xrightarrow []{[Li……Mg]} MOH +H_2uparrow$ активные металлы (до Al)
$H_2O + M xrightarrow []{[Al……Pb} M_xO_y +H_2uparrow$ среднеактивные металлы (от Al до H), только при нагревании
$hspace{1.5cm} xrightarrow []{[Bi……Au]} hspace{1cm} ne hspace{1cm}$ неактивные металлы (после Н)
Более подробно взаимодействие металлов с водой рассмотрено в темах, посвященных химии отдельных групп.
3) С разбавленными кислотами реагируют металлы, стоящие в ЭХР до водорода: происходит реакция замещения с образованием соли и газообразного водорода. При этом кислота проявляет окислительные свойства за счет наличия катиона водорода:
$mathrm{Mg} + 2mathrm{HCl} = mathrm{MgCl}_2 + mathrm{H}_2$
4) Взаимодействие азотной кислоты (любой концентрации) и концентрированной серной кислоты протекает с образованием других продуктов: кроме соли в этих реакциях образуется продукт восстановления серной (или азотной) кислоты. Подробнее см.тему “Взаимодействие азотной кислоты с металлами и неметаллами.
Запомнить! Все металлы, стоящие в ряду левее водорода, вытесняют его из разбавленных кислот, а металлы, расположенные справа от водорода, с растворами кислот не реагируют (азотная кислота – исключение).
5) Активность металлов также влияет на возможность протекания простого вещества металла с оксидом или солью другого металла. Металл вытесняет из солей менее активные металлы, стоящие правее его в ряду напряжений.
Запомнить! Для протекания реакции между металлом и солью другого требуется, чтобы соли, как вступающие в реакцию, так и образующиеся в ходе нее, были растворимы в воде. Металл вытесняет из соли только более слабый металл.
Например, для вытеснения меди из водного раствора сульфата меди подходит железо,
$mathrm{CuSO}_4 + mathrm{Fe} = mathrm{FeSO}_4 + mathrm{Cu}$
но не подходят свинец – так как он образует нерастворимый сульфат. Если опустить кусочек свинца в раствор сульфата меди, то с поверхности металла покроется тонким слоем сульфата, и реакция прекратится
$mathrm{CuSO}_4 + mathrm{Pb} = mathrm{PbSO}_4downarrow + mathrm{Cu}$
Другой пример: цинк легко вытесняет серебро из раствора нитрата серебра, однако реакция цинка со взвесью сульфида серебра, нерастворимого в воде, практически не протекает.
Общие химические свойства металлов обобщены в таблице:
| Уравнение реакции | Продукты реакции | Примечания |
|---|---|---|
| с простыми веществами – неметаллами | ||
| с кислородом | ||
$4Li + O_2 = 2Li_2O$ | оксиды $O^{-2}$ | |
$2Na + O_2 = Na_2O_2$ | пероксиды $(O_2)^{-2}$ | только натрий |
$K + O_2 = KO_2$ | надпероксиды $(O_2)^{-2}$ | надпероксиды при горении образуют K, Rb, Cs |
| с водородом | ||
$Ca + H_2 = CaH_2$ | гидриды | щелочные металлы 0 при комнатной температуре; остальные металлы – при нагревании |
| с галогенами | ||
$2Fe + 3Cl_2 =2Fe^{+3}Cl_3$ | хлориды и др. | при взаимодействии с хлором и бромом (сильные окислители) железо и хром образуют хлориды в степени окисления +3 |
| с серой | ||
$Fe + S = FeS$ | сульфиды | при взаимодействии с серой и иодом железо приобретает степень окисления +2 |
| с азотом и фосфором | ||
$3Mg + N_2 = Mg_3N_2 $ | нитриды | * при комнатной температуре с азотом реагируют только литий и магний |
$3Ca + 2P = Ca_3P_2$ | фосфиды | |
| с углеродом | ||
$4Al + 3C = Al_4C_3$ | карбиды | |
| с водой | ||
$2Na^0 + 2H_2O = 2NaOH + H_2 $ | Основание + $H_2$ | щелочные металлы |
$ Zn^0 + H_2O = ZnO + H_2$ | Оксид + $H_2$ | среднеактивные металлы, при нагревании |
$Au, Ag, Pt+ H_2O /ne $ | не реагируют | неактивные металлы (после Н) |
| с окисдами менее активных металлов | ||
| $2Al + 3ZnO = Al_2O_3 + 2Zn$ | др оксид + др.металл | |
| с солями менее активных металлов | ||
$Fe+ CuSO_4 = Cu + FeSO_4$ | Др. соль + др. металл |
|
| $Cu + AlCl_3 ne$ | ||
| с кислотами | ||
$Fe + 2HCl = FeCl_2 + H_2 $ $6Na + 2H_3PO_4 = 2Na_3PO_4 + 3H_2 $ | Др. соль +водород | Металлы, стоящие в электрохимическом ряду напряжений до H реагируют с разбавленными кислотами (кроме $HNO_3$) |
$Cu + 2H_3PO_4 ne$ | ||
Источник

Металлы, это группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск. В данной статье все свойства металлов будут представлены в виде отдельных таблиц.
Содержание

Свойства металлов
Свойства металлов делятся на физические, химические, механические и технологические.
Физические свойства металлов
К физическим свойствам относятся: цвет, удельный вес, плавкость, электропроводность, магнитные свойства, теплопроводность, теплоемкость, расширяемость при нагревании.
Удельный вес металла — это отношение веса однородного тела из металла к объему металла, т.е. это плотность в кг/м3 или г/см3.
Плавкость металла — это способность металла расплавляться при определенной температуре, называемой температурой плавления.
Электропроводность металлов — это способность металлов проводить электрический ток, это свойство тела или среды, определяющее возникновение в них электрического тока под воздействием электрического поля. Под электропроводностью подразумевается способность проводить прежде всего постоянный ток (под воздействием постоянного поля), в отличие от способности диэлектриков откликаться на переменное электрическое поле колебаниями связанных зарядов (переменной поляризацией), создающими переменный ток.
Магнитные свойства металлов характеризуются: остаточной индукцией, коэрцетивной силой и магнитной проницаемостью.
Теплопроводность металлов — это их способность передавать тепло от более нагретых частиц к менее нагретым. Теплопроводность металла определяется количеством теплоты, которое проходит по металлическому стержню сечением в 1см2, длиной 1см в течение 1сек. при разности температур в 1°С.
Теплоемкость металлов — это количество теплоты, поглощаемой телом при нагревании на 1 градус. Отношение количества теплоты, поглощаемой телом при бесконечно малом изменении его температуры, к этому изменению единицы массы вещества (г, кг) называется удельной теплоёмкостью, 1 моля вещества — мольной (молярной).
Расширяемость металлов при нагревании.Все металлы при нагревании расширяются, а при охлаждении сжимаются. Степень увеличения или уменьшения первоначального размера металла при изменении температуры на один градус характеризуется коэффициентом линейного расширения.
Химические свойства металлов
К химическим — окисляемость, растворимость и коррозионная стойкость.
Окисление металлов — это реакция соединения металла с кислородом, сопровождающаяся образованием окислов (оксидов). Если рассмотреть окисляемость шире, то это реакции, в которых атомы теряют электроны и образуются различные соединения, например, хлориды, сульфиды. В природе металлы находятся в основном в окисленном состоянии, в виде руд, поэтому их производство основано на процессах восстановления различных соединений.
Растворимость металлов — это их способность образовывать с другими веществами однородные системы — растворы, в которых металл находится в виде отдельных атомов, ионов, молекул или частиц. Металлы растворяются в растворителях, в качестве которых выступают сильные кислоты и едкие щелочи. В промышленности наиболее часто используются: серная, азотная и соляные кислоты, смесь азотной и соляной кислот (царская водка), а также щелочи — едкий натр и едкий калий.
Коррозионная стойкость металлов — это их способность сопротивляться коррозии.
Механические свойства металлов
К механическим — прочность, твердость, упругость, вязкость, пластичность.
Прочностью металла называется его способность сопротивляться действию внешних сил, не разрушаясь.
Твердостью металлов называется способность тела противостоять проникновению в него другого, более твердого тела.
Упругость металлов — свойство металла восстанавливать свою форму после прекращения действия внешних сил, вызвавших изменение формы (деформацию).
Вязкость металлов — это способность металла оказывать сопротивление быстро возрастающим (ударным) внешним силам. Вязкость — свойство обратное хрупкости.
Пластичность металлов — это свойство металла деформироваться без разрушения под действием внешних сил и сохранять новую форму после прекращения действия сил. Пластичность—свойство обратное упругости.
Технологические свойства металлов
К технологическим — прокаливаемость, жидкотекучесть, ковкость, свариваемость, обрабатываемость резанием.
Прокаливаемость металлов – это их способность получать закаленный слой определенной глубины.
Жидкотекучесть металлов — это свойство металла в жидком состоянии заполнять литейную форму и воспроизводить ее очертания в отливке.
Ковкость металлов —это технологическое свойство, характеризующее их способность к обработке деформированием, например, ковкой, вальцеванием, штамповкой без разрушения.
Свариваемость металлов — это их свойство образовывать в процессе сварки неразъемное соединение, отвечающее требованиям, обусловленным конструкцией и эксплуатацией производимого изделия.
Обрабатываемость металлов резанием — это их способность изменять геометрическую форму, размеры, качество поверхности за счет механического срезания материала заготовки режущим инструментом. Обрабатываемость металлов зависит от их механических свойств, в первую очередь прочности и твердости.
Современными методами испытания металлов являются механические испытания, химический анализ, спектральный анализ, металлографический и рентгенографический анализы, технологические пробы, дефектоскопия. Эти испытания дают возможность получить представление о природе металлов, их строении, составе и свойствах, а также определить качество готовых изделий.
Таблицы свойств металлов
Таблица «Свойства металлов: Чугун, Литая сталь, Сталь»
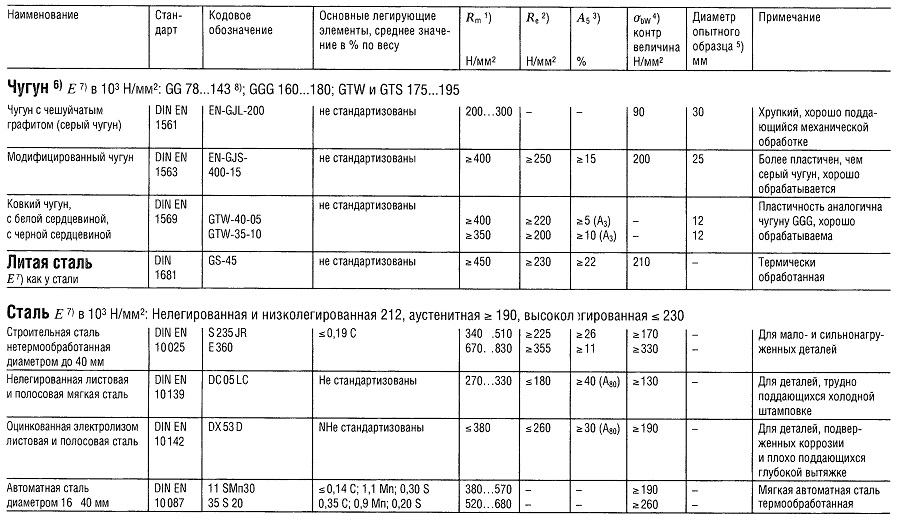
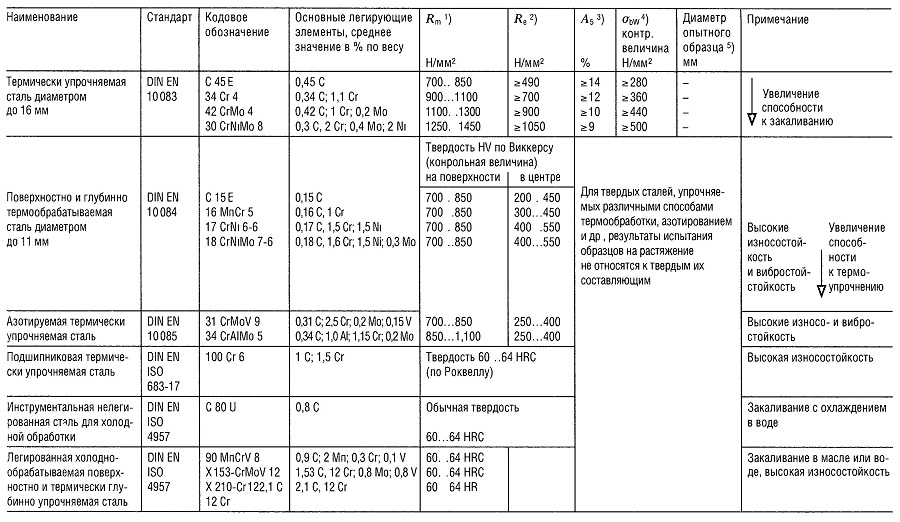
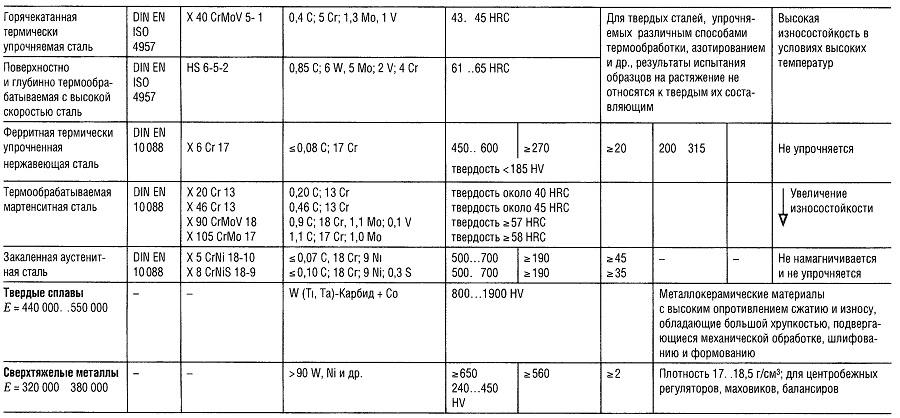
- Предел прочности на растяжение
- Предел текучести (или Rp 0,2);
- Относительное удлинение образца при разрыве;
- Предел прочности на изгиб;
- Предел прочности на изгиб приведен для образца из литой стали;
- Предел усталости всех типов чугуна, зависит массы и сечения образца;
- Модуль упругости;
- Для серого чугуна модуль упругости уменьшается с увеличением напряжения растяжения и остается практически постоянным с увеличением напряжения сжатия.
Таблица «Свойства пружинной стали»
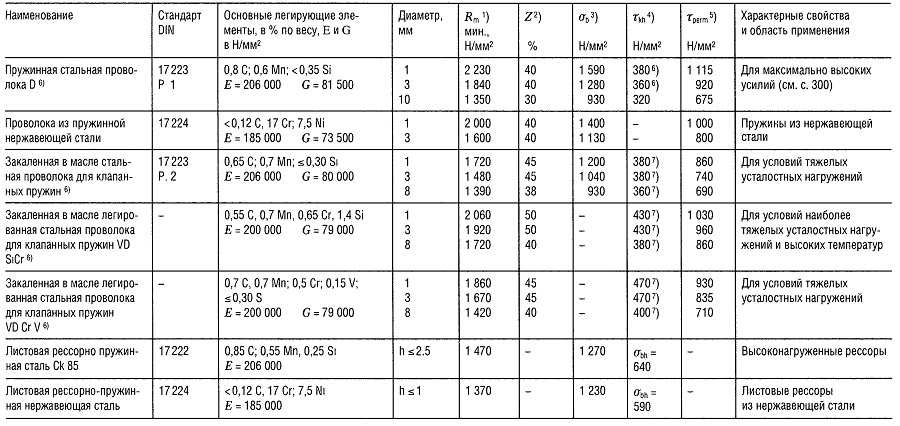
- Предел прочности на растяжение,
- Относительное уменьшение поперечного сечения образца при разрыве,
- Предел прочности на изгиб;
- Предел прочности при знакопеременном циклическом нагружении при N ⩾ 107,
- Максимальное напряжение при температуре 30°С и относительном удлинении 1 2% в течение 10 ч; для более высоких температур см. раздел «Способы соединения деталей»,
- см. раздел «Способы соединения деталей»;
- 480 Н/мм2 для нагартованных пружин;
- Приблизительно на 40% больше для нагартованных пружин
Таблица «Свойства кузовных тонколистовых металлов»
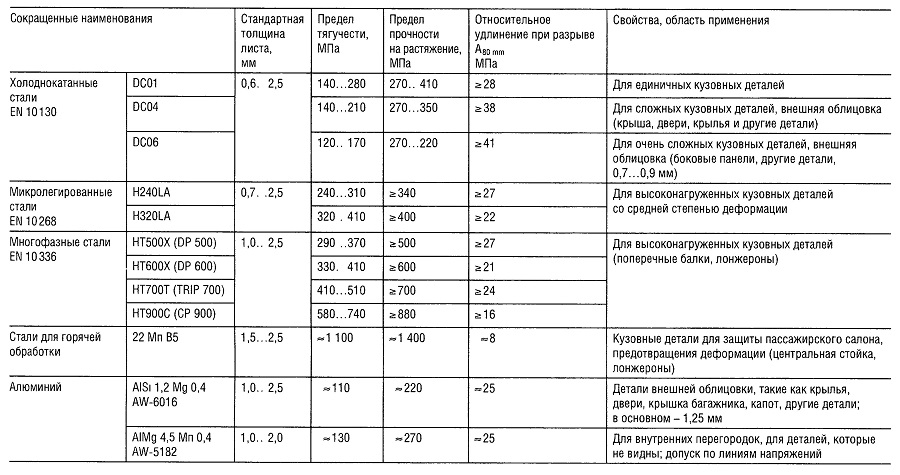
Таблица «Свойства цветных металлов»
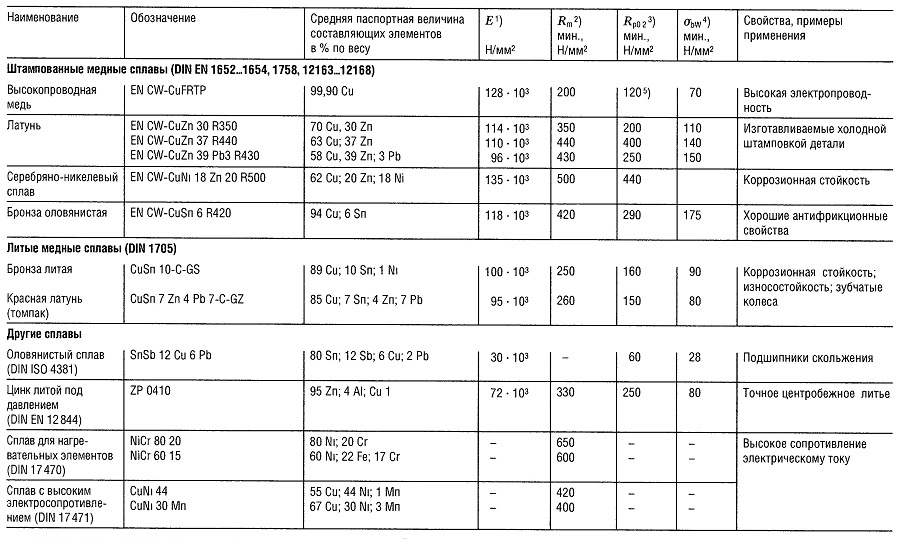
- Модуль упругости, справочные данные;
- Предел прочности на растяжение;
- Предел текучести, соответствующий пластической деформации 0,2%;
- Предел прочности на изгиб;
- Наибольшая величина;
- Для отдельных образцов
Таблица «Свойства легких сплавов»
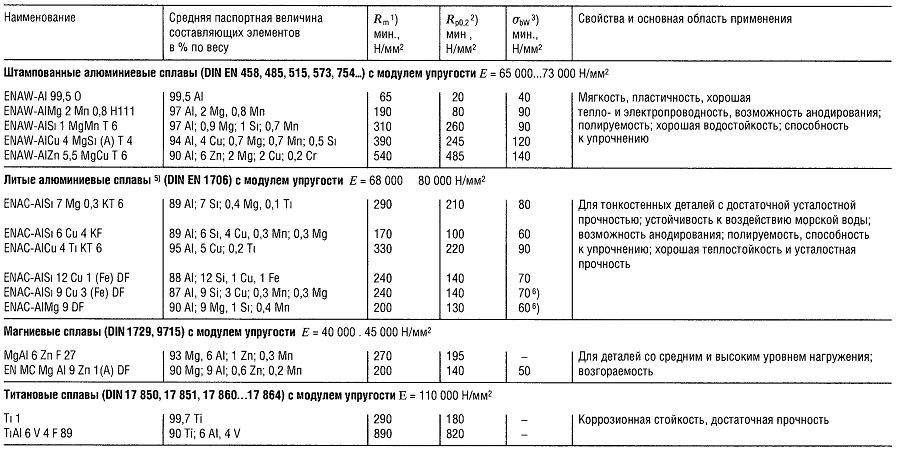
- Предел прочности на растяжение;
- Предел текучести, соответствующий пластической деформации 0,2%;
- Предел прочности на изгиб;
- Наибольшая величина;
- Показатели прочности приведены для образцов и для отливок;
- Показатели предела прочности на изгиб приведены для случая плоского нагружения
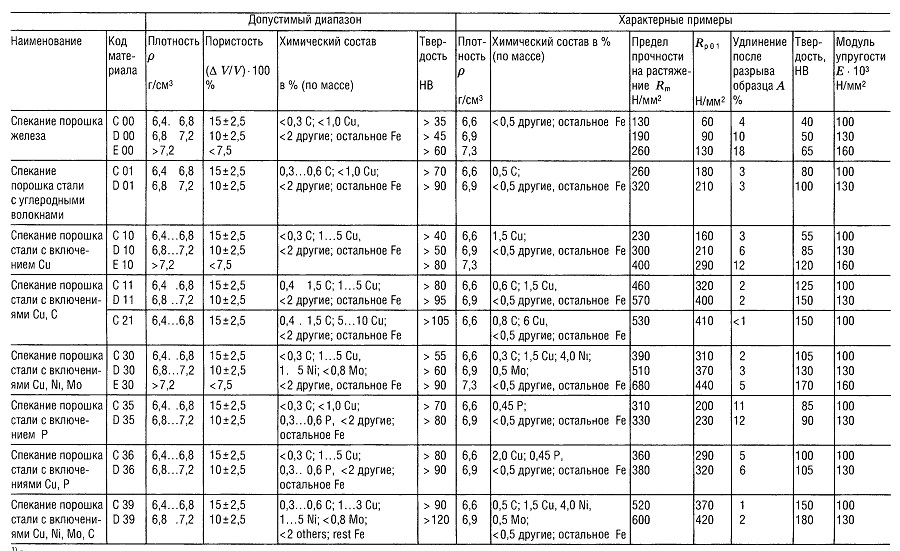
Таблица «Металлокерамические материалы (PM)1) для подшипников скольжения»
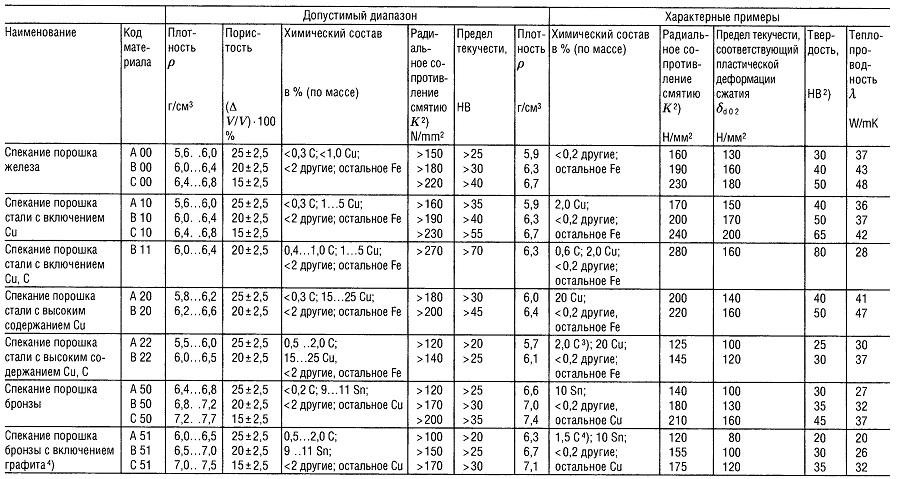
- В соответствии со стандартом DIN 30 910,1990 г. издания;
- Применительно к подшипнику 10/16 г 10;
- Углерод содержится, главным образом, в виде свободного графита;
- Углерод содержится только в виде свободного графита
Таблица «Свойства металлокерамических материалов (РМ)1 для конструкционных деталей»

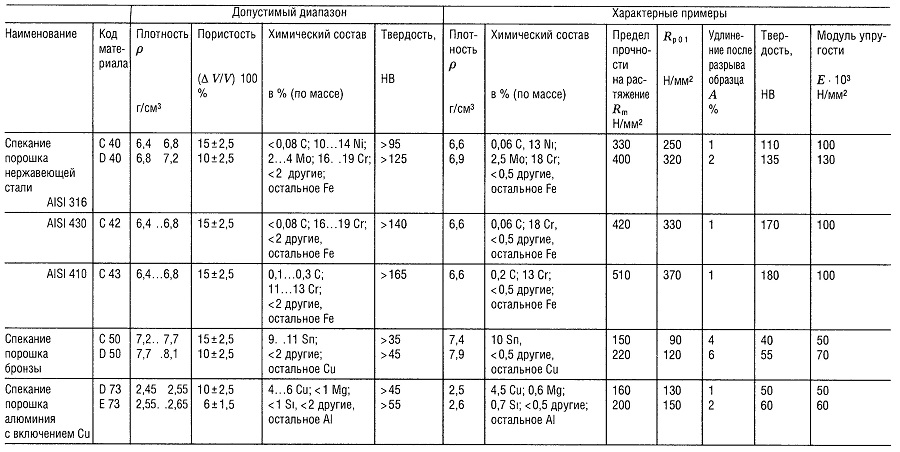
- В соответствии со стандартом DIN 30 910,1990 г. издания;
Магнитные материалы
Таблица «Свойства магнитомягких материалов»
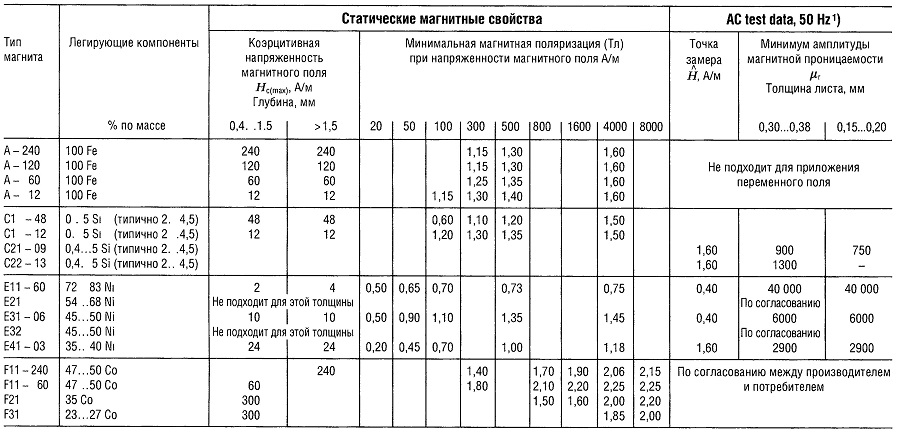
- Данные относятся только к магнитным кольцам.
Магнитомягкие металлы
Таблица «Свойства магнитной листовой и полосовой стали»
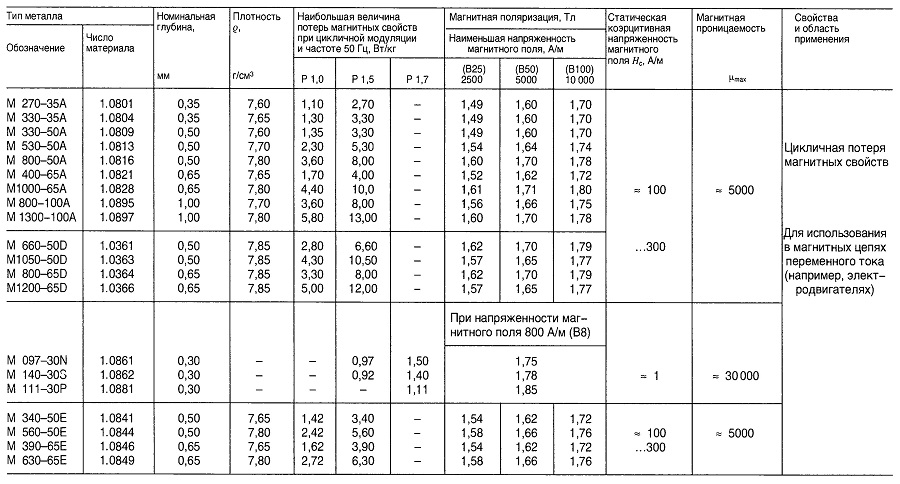
Материалы для преобразователей и электрических реакторов
Магнитная проницаемость листового сердечника для классов сплавов С21, С22, Е11, Е31 и Е41 для секции тонколистового сердечника EY11
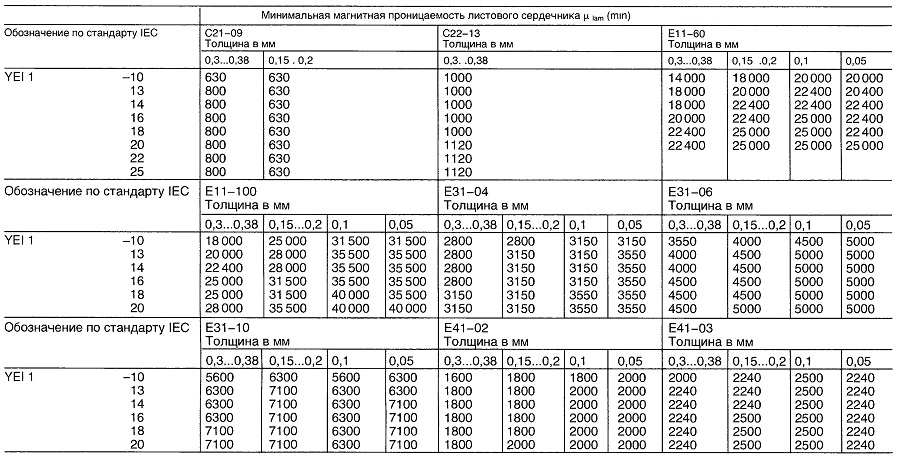
Материалы для реле постоянного тока
Таблица «Свойства материалов для реле постоянного тока»
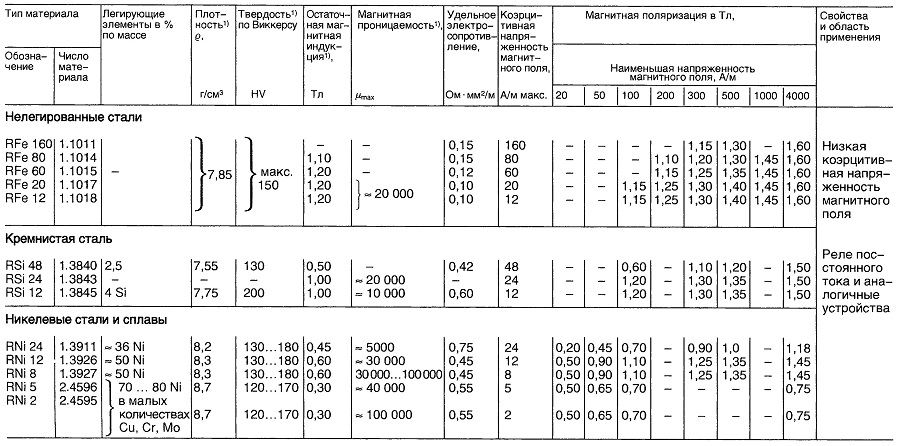
- Нормируемые величины
Металлокерамические материалы для магнитомягких компонентов
Таблица «Свойства металлокерамических материалов для магнитомягких компонентов»
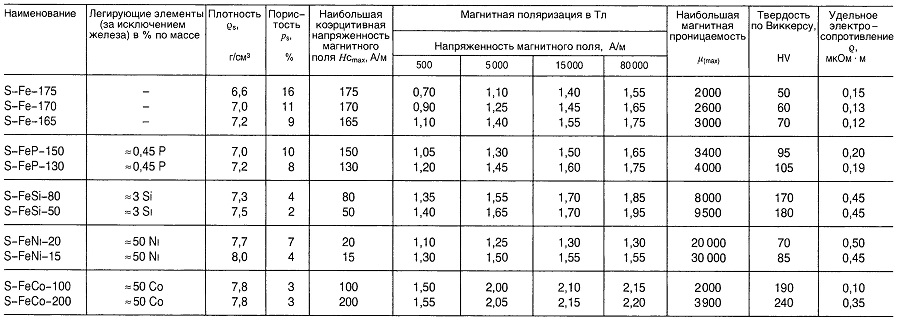
Магнитомягкие ферриты
Таблица «Свойства магнитомягких ферритов»

- Нормируемые величины;
- Потеря материалом магнитных свойств в зависимости от частоты при низкой плотности магнитного потока (В < 0,1 мТл);
- Потери магнитных свойств при высокой плотности магнитного потока; замеряются предпочтительно при f = 25 кГц, В = 200 мТл, Θ = 100°С;
- Магнитная проницаемость при строго синусоидальном магнитном поле; замеряется при f<; 25 кГц, В = 320 мТл, Θ = 100°С;
- Температура Кюри Θс, при которой начальная магнитная проницаемость μ, снижается ниже 10% от значения при температуре 25°С;
- Нормируемые величины.
Материалы для постоянных магнитов
Таблица «Свойства материалов для постоянных магнитов»
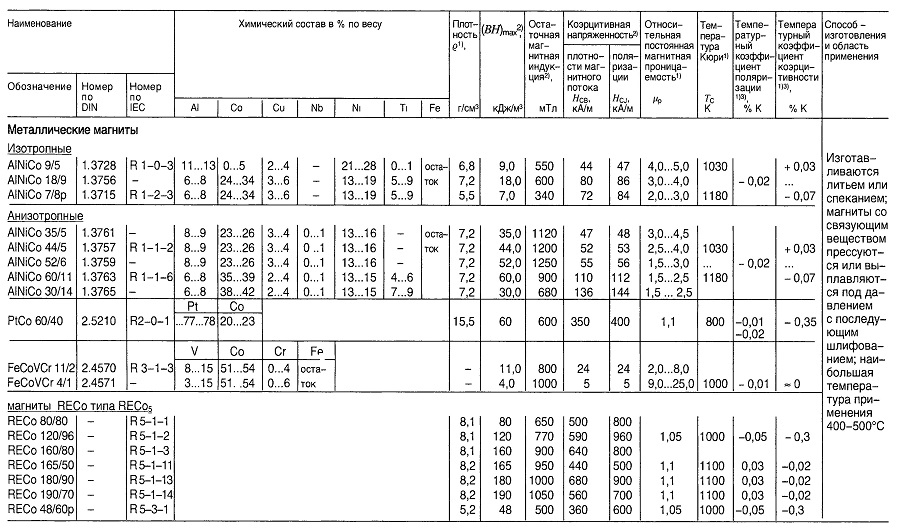
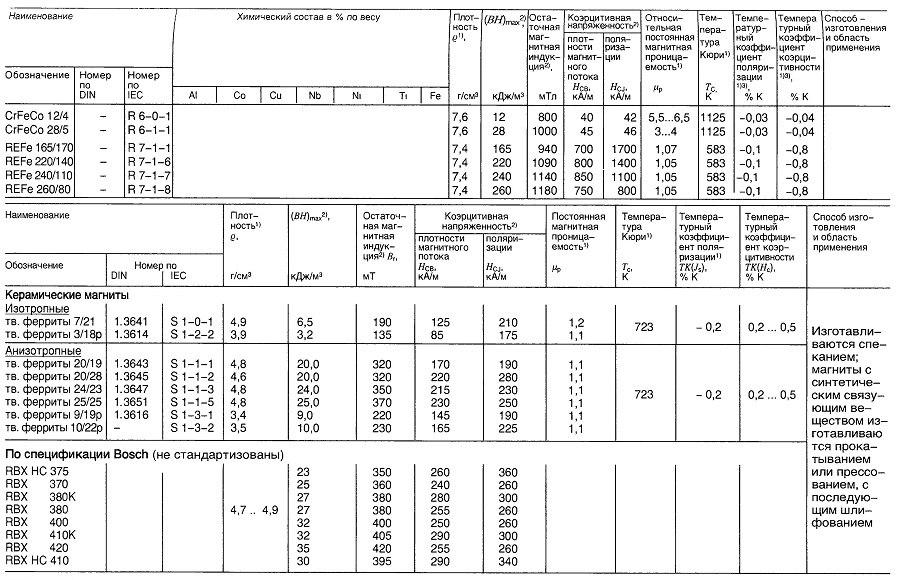
- Нормируемые величины;
- Наименьшее значение;
- В диапазоне температур 273…373 К.
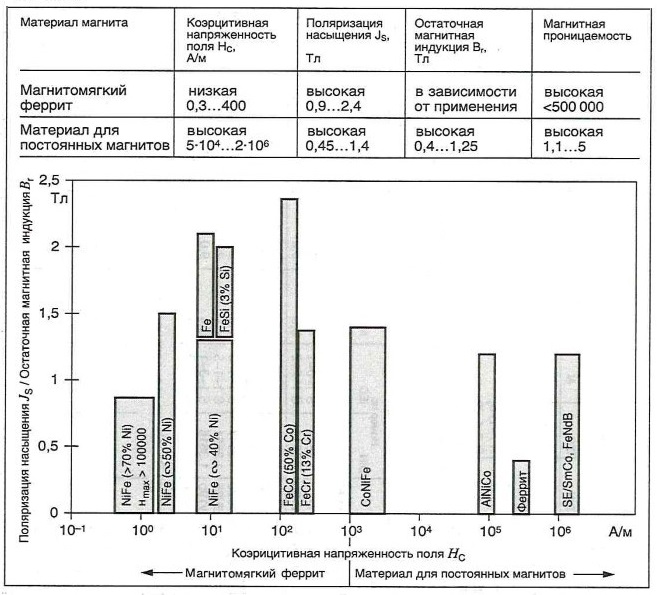
Сравнение материалов для постоянных магнитов и магнитомягких ферритов
Таблица «Диапазон магнитных характеристик некоторых широко используемых кристаллических материалов»
Материалы для пайки
Таблица «Свойства материалов для пайки»
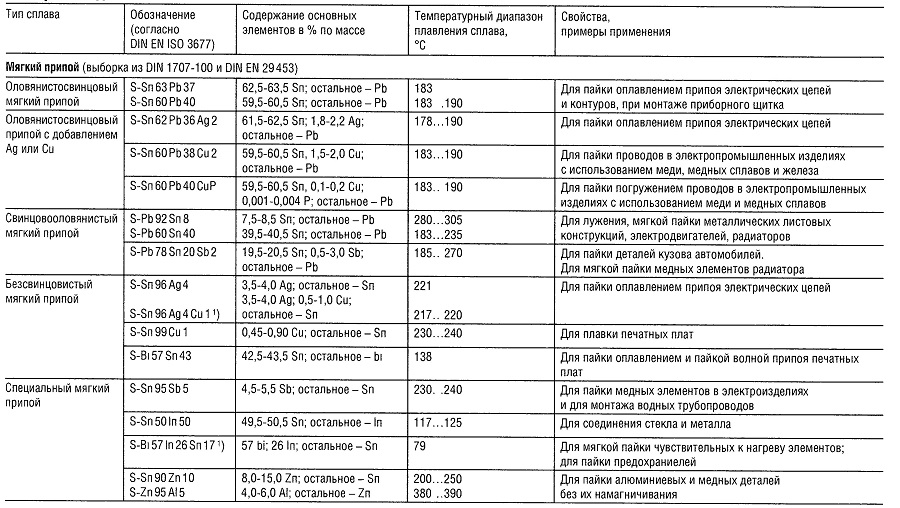
- Нет перечисленных в DIN 1707-100 или DIN EN 29453
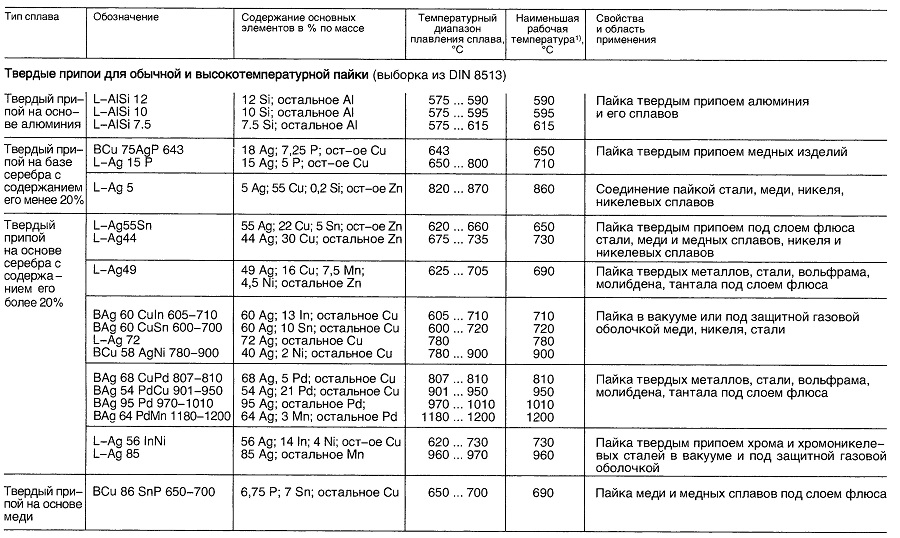
- В зависимости от выполняемой операции.
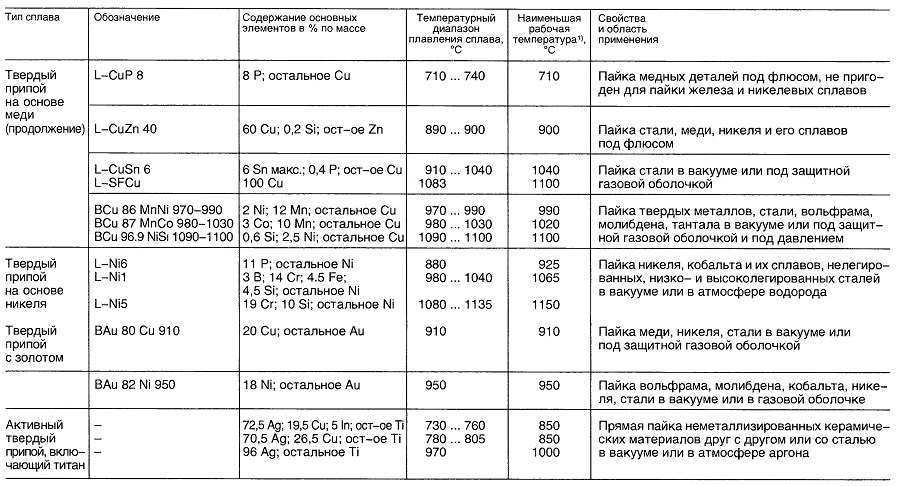
- В зависимости от выполняемых операций
В следующей статье я расскажу о бензине и дизельном топливе.
РЕКОМЕНДУЮ ЕЩЁ ПОЧИТАТЬ:
Источник
