Какие свойства металлов обусловлены кристаллическим строением

Металлы – особая группа элементов в периодической таблице Менделеева. В отличие от неметаллов элементы этой группы являются исключительно восстановителями с положительной степенью окисления, а также обладают пластичностью, твёрдостью, упругостью, что обусловлено кристаллическим строением металлов.

Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Отрицательно заряженные электроны держат на равном расстоянии положительно заряженные электроны, предавая кристаллической решётке правильную геометрическую форму.
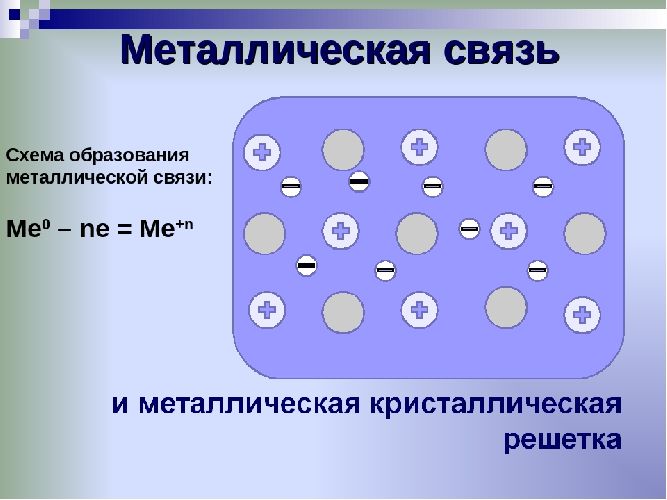
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Виды решёток
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
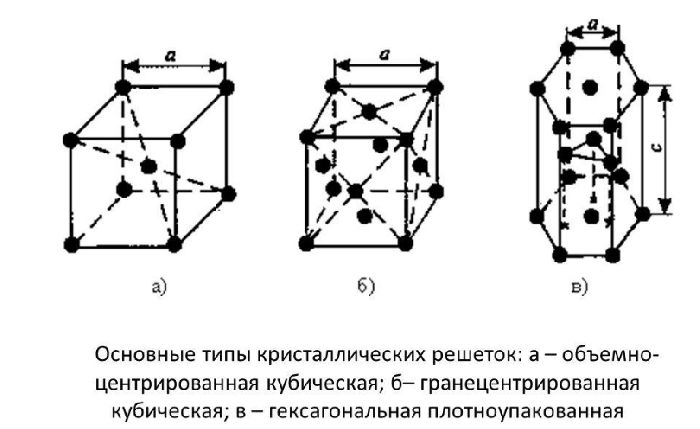
Рис. 2. Типы решёток.
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.
При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.
Рис. 3. Кристаллические ячейки составляют решётку.
Что мы узнали?
Узнали кратко об атомно-кристаллическом строении металлов. Металлы – твёрдые кристаллические вещества. Единицей решётки является элементарная кристаллическая ячейка. Благодаря металлическим связям ионы в узлах ячеек удерживаются на одинаковом расстоянии. Различают три типа кристаллических решёток – ОЦК, ГЦК и ГПУ, отличающихся количеством атомов и геометрической формой.
Тест по теме
Оценка доклада
Средняя оценка: 4.5. Всего получено оценок: 102.
Источник
Основные сведения о металлах и сплавах
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место.
Подтверждение этому: и в названиях эпох (золотой, серебряный, бронзовый, железный века), на которые греки делили историю человечества: и в археологических находках металлических изделий (кованые медные украшения, сельскохозяйственные орудия); и в повсеместном использовании металлов и сплавов в современной технике.
Причина этого – в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Железный век продолжается. Примерно 9/10 всех используемых человечеством металлов и сплавов – это сплавы на основе железа. Железа выплавляется в мире примерно в 50 раз больше, чем алюминия, не говоря уже о прочих металлах.
Было время, когда железо на земле ценилось значительно дороже золота. Советский историк Г. Арешян изучал влияние железа на древнюю культуру стран Средиземноморья. Он приводит такую пропорцию: 1 : 160 : 1280 : 6400. Это соотношение стоимостей меди, серебра, золота и железа у древних хеттов.
До настоящего времени основной материальной базой машиностроения служит черная металлургия, производящая стали и чугуны. Эти материалы имеют много положительных качеств и в первую очередь обеспечивают высокую конструкционную прочность деталей машин. Однако эти классические материалы имеют такие недостатки как большая плотность, низкая коррозионная стойкость. Потери от коррозии составляют 20% годового производства стали и чугуна. Поэтому, по данным научных исследований, через 20…40 лет все развитые страны перестроятся на массовое использование металлических сплавов на базе титана, магния, алюминия. Эти легкие и прочные сплавы позволяют в 2-3 раза облегчить станки и машины, в 10 раз уменьшить расходы на ремонт.
Кристаллическое строение металлов. Характерные свойства металлов. Виды кристаллических решеток, дефекты их строения.
Металлы – простые вещества, обладающие в обычных условиях характерными свойствами:
- специфический «металлический» блеск (хорошая отражательная способность и непрозрачность);
- высокая электропроводность;
- высокая теплопроводность;
- пластичность;
- отрицательный температурный коэффициент электропроводности (возрастание электросопротивления с повышением температуры).
Самыми распространенными в природе металлами являются алюминий, железо, кальций, натрий, калий, магний и титан.
Характерные свойства металлов обусловлены строением их атомов.
Из курса физики известно, что атом состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных частичек – электронов. В ядре атома находятся положительно заряженные частицы – протоны. Количество протонов равно количеству окружающих ядро электронов, т. е. атом в целом является электрически нейтральным.
Атом может терять или приобретать электроны. Тогда он превращается в электрически заряженный атом — ион. При избытке электронов ион заряжен отрицательно, при недостатке электронов — положительно.
Принадлежащие атому электроны разделяют на валентные (внешние), движущиеся по внешним орбитам, и внутренние, движущиеся по более близким к ядру орбитам.
Благодаря слабой связи внешних электронов с ядром в металлах всегда имеются электроны, подвергающиеся воздействию положительно заряженных ядер близлежащих атомов. Такие электроны называются свободными. Свободные электроны принадлежат не одному какому-либо ядру, а блуждают по всему металлу, вращаясь вокруг ядра то одного, то другого иона.
Наличием большого количества свободных электронов (называемых также коллективными или «электронный газ») и объясняются указанные выше характерные признаки металлов.
В отличие от металлов неметаллы, как правило, хрупки, лишены металлического блеска, имеют низкую тепло- и электропроводность. Электросопротивление неметаллов с повышением температуры понижается.
Все металлы в нормальных условиях являются твёрдыми телами (за исключением ртути) и представляют собой вещества, состоящие из большого числа мелких зёрен – кристаллов, упорядоченно расположенных друг относительно друга в пространстве. Этот порядок определяется понятием кристаллическая решётка.
Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Основными типами кристаллических решёток являются:
1) Объемно – центрированная кубическая (ОЦК) (см. рис.1 а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, Feα)
2) Гранецентрированная кубическая (ГЦК) (см. рис. 1 б), атомы располагаются в вершинах куба и по центру каждой из 6 граней (Cu, Al, Ag, Au, Feγ)
3) Гексагональная, в основании которой лежит шестиугольник:
простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости (цинк).
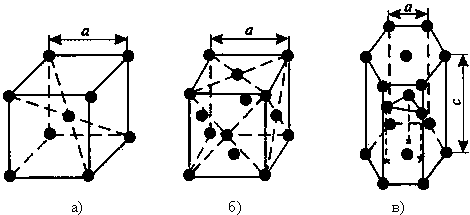
Рисунок 1 – Основные типы кристаллических решеток: а – объемно-центрированная кубическая;
б– гранецентрированная кубическая; в – гексагональная плотноупакованная
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропиейили полиморфизмом.
Примером аллотропического видоизменения в зависимости от температуры является железо (Fe): t<911°С – ОЦК – Feα; 911< t< 1392°С – ГЦК – Feβ; 1392< t> 1539°С – ОЦК – Feσ.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
В кристаллической решетке реальных металлов имеются различные дефекты (несовершенства), которые нарушают связи между атомами и оказывают влияние на свойства металлов. Различают точечные, линейные и поверхностные дефекты.
Одним из распространенных несовершенств кристаллического строения является наличие точечных дефектов: вакансий, дислоцированных атомов и примесей (рис. 2).
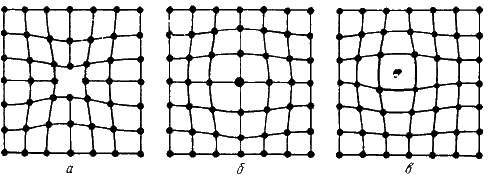
Рисунок 2 – Точечные дефекты
Вакансия – отсутствие атомов в узлах кристаллической решетки.
Дислоцированный атом – это атом, вышедший из узла решетки и занявший место в междоузлие.
Примесные атомы всегда присутствуют в металле, так как практически невозможно выплавить химически чистый металл. Они могут иметь размеры больше или меньше размеров основных атомов и располагаются в узлах решетки или междоузлиях.
Точечные дефекты вызывают незначительные искажения решетки, что может привести к изменению свойств тела (электропроводность, магнитные свойства), их наличие способствует процессам диффузии и протеканию фазовых превращений в твердом состоянии. При перемещении по материалу дефекты могут взаимодействовать.
Основными линейными дефектами являются дислокации.
Д  ислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. Простейшие виды дислокаций – краевые и винтовые.
ислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. Простейшие виды дислокаций – краевые и винтовые.
Рисунок 3 – Искажения в кристаллической решетке при наличии краевой дислокации
Плотность дислокации в значительной мере определяет пластичность и прочность материала. С увеличением плотности дислокаций возрастает внутреннее механическое напряжение, изменяются оптические свойства, повышается электросопротивление металла. Дислокации ускоряют старение и другие процессы, уменьшают химическую стойкость, поэтому в результате обработки поверхности кристалла специальными веществами в местах выхода дислокаций образуются ямки.
Источник
Все металлы и металлические сплавы — кристаллические тела: атомы (ионы) расположены в металлах закономерно, образуя пространственную кристаллическую решетку, характеризуемую наличием каркаса из малоподвижных положительно заряженных ионов, в промежутках которого движутся свободные электроны.
В пространстве атомы металлов располагаются в геометрически правильном порядке, соприкасаясь внешними электронными сферами.
Если через атомы в кристаллических решетках провести плоскости, то атомы в них будут располагаться в геометрически правильном порядке, образуя кристаллографические плоскости.
Наименьший объем металла, который характеризует атомно-кристаллическое строение всего объема, называется элементарной кристаллической ячейкой.
Кристаллические решетки металлов могут быть разных типов. Наиболее распространены решетки объемно центрированная кубическая (рис. 1.3, а, б), гранецентрированная кубическая (рис. 1.3, в, г), гексагональная плотноупакованная (рис. 1.4).
В объемно центрированной кубической решетке атомы расположены в вершинах куба и центре объема куба. Каждый угловой атом входит в восемь соседних ячеек, т.е. одной ячейке принадлежит от угловых атомов только У8 атома, лишь внутренний атом целиком принадлежит данной ячейке. Следовательно, на одну ячейку такой решетки приходится 8л/8 + 1 = 2 атома. Объемно центрированную кубическую решетку имеют металлы: Li, Na, К, V, Cr, Fe, Rb, Kb, Mo, W и др.
В гранецентрированной кубической решетке атомы расположены в вершинах и центрах каждой грани куба. На одну ячейку приходится 8л/8 + 6л/2 = 4 атома. Такую решетку имеют металлы: Al, Са, Ni, Си, Pb, Ag, Pt, Аи, Pd и др.
В гексагональной плотноупакованной решетке элементарная ячейка — шестигранная призма, в которой атомы находятся в вершинах и в центре оснований призмы, а также внутри призмы. На одну ячейку кристаллической решетки приходятся 6 атомов: 2 атома, лежащие в центре шестиугольников, входят в две соседние ячейки (2-1/2) — 1 атом, а 12 атомов, образующие вершины призмы, — в 6 соседних ячеек (12-‘/6) = 2 атома; 3 атома, лежащие внутри призмы, целиком принадлежат данной ячейке (3-1 = 3 атома). В гексагональной системе кристаллизуются Be, Ni, Cd, Ti, Co, Zn и другие металлы.

Рис. 1.3. Типы и ячейки кристаллических решеток в металле: а — объемно центрированная кубическая решетка; б — ячейка объемно центрированной кубической решетки; в — гранецентрированная кубическая решетка; г — ячейка гранецентрированной кубической решетки
На рис. 1.3 и 1.4 показано условное изображение кристаллических решеток. В действительности линий, соединяющих атомы в узлах решеток, нет. Атомы соприкасаются один с другим, так как только при этом условии возможен переход внешних электронов одного атома на внешние орбиты других атомов, что и представляет собой электронный газ. Если бы атомы находились на больших расстояниях один от другого, то никакого обмена внешними электронами не было. Различные типы кристаллических решеток имеют разную плотность упаковки атомов. В гранецентрированной кубической и гексагональной решетках атомы занимают 74 % всего объема кристаллической решетки, а межатомные промежутки («поры») 26 %. В объемно центрированной кубической решетке атомы занимают 68 % всего объема, а «поры» 32 %. Размеры кристаллической решетки характеризуются периодами (параметрами) решетки.

Рис. 1.4. Гексагональная плотноупакован- ная решетка
Периодом решетки называется расстояние между атомами по ребру элементарной ячейки, измеряемое в нанометрах (1 нм =
= 10-9 см = 0,1 °А). Период кубической решетки характеризуется длиной ребра куба и обозначается буквой а.
Для определения характеристики гексагональной решетки принимают два параметра — сторону шестигранника а и высоту призмы с. У гексагональной плот- ноупакованной решетки атомы упакованы наиболее плотно: отношение с/а = 1,633 (см. рис. 1.4). Некоторые металлы имеют гексагональную решетку с менее плотной упаковкой атомов {с/а > 1,633). Период решетки металлов а, кристаллизующихся в кубической системе, находится в пределах от 0,286 до 0,607 нм. Для металлов с гексагональной решеткой а лежит в пределах 0,228—0,398 нм, с в пределах 0,357— 0,652 нм.
Расстояние между соседними атомами (ионами) в разных направлениях кристаллической решетки различно. Так, в объемно центрированной кубической решетке расстояние между атомами по диагонали куба меньше, чем по ребру, а по ребру меньше, чем по диагонали грани. Элементарная кристаллическая ячейка характеризуется также координационным числом, под которым понимают число атомов, находящихся на наиболее близком равном расстоянии от избранного атома.
В объемно центрированной кубической решетке (рис. 1.5, а) атом А (в центре) находится в наиболее близком и равном расстоянии от восьми атомов, расположенных в вершине куба, т.е. координационное число для этой решетки равно 8 (К8).

Рис. 1.5. Координационное число в различных решетках для атома А: а — объемно центрированной кубической (К8); б — гранецентрированной кубической (К12); в – гексагональной плотноупакованной (Г12)
В гранецентрированной кубической решетке (рис. 1.5, б) атом А (на грани куба) находится в наиболее близком и равном расстоянии от четырех атомов 1,2,3, 4, которые расположены в вершинах куба, от четырех атомов 5, 6, 7, 8, расположенных на гранях куба, а также от четырех атомов 9, 10, 11, 12, принадлежащих расположенной рядом кристаллической ячейке. Атомы 9, 10, 11, 12 симметричны атомам 5, 6, 7, 8. Таким образом, для гранецентрированной кубической решетки координационное число равно 12 (К12).
В гексагональной плотноупакованной решетке при с/а = = 1,633 (рис. 1.5, в) атом А в центре шестигранного основания призмы находится на наиболее близком равном расстоянии от шести атомов 1, 2, 3, 4, 5, 6, размещенных в вершинах шестигранника, и от трех атомов 7, 8, 9, расположенных в средней плоскости призмы. Кроме того, атом А находится на таком же расстоянии еще от трех атомов 10,11, 12, которые принадлежат кристаллической ячейке, лежащей ниже основания. Атомы 10, 11, 12 симметричны атомам 7, 8, 9. Следовательно, для гексагональной плотноупакованной решетки координационное число равно 12 (Г12).
В гексагональной решетке с отношением осей с/а ф 1,633 на наиболее близком и равном расстоянии от атома А помещаются только шесть атомов 1, 2, 3, 4, 5, 6, а атомы 7, 8,9 и симметричные им 10, 11 и 12 находятся на несколько большем расстоянии. Поэтому для такой решетки координационное число равно 6 (Гб).
Кристаллографические плоскости. Расположение кристаллографических плоскостей в пространстве относительно выбранных осей координат определяется особыми индексами — целыми рациональными числами, значения которых обратны отрезкам, отсекаемым данной плоскостью на осях координат.
Для определения индексов кристаллографической плоскости нужно:
О определить отрезки, которые данная плоскость отсекает от осей координат (в единицах масштаба);
О найти обратные значения этих чисел;
О привести отношение этих трех обратных значений к соотношению трех простых целых чисел.
На рис. 1.6 показаны обозначения плоскостей в кубической объемно центрированной решетке.

Рис. 1.6. Атомные плоскости в кубической объемно центрированной решетке
Если плоскость пересекает только одну ось координат и параллельна двум другим осям (рис. 1.6, а), то отрезки соответственно равны:
О 1, ©о, оо — плоскость куба отсекает на оси х отрезок, равный единице, и пересекает оси у и z в бесконечности, т.е.
1 .I J_ = i о о-
л 5 5 А)
ОО СЮ
О оо, 1, оо — плоскость куба отсекает на оси у отрезок, равный единице, и пересекает оси х и z в бесконечности, т.е.
I 1 1=0 ю-
- 00 1 ОО
- 0 оо, оо, 1 — плоскость куба отсекает на оси z отрезок, равный единице, и пересекает оси хи у в бесконечности, т.е.—= 0, 0,1.
оо оо ]
Индексы плоскости пишут в круглых скобках и не разделяют запятыми: (100), (010), (001). Если плоскость отсекает на осях отрезки 1,1, 1 (рис. 1.6, б), то обратные значения отрезков
будут |, j, j, а индексы (111).
Если плоскость отсекает на осях х и у отрезки, равные еди- нице(1,1), и пересекает ось z в бесконечности °° (рис. 1.6, в), то
обратные значения отрезков равны -, , а индексы (110).
1 1 оо
В разных плоскостях кубической объемно центрированной решетки плотность атомов различна. Так, плоскость (100) имеет 4 атома, но каждый атом принадлежит одновременно четырем плоскостям, поэтому на долю каждой плоскости приходится
1 атом (У44). Плоскости (110) принадлежат 2 атома — 1 атом от угловых атомов (У44) и 1 атом находится в центре куба и целиком относится к данной плоскости. Следовательно, в плоскости (110) плотность атомов выше, чем в плоскости (100).
Анизотропия свойств кристаллов. Так как в разных плоскостях решетки плотность расположения атомов неодинакова, свойства кристаллов (механические, физические, химические) в разных направлениях различны. Разнообразие свойств кристаллов в зависимости от направления называется анизотропией. Все кристаллы анизотропны. Степень анизотропности свойств может быть значительной.
Свойства реальных металлов, которые состоят из большого числа по-разному ориентированных мелких анизотропных кристаллов (поликристаллов), во всех направлениях одинаковые (усредненные). Эта кажущаяся независимость свойств от направления называется квазиизотропией (ложной изотропией).
Источник
