Какие свойства металлов обуславливает металлическая связь
Металли́ческая связь — химическая связь между атомами в металлическом кристалле, возникающая за счёт перекрытия (обобществления) их валентных электронов. Металлическая связь описывается многими физическими свойствами металлов, такими как прочность, пластичность, теплопроводность, удельное электрическое сопротивление и проводимость, непрозрачность и блеск[1][2][3][4].
Механизм металлической связи[править | править код]
В узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся электроны проводимости, происходящие из атомов металлов при образовании ионов. Эти электроны играют роль «цемента», удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Когда металл принимает какую-либо форму или растягивается, он не разрушается, потому что ионы в его кристаллической структуре довольно легко смещаются относительно друг друга[5]. Силы связи не локализованы и не направлены. В металлах в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).
Рис. 1. Расположение ионов в кристалле щелочного металла
Так, щелочные металлы кристаллизуются в кубической объёмно-центрированной решётке, и каждый положительно заряженный ион щелочного металла имеет в кристалле по восемь ближайших соседей — положительно заряженных ионов щелочного металла (рис. 1). Кулоновское отталкивание одноимённо заряженных частиц (ионов) компенсируется электростатическим притяжением к электронам связывающих звеньев, имеющих форму искажённого сплющенного октаэдра — квадратной бипирамиды, высота которой и рёбра базиса равны величине постоянной решётки aw кристалла щелочного металла (рис. 2).
Связывающие электроны становятся общими для системы из шести положительных ионов щелочных металлов и удерживают последние от кулоновского отталкивания.
Величина постоянной трансляционной решётки aw кристалла щелочного металла значительно превышает длину ковалентной связи молекулы щелочного металла, поэтому принято считать, что электроны в металле находятся в свободном состоянии:
| Щелочной металл | Li | Na | K | Rb | Cs |
|---|---|---|---|---|---|
| Постоянная решётки aw, Å[6] | 3,502 | 4,282 | 5,247 | 5,690 | 6,084 |
| Длина ковалентной связи для Me2, Å[7] | 2,67 | 3,08 | 3,92 | 4,10 | 4,30 |
Математическое построение, связанное со свойствами свободных электронов в металле, обычно отождествляют с «поверхностью Ферми», которую следует рассматривать как геометрическое место в k-пространстве, где пребывают электроны, обеспечивая основное свойство металла — проводить электрический ток[8]. Таким образом, электрический ток в металлах — это движение сорванных с орбитального радиуса электронов в поле положительно заряженных ионов, находящихся в узлах кристаллической решётки металла. Выход и вход свободных электронов в связывающее звено кристалла осуществляется через точки «0», равноудалённые от положительных ионов атомов (рис. 2).
Свободное движение электронов в металле подтверждено в 1916 году опытом Толмена и Стюарта по резкому торможению быстро вращающейся катушки с проводом — свободные электроны продолжали двигаться по инерции, в результате чего гальванометр регистрировал импульс электрического тока. Свободное движение электронов в металле обусловливает высокую теплопроводность металла и склонность металлов к термоэлектронной эмиссии, происходящей при умеренной температуре.
Колебание ионов кристаллической решётки создаёт сопротивление движению электронов по металлу, сопровождающееся разогревом металла. В настоящее время важнейшим признаком металлов считается положительный температурный коэффициент электрической проводимости, то есть понижение проводимости с ростом температуры. С понижением температуры электросопротивление металлов уменьшается, вследствие уменьшения колебаний ионов в кристаллической решётке. В процессе исследования свойств материи при низких температурах Камерлинг-Оннес открывает явление сверхпроводимости. В 1911 году ему удаётся обнаружить уменьшение электросопротивления ртути при температуре кипения жидкого гелия (4,2 К) до нуля. В 1913 году Камерлинг-Оннесу присуждается Нобелевская премия по физике со следующей формулировкой: «За исследование свойств веществ при низких температурах, которые привели к производству жидкого гелия».
Однако теория сверхпроводимости была создана позднее. В её основе лежит концепция куперовской электронной пары — коррелированного состояния связывающих электронов с противоположными спинамии и импульсами, и, следовательно, сверхпроводимость можно рассматривать как сверхтекучесть электронного газа, состоящего из куперовских пар электронов, через ионную кристаллическую решётку. В 1972 году авторам теории БКШ — Бардину, Куперу и Шрифферу присуждена Нобелевская премия по физике «За создание теории сверхпроводимости, обычно называемой БКШ-теорией».
Характерные кристаллические решётки[править | править код]
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства[править | править код]
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Многие металлы обладают высокой твёрдостью, например хром, молибден, тантал, вольфрам и др. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
Примечания[править | править код]
Источник
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Механизм металлической связи
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены.
Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8). Когда два атома металла сближаются, орбитали их внешних оболочек перекрываются, образуя молекулярные орбитали. Если подходит третий атом, его орбиталь перекрывается с орбиталями первых двух атомов, что дает еще одну молекулярную орбиталь. Когда атомов много, возникает огромное число трехмерных молекулярных орбиталей, простирающихся во всех направлениях. Вследствие многократного перекрывания орбиталей валентные электроны каждого атома испытывают влияние многих атомов.
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt,Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей. Также важным свойством является металлическая ароматичность.
Металлы хорошо проводят тепло и электричество, они достаточно прочны, их можно деформировать без разрушения. Некоторые металлы ковкие (их можно ковать), некоторые тягучие (из них можно вытягивать проволоку). Эти уникальные свойства объясняются особым типом химической связи, соединяющей атомы металлов между собой – металлической связью.
Металлы в твердом состоянии существуют в виде кристаллов из положительных ионов, как бы “плавающих” в море свободно движущихся между ними электронов.
Металлическая связь объясняет свойства металлов, в частности, их прочность. Под действием деформирующей силы решетка металла может изменять свою форму, не давая трещин, в отличие от ионных кристаллов.
Высокая теплопроводность металлов объясняется тем, что если нагреть кусок металла с одной стороны, то кинетическая энергия электронов увеличится. Это увеличение энергии распространится в “ электронном море” по всему образцу с большой скоростью.
Становится понятной и электрическая проводимость металлов. Если к концам металлического образца приложить разность потенциалов, то облако делокализованных электронов будет сдвигаться в направлении положительного потенциала: этот поток электронов, движущихся в одном направлении, и представляет собой всем знакомый электрический ток.
Источник
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов – металлическую, ионную и водородную, свойственную кристаллам льда.
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
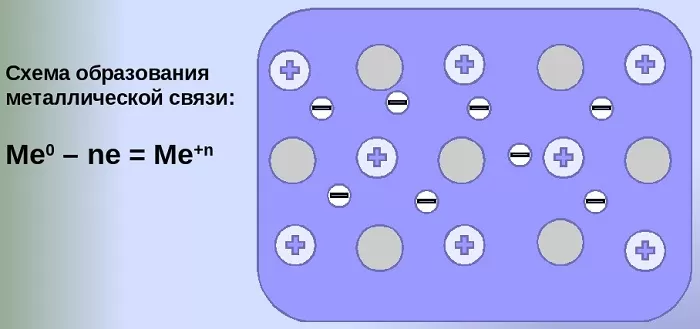
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
Me – ne⁻ ⇆ Me,
здесь n – число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения – атом металла, отдающий электроны, в правой – образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
- K – e⁻ ⇆ K;
- Cu – 2e⁻ ⇆ Cu;
- Al – 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
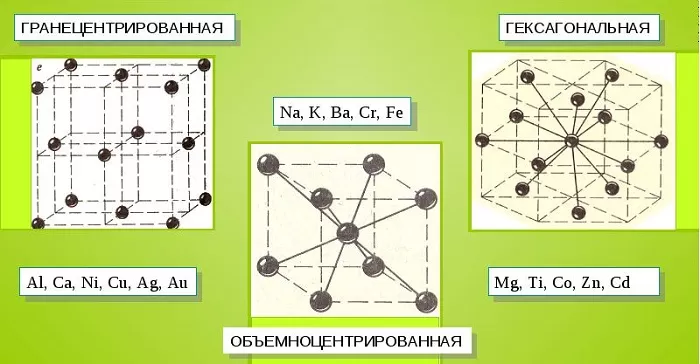
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni – в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
пластичность – большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.

Их общие черты:
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью – поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Источник
Атомы в молекуле удерживаются посредством химической связи. Если молекула состоит из разных атомов (KF, Na2S, CO2, H2O), то речь идёт о ковалентной полярной (случай, когда в молекулу входят атомы неметаллов) или ионной связи (случай, когда молекула состоит из атома металла и атома неметалла). Если мы имеем дело с молекулой, состоящей из атомов неметалла одного вида (О2, N2, Br2), то в этом случае имеет место ковалентная неполярная связь. А как же связаны атомы в металлах, например, в натрии Na, кальции Са или алюминии Al?
Фото: livemaster.ru
Металлическая связь
Составляющие металл атомы удерживаются в единой структуре посредством химической связи. Не будь её, не существовало бы кристаллов. И эта связь носит название металлическая.
Металлическая связь – это связь, возникающая в результате обобществления электронов, находящихся на внешних электронных слоях атомов.
Чтобы понять это довольно сложно определение, посмотрим пример. Но для начала вспомним, как построены атомы металлов. В таблице Менделеева элементы-металлы располагаются в левом нижнем углу (мы говорим о главных подгруппах). У атомов металлов на внешнем электронном слое мало электронов. Кроме того, чем ниже мы опускаемся по группе в периодической таблице, тем больше становится радиус атома. Это означает, что на внешний слой всё дальше от ядра (напомню, что ядро атома имеет положительный заряд). Из-за этого электроны на внешнем уровне все меньше притягиваются к ядру. Малое число электронов и их удалённость от ядра позволяют им с лёгкостью отрываться от атома. При этом, как вы помните, атом превращается в ион, в данном случае в катион:
Me – 1e- → Me+1
Здесь Me – произвольный металл, с одним электроном на внешнем электронном уровне. В случае, если на внешнем электронном уровне несколько электронов, схема выглядит так:
Me – ne- → Me+n
Здесь n – число валентных электронов. Например, для кальция, стоящего во второй группе таблицы Менделеева и имеющего 2 электрона не внешнем уровне, схема такова:
Са – 2e- → Са+2
Для алюминия, стоящего в третьей и группе и имеющего 3 электрона на внешнем уровне, мы можем записать такую схему:
Al – 3e- → Al+3
Тут уместно задаться вопросом, а куда же деваются эти самые оторвавшиеся от атомов электроны? Они никуда не исчезают, а просто перемещаются от одного атома к другому. «Найдя» катион, электрон просто временно присоединяется к нему, чтобы тут же оторваться и отправиться в новое путешествие между атомами в поисках нового катиона. Фактически образуется эдакая динамическая система, в которой есть атомы и катионы металлов и курсирующие между ними электроны, которые то и дело присоединяются и отрываются, превращая катионы в атомы и атомы в катионы:
Me – ne- ⇄ Me+n
За счёт чего удерживается эта структура? За счёт электростатического взаимодействия, то есть притяжения отрицательно и положительно заряженных частиц.
Чтобы представить себе это более чётко, вообразите структуру из катионов, которая погружена в своеобразный «газ» из электронов. Это и есть металлическая связь. Подобным образом построены все металлы и их сплавы, когда они находятся в твёрдом или расплавленном состоянии.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник
