Какие свойства металлов лежат в основе образных литературных

Глава 2. Металлы
Из курса химии 9 класса вы уже имеете представление о природе химической связи, существующей в кристаллах металлов, — металлической связи. Напомним, что в узлах металлических кристаллических решёток располагаются атомы и положительные ионы металлов, связанные посредством обобществлённых внешних электронов, принадлежащих всему кристаллу. Эти электроны компенсируют силы электростатического отталкивания между положительными ионами и тем самым связывают их, обеспечивая устойчивость металлической решётки.
Металлическая связь обусловливает все важнейшие физические свойства металлов: пластичность, электро- и теплопроводность, металлический блеск и другие свойства, характерные для этого класса простых веществ.
Пластичность — это свойство вещества изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия.
Способность расплющиваться от удара или вытягиваться в проволоку под действием силы составляет важнейшее механическое свойство металлов. Оно лежит в основе такой уважаемой большинством народов мира профессии, как профессия кузнеца. Недаром покровителем кузнечного дела у разных народов был бог огня: у греков — Гефест, у римлян — Вулкан, у славян — Сварог.
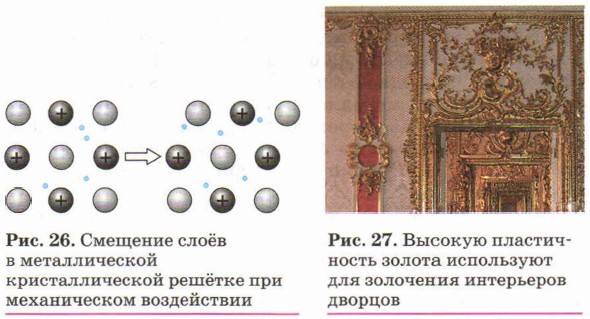
Пластичность металлов обусловлена способностью одних слоёв атом-ионов в кристаллах под внешним воздействием легко смещаться (как бы скользить) по отношению к другим слоям без разрыва связей между ними (рис. 26). Наиболее пластичны золото, серебро и медь. Например, из золота можно изготовить «золотую фольгу» толщиной 0,003 мм, которую используют для золочения изделий (рис. 27).
Высокая электропроводность большинства металлов обусловлена присутствием в их кристаллических решётках подвижных электронов, которые направленно перемещаются под действием электрического поля (рис. 28).
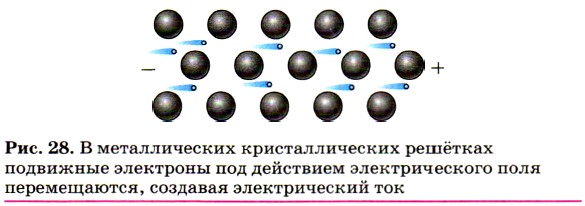
При нагревании колебательные движения ионов в кристалле усиливаются, что затрудняет направленное движение электронов и ведёт к снижению электрической проводимости. При охлаждении электропроводность металлов увеличивается и вблизи абсолютного нуля переходит в сверхпроводимость. Наибольшую электропроводность имеют серебро и медь, наименьшую — марганец, свинец, ртуть и вольфрам.
Такое свойство, как теплопроводность металлов, также связано с высокой подвижностью свободных электронов: сталкиваясь с колеблющимися в узлах решётки ионами, электроны обмениваются с ними энергией. С повышением температуры колебания ионов при посредстве электронов передаются другим ионам, и температура всего металлического предмета быстро выравнивается.
Для гладкой поверхности металлов характерен металлический блеск — результат отражения световых лучей. В порошкообразном состоянии большинство металлов теряет блеск, приобретая чёрную или серую окраску, и только алюминий и магний сохраняют блеск в порошке. Из алюминия, серебра и палладия, обладающих наиболее высокой отражательной способностью, изготовляют зеркала, в том числе и применяемые в прожекторах.
Для большинства металлов характерен белый или серый цвет. Золото и медь окрашены соответственно в жёлтый и жёлто-красный цвет.
Из других физических свойств металлов наибольший практический интерес представляют твёрдость, плотность и температура плавления.
Для большинства металлов характерен белый или серый цвет. Золото и медь окрашены соответственно в жёлтый и жёлто-красный цвет.
Из других физических свойств металлов наибольший практический интерес представляют твёрдость, плотность и температура плавления.
Для всех металлов (кроме ртути) при обычных условиях характерно твёрдое агрегатное состояние. Однако твёрдость их различна. Наиболее твёрдые — металлы побочной подгруппы VI группы (VIB группы) Периодической системы Д. И. Менделеева. Так, хром по твёрдости приближается к алмазу. Самые мягкие — металлы главной подгруппы I группы (IA группы) Периодической системы Д. И. Менделеева — щелочные металлы. Например, натрий и калий легко режутся ножом.

По плотности металлы делят на лёгкие (плотность меньше 5 г/см3) и тяжёлые (плотность больше 5 г/см3). К лёгким относят щелочные, щёлочноземельные металлы и алюминий. Из переходных металлов сюда включают скандий, иттрий и титан. Эти металлы, благодаря лёгкости и тугоплавкости, всё шире применяют в различных областях техники.
Самый лёгкий металл — это литий (р = 0,53 г/см3). Самый тяжёлый — осмий (р = 22,6 г/см3).
Лёгкие металлы обычно легкоплавки, галлий может плавиться уже на ладони руки, а тяжёлые металлы — тугоплавки. Наибольшей температурой плавления, которая равна 3380 °С, обладает вольфрам. Это свойство вольфрама используют для изготовления ламп накаливания (рис. 29, 2). Кроме него в конструкцию лампы входят ещё семь металлов.
В Российской Федерации в настоящее время, как и ранее в Евросоюзе и США, на государственном уровне принято решение о замене привычных ламп накаливания на более экономичные и долговечные современные лампы, например галогенные, люминесцентные и светодиодные. Галогенная лампа (рис. 29, 2) — это та же лампа накаливания с вольфрамовой нитью, заполненная инертными газами с добавкой паров галогенов (брома или иода).

Люминесцентные (рис. 29, 3) — это хорошо знакомые вам лампы дневного света, имеющие один существенный недостаток — они содержат ртуть, а потому нуждаются в соблюдении особых правил утилизации на специальных пунктах приёма. Светодиодные лампы (рис. 29, 4) — самые экономичные и самые долговечные (срок работы до 100 тыс. ч), но пока и самые дорогие из ламп.
В технике, как вы уже знаете, металлы делят на чёрные (железо и его сплавы) и цветные (все остальные, более подробно о них будет рассказано в следующем параграфе) (рис. 30). Золото, серебро, платину и некоторые другие металлы относят к драгоценным металлам (рис. 31). 1


1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.

1. Назовите самый легкоплавкий металл.
2. Какие физические свойства металлов используют в технике?
3. Фотоэффект, т. е. свойство металлов испускать электроны под действием лучей света, характерен для щелочных металлов, например для цезия. Почему? Где это свойство находит применение?
4. Какие физические свойства вольфрама лежат в основе его применения в лампах накаливания?
5. Какие свойства металлов лежат в основе образных литературных выражений: «серебряный иней», «золотая заря», «свинцовые тучи»?
- Физические свойства металлов. Ответы
Источник
![]()
Какие свойства металлов лежат в основе образных литературных выражений: «серебряный иней», «золотая заря», «свинцовые тучи»?
1 ответ:
![]()
1
0
В этих выражениях в основном используется окраска металлов, то есть та часть излучения которая отражается металлом в видимом диапазоне света. Серебро отражает практически весь видимый спектр, что используется в производстве зеркал и придает серебру белую окраску. Золото часть излучения поглощает, поэтому мы видим желтый цвет, с которым и сравнивается заря. Свинец из-за оксидной пленки равномерно поглощает все длины видимого света, но не полностью, что воспринимается нами как серая окраска, которая и упоминается в фразе “свинцовые тучи”.
Читайте также
![]()
Плотность (кг/м3):
Алюминий-2712
Алюминий жидкий – 2560 – 2640
Бериллий – 1840
Ванадий – 5494
Вольфрам – 19600
Дельта металл – 8600
Железо – 7850
Желтая латунь – 8470
Золото – 19320
Фосфористые бронзы – 8780 – 8920
Ковкий чугун – 7750
Кобальт – 8746
Легкие сплавы алюминия – 2560 – 2800
Легкие сплавы магния – 1760 – 1870
Магний – 1738
Марганцовистая бронза – 8359
Медь – 8930
Мельхиор – 8940
Молибден – 10188
Монель – 8360 – 8840
Нержавеющая сталь – 7480 – 8000
Никель – 8800
Нейзильбер – 8400 – 8900
Олово – 7280
Платина – 21400
Плутоний – 19816
Ртуть – 13593
Серебро -10490
Свинец – 11340
Свинцовые бронзы -7700 – 8700
Титан – 4500
Углеродистая сталь – 7850
Уран – Uranium 18900
Хастелой – 9245
Цинк – 7135
Чугуны – 6800 – 7800
Электрум (сплав золота с серебром, 20% Au) – 8400 – 8900
![]()
ТОРИЙ МЕТАЛЛИЧЕСКИЙ-Компактный свежеприготовленный торий – металл серебристо-белого цвета, однако при выдерживании на воздухе становится темно-серым. Отношение тория к воздуху определяется степенью его измельчения, а также содержанием в нем оксида. Наиболее чистые образцы содержат несколько десятых процента оксида тория, который может быть в металле как таковой или в виде низшего оксида.Образцы с малым содержанием оксида быстро тускнеют, становятся серыми и в конце концов, чёрными, в то время как образцы с высоким содержанием оксида (1,5-2%), устойчивы на воздухе и сохраняют свой серебристый блеск месяцами. Порошок тория пирофорен на воздухе, поэтому его хранят под слоем керосина. Устойчив по
отношению к воде до 100оС.
![]()
В основном в структуре металла и его физико- механических свойствах .
Например, металл холодного проката имеет более высокие прочностные характеристики за счёт явления наклёпа – уплотнения материала при холодной обработке.
Это явление отсутствует при горячем прокате.
![]()
Не только Витрум. Все витамины аптечные, зарегистрированные как лекарственные препараты, можно считать синтетическими.
Разве что рутин (вит. Р) получают их отходов – шелухи гречихи, чайной пыли… Остальные – искусственные, аналогичные природным, синтетически, полусинтетически и др.
Даже рыбий жир, если на этикетке “витаминизированный”, добавляют туда вит. А и Д.
Из природных аптечных могу назвать Сироп шиповника (вит.С), плоды шиповника, плоды рябины, некоторые БАД.
![]()
Основная ценность плодов шиповника в том, что аскорбиновой кислоты в них содержится примерно в 10 раз больше (1,2 г/100 г), чем в чёрной смородине, и в 50! раз больше, чем в лимонах.
Поэтому шиповник можно смело принимать так же, как и витамин С.
- Для профилактики авитаминоза
- При высоких нагрузках (умственных и физических)
- При беременности и кормлении грудью
- При выздоровлении после тяжёлой болезни
Противопоказаниями к употреблению шиповника являются:
- Повышенная свёртываемость крови
- Тромбофлебит
- Сахарный диабет
Источник
