Какие свойства элементов называют электроотрицательностью

Все известные химические элементы можно разделить на металлы и неметаллы.
Металлы — элементы, атомы которых способны отдавать электроны.
Неметаллы — элементы, атомы которых могут принимать электроны.
При взаимодействии металла с неметаллом атом первого теряет электроны, а атом второго их присоединяет.
А что происходит, если взаимодействуют атомы двух неметаллов?
Сравним атомы серы и кислорода:
O8 +8 2e, 6e;
S16 +16 2e, 8e, 6e.
Радиус атома серы больше, валентные электроны слабее связаны с ядром. При образовании связи произойдёт сдвиг электронов от серы к кислороду.
Сравним атомы углерода и кислорода:
O8 +8 2e, 6e;
C6 +6 2е, 4е.
Заряд ядра атома кислорода больше, и притягивать к себе электроны он будет сильнее.
Значит, атомы разных неметаллов притягивают к себе электроны неодинаково.
Способность атомов элементов оттягивать к себе общие электронные пары в химических соединениях называется электроотрицательностью (ЭО).
Так как общие электронные пары образуются валентными электронами, то можно сказать, что электроотрицательность — это способность атома притягивать к себе валентные электроны от других атомов.
Обрати внимание!
Чем больше электроотрицательность, тем сильнее у элемента выражены неметаллические свойства.
Шкала относительной электроотрицательности Полинга
Абсолютные значения ЭО — неудобные для работы числа. Поэтому обычно используют относительную электроотрицательность по шкале Полинга. За единицу в ней принята ЭО лития.
По шкале Полинга наиболее электроотрицательным среди элементов, способных образовывать соединения, является фтор, а наименее электроотрицательным — франций. ЭО франция равна (0,7), а ЭО фтора — (4). ЭО остальных элементов изменяются в пределах от (0,7) до (4).
Как правило, неметаллы имеют ЭО больше двух. У металлов значение ЭО меньше двух. Некоторые элементы (B,Si,Ge,As,Te) со значениями электроотрицательности, близкими к (2), способны проявлять промежуточные свойства.
Элементы с высокой и низкой электроотрицательностью считаются активными. С высокой — активные неметаллы, с низкой — активные металлы. У первых ЭО близка к (3)–(4), у вторых — к (1).
Изменение электроотрицательности в Периодической системе
С увеличением порядкового номера элементов ЭО изменяется периодически.
В периоде она растёт слева направо при накоплении электронов на внешнем слое.
В группе она убывает сверху вниз при увеличении числа электронных слоёв и увеличении атомных радиусов.
Наибольшей ЭО в каждом периоде обладают самые маленькие атомы с семью внешними электронами — атомы галогенов (инертные газы соединений не образуют).
Наименьшая ЭО в периоде у самого большого атома с одним внешним электроном — атома щелочного металла.
Обрати внимание!
Значения электроотрицательности элементов позволяют определить:
— заряды атомов в соединении;
— сдвиг электронов при образовании химической связи.
Установим, как происходит сдвиг электронов при взаимодействии атомов хлора и серы, cеры и кислорода.
Пример:
хлор и сера расположены в третьем периоде. Электроотрицательность по периоду возрастает слева направо. ЭО хлора больше ЭО серы, значит, электроны будут сдвинуты от серы к хлору. Заряд атома серы будет положительным, а хлора — отрицательным:
Sδ+→Clδ−.
Проверим вывод по шкале Полинга. Электроотрицательность хлора равна (3), а электроотрицательность серы — (2,5). Хлор более электроотрицательный.
Пример:
кислород и сера расположены в шестой А группе. Электроотрицательность по группе сверху вниз уменьшается. ЭО кислорода больше ЭО серы, значит, электроны будут сдвинуты от серы к кислороду. Атом серы имеет положительный заряд, а кислорода — отрицательный:
Sδ+→Oδ−.
По шкале Полинга электроотрицательность кислорода равна (3,5), а электроотрицательность серы — (2,5). Более электроотрицательный — кислород.
При сравнении ЭО элементов часто используют ряд электроотрицательности, расположив элементы в порядке убывания её значения:
F,O,N,Cl,Br,S,C,P,H,Si,Mg,Li,Na.
Источники:
Габриелян О. С. Химия. 8 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2013. — 71с
Жилин Д. М. Химия. 8 класс. Учебник для общеобразовательных учреждений. М.: Бином. Лаборатория знаний, 2011. — 245с.
Источник
Выяснить активность простых веществ можно с помощью таблицы электроотрицательности химических элементов. Обозначается как χ. Подробнее о понятии активности читайте в нашей статье.

Что такое электроотрицательность
Свойство атома химического элемента притягивать к себе электроны других атомов называется электроотрицательностью. Впервые понятие ввёл Лайнус Полинг в первой половине ХХ века.
Все активные простые вещества можно разделить на две группы в соответствии с физическими и химическими свойствами:
- металлы;
- неметаллы.
Все металлы являются восстановителями. В реакциях они отдают электроны и обладают положительной степенью окисления. Неметаллы могут проявлять свойства восстановителей и окислителей в зависимости от значения электроотрицательности. Чем выше электроотрицательность, тем сильнее свойства окислителя.

Рис. 1. Действия окислителя и восстановителя в реакциях.
Полинг составил шкалу электроотрицательности. В соответствии со шкалой Полинга наибольшей электроотрицательностью обладает фтор (4), наименьшей – франций (0,7). Это значит, что фтор является самым сильным окислителем и способен притягивать электроны большинства элементов. Напротив, франций, как и другие металлы, является восстановителем. Он стремится отдать, а не принять электроны.
Электроотрицательность является одним из главных факторов, определяющих тип и свойства образованной между атомами химической связи.
Как определить
Свойства элементов притягивать или отдавать электроны можно определить по ряду электроотрицательности химических элементов. В соответствии со шкалой элементы со значением более двух являются окислителями и проявляют свойства типичного неметалла.
Номер элемента | Элемент | Символ | Электроотрицательность |
87 | Франций | Fr | 0,79 |
55 | Цезий | Cs | 0,79 |
19 | Калий | K | 0,82 |
37 | Рубидий | Rb | 0,82 |
56 | Барий | Ba | 0,89 |
88 | Радий | Ra | 0,9 |
11 | Натрий | Na | 0,93 |
38 | Стронций | Sr | 0,95 |
3 | Литий | Li | 0,98 |
20 | Кальций | Ca | 1,0 |
57 | Лантан | La | 1,1 |
89 | Актиний | Ac | 1,1 |
70 | Иттербий | Yb | 1,1 |
58 | Церий | Ce | 1,12 |
59 | Празеодим | Pr | 1,13 |
61 | Прометей | Pm | 1,13 |
95 | Америций | Am | 1,13 |
60 | Неодим | Nd | 1,14 |
62 | Самарий | Sm | 1,17 |
64 | Гадолиний | Gd | 1,2 |
66 | Диспрозий | Dy | 1,22 |
39 | Иттрий | Y | 1,22 |
68 | Эрбий | Er | 1,24 |
69 | Тулий | Tm | 1,25 |
71 | Лютеций | Lu | 1,27 |
96 | Кюрий | Cm | 1,28 |
94 | Плутоний | Pu | 1,28 |
90 | Торий | Th | 1,3 |
97 | Берклий | Bk | 1,3 |
98 | Калифорний | Cf | 1,3 |
99 | Эйнштейний | Es | 1,3 |
100 | Фермий | Fm | 1,3 |
101 | Менделевий | Md | 1,3 |
102 | Нобелий | No | 1,3 |
12 | Магний | Mg | 1,31 |
40 | Цирконий | Zr | 1,33 |
93 | Нептуний | Np | 1,36 |
21 | Скандий | Sc | 1,36 |
92 | Уран | U | 1,38 |
73 | Тантал | Ta | 1,5 |
91 | Протактиний | Pa | 1,5 |
22 | Титан | Ti | 1,54 |
25 | Марганец | Mn | 1,55 |
4 | Бериллий | Be | 1,57 |
41 | Ниобий | Nb | 1,6 |
13 | Алюминий | Al | 1,61 |
81 | Талий | Tl | 1,62 |
30 | Цинк | Zn | 1,65 |
23 | Ванадий | V | 1,63 |
24 | Хром | Cr | 1,66 |
48 | Кадмий | Cd | 1,69 |
49 | Индий | In | 1,78 |
31 | Галлий | Ga | 1,81 |
26 | Железо | Fe | 1,83 |
82 | Свинец | Pb | 1,87 |
27 | Кобальт | Co | 1,88 |
29 | Медь | Cu | 1,9 |
75 | Рений | Re | 1,9 |
14 | Кремний | Si | 1,9 |
43 | Технеций | Tc | 1,9 |
28 | Никель | Ni | 1,91 |
47 | Серебро | Ag | 1,93 |
50 | Олово | Sn | 1,96 |
80 | Ртуть | Hg | 2 |
84 | Полоний | Po | 2 |
83 | Висмут | Bi | 2,02 |
5 | Бор | B | 2,04 |
51 | Сурьма | Sb | 2,05 |
42 | Молибден | Mo | 2,16 |
33 | Мышьяк | As | 2,18 |
15 | Фосфор | P | 2,19 |
1 | Водород | H | 2,2 |
77 | Иридий | Ir | 2,2 |
86 | Радон | Rn | 2,2 |
85 | Астат | At | 2,2 |
44 | Рутений | Ru | 2,2 |
46 | Палладий | Pd | 2,2 |
76 | Осмий | Os | 2,2 |
78 | Платина | Pt | 2,28 |
45 | Родий | Rh | 2,28 |
74 | Вольфрам | W | 2,36 |
79 | Золото | Au | 2,54 |
6 | Углерод | C | 2,55 |
34 | Селен | Se | 2,55 |
16 | Сера | S | 2,58 |
54 | Ксенон | Xe | 2,6 |
53 | Йод | I | 2,66 |
36 | Криптон | Kr | 2,96 |
7 | Азот | N | 3,04 |
17 | Хлор | Cl | 3,16 |
8 | Кислород | O | 3,44 |
9 | Фтор | F | 3,98 |
Вещества с электроотрицательностью два и меньше являются восстановителями и проявляют металлические свойства. Переходные металлы, обладающие переменной степенью окисления и относящиеся к побочным подгруппам таблицы Менделеева, имеют значения электроотрицательности в пределах 1,5-2. Ярко выраженными свойствами восстановителя обладают элементы с электроотрицательностью равной или меньше одного. Это типичные металлы.
В ряде электроотрицательности металлические и восстановительные свойства увеличиваются справа налево, а окислительные и неметаллические свойства – слева направо.

Рис. 2. Ряд электроотрицательности.
Помимо шкалы Полинга узнать, насколько выражены окислительные или восстановительные свойства элемента можно с помощью периодической таблицы Менделеева. Электроотрицательность увеличивается в периодах слева направо с увеличением порядкового номера. В группах значение электроотрицательности уменьшается сверху вниз.
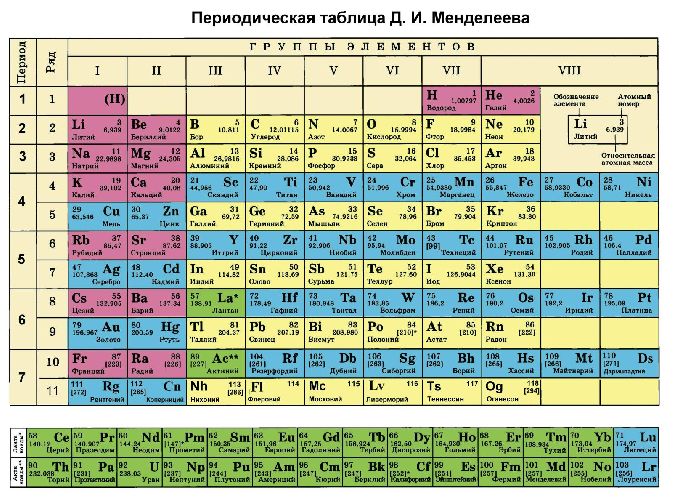
Рис. 3. Таблица Менделеева.
Что мы узнали?
Электроотрицательность показывает способность элементов отдавать или принимать электроны. Эта характеристика помогает понять, насколько выражены свойства окислителя (неметалла) или восстановителя (металла) у конкретного элемента. Для удобства Полингом была разработана шкала электроотрицательности. Согласно шкале максимальными окислительными свойствами обладает фтор, минимальными – франций. В периодической таблице свойства металлов увеличиваются справа налево и сверху вниз.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-

Александр Котков
5/5

Александр Котков
5/5
Оценка доклада
Средняя оценка: 4.6. Всего получено оценок: 219.
Источник
Одно из основополагающих понятий в химии – электроотрицательность.
Электроотрицательность – это свойство атома притягивать к себе общие электронные пары, образующиеся химическую связь.
Можно говорить также, что электроотрицательность – способность атома притягивать к себе электроны других атомов при образовании химической связи. Существуют количественные характеристики электроотрицательности, но в курсе неорганической химии 8 класса они не изучаются. Нам будет достаточно качественного определения этого понятия.
Фото: fineartamerica.com
В первую очередь надо запомнить следующее:
электроотрицательность растёт при движении по периоду таблицы Менделеева слева направо и падает при движении по группе сверху вниз.
Инертные газы (элементы VIII группы) имеют завершённый внешний электронный слой, поэтому понятие электроотрицательности к ним неприменимо, их мы в расчёт брать не будем. А теперь давайте сразу рассмотрим примеры, чтобы наглядно это увидеть. Взгляните на второй период таблицы Менделеева, он выглядит так:
Так вот при движении от лития к фтору электроотрицательность растёт, то есть минимальная электроотрицательноть будет во втором периоде у лития, максимальная – у фтора. Аналогичная ситуация наблюдается во всех периода: в начале стоят элементы с низкой электроотрицательностью, в конце – с высокой.
Теперь взглянем на первую группу:
При движении сверху вниз электроотрицательность падает, то есть теперь у лития будет максимальная электроотрицательность, а у франция – минимальная. Точно так же происходит и в других группах: чем выше элемент, тем выше электроотрицательность.
Таким образом,
элементы с максимальной электроотрицательностью сосредоточены в правом верхнем углу таблицы, с минимальной – в левом нижнем.
Также можно говорить, что неметаллы имеют высокую электроотрицательность, а металлы – низкую.
Зачем нужна электроотрицательность
Этот вопрос логичен, ведь мы уже столько поговорили об этом понятии, но так и не применили его на практике. Согласно определению,
электроотрицательность – это способность атома притягивать электронную пару.
Атомы с высокой электроотрицательностью будут сильно притягивать электронные пары, атомы с низкой электроотрицательностью будут пары отдавать. Чтобы это понять, рассмотрим ещё несколько примеров.
В хлориде натрия NaCl атом хлора будет притягивать электронную пару, а атом натрия отдавать (посмотрите в таблицу Менделеева и убедитесь, что хлор стоит сильно правее натрия). Кроме того, выше говорилось, что атомы металлов отдают электроны, а атомы неметаллов – притягивают их, именно это мы здесь и наблюдаем: натрий – металл, он имеет низкую электроотрицательность и отдаёт электроны, а атом хлор – неметалл, он имеет высокую электроотрицательность и притягивает электроны.
Ещё один пример – оксид азота (II) NO. Здесь два неметалла, но у кислорода электроотрицательность значительно выше (обратитесь к таблице и посмотрите на положение этих элементов). То есть в этом соединении отдавать электроны будет азот, а притягивать их будет кислород.
Понятие электроотрицательности нельзя игнорировать, с ним непременно нужно разобраться, поскольку оно необходимо для понимания образования химической связи.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник
Электроотрицательность химических элементов
Электроотрицательность (ЭО) – свойство атомов элементов оттягивать на себя электроны от другого атома в соединении.
На ЭО влияет несколько факторов: радиус атома и расстояние между ядром и валентными электронами. Численные значения ЭО приблизительные. Часто используют шкалу определения ЭО по Полингу.
Относительная электроотрицательность атомов элементов по Полингу
Анализируя данную шкалу можно выявить ряд закономерностей, перекликающихся с периодическим законом (ПЗ).
- В периодической системе химических элементов (ПСХЭ) ЭО в периоде увеличивается слева направо и уменьшается в главной подгруппе.
- ЭО связана с окислительно-восстановительными свойствами элементов, поэтому типичные неметаллы характеризуются высокой ЭО, а металлы – низкой. Самая высокая ЭО у фтора, потому что он самый сильный окислитель.
В зависимости от значения электроотрицательности образуются вещества с различным видом химической связей: если между атомами нет разности в электроотрицательности, образуются простые вещества (состоящие из одного вида атомов), чем больше разность, тем полярность молеклы возрастает: образуются молекулы веществ с полярной связью и ионной связью.
Степень окисления химических элементов и ее вычисление
Степень окисления(СО) – условный заряд атомов химических элементов в соединении на основании того, что все связи ионные.
Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно помещается над символом элемента в верхней части.
При определении СО следует руководствоваться следующими правилами:
- Сумма СО в химическом соединении всегда равна нулю, так как молекулы электронейтральны; в сложном ионе соответствует заряду иона.
- СО всех простых веществ соответствует нулю;
- Высшая положительная СО определяется по номеру группы; низшая отрицательная равна восемь минус номер группы;
- Элементы с наибольшей ЭО имеют отрицательную СО, с наименьшей – положительную;
- Постоянную СО имеют фтор (-1), щелочные металлы (+1), щелочноземельные, а также бериллий, магний, цинк (+2), алюминий (+3). У кислорода СО равна -2, исключение пероксиды (+2). У водорода +1, исключение соединения с металлами (гидриды) -1.
Применяя эти правила можно рассчитать степени окисления элементов в сложном веществе.
К примеру, определим степени окисления элементов в фосфорной кислоте H3PO4.
- Найдем и проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х». — H+13 PX O-24
- Используя эти значения составим и решим уравнение с одной неизвестной. (+1) * 3 + (x) * 1 + (-2) * 4 = 0 Следовательно, x=5 или +5. Таким образом, СО у фосфора +5.
Рассчитаем степени окисления у элементов в нитрате алюминия Al(NO3)3.
- Проставим известные СО элементов – алюминий и кислород, у азота примем СО за «x». Al+3 (NxO-23)3
- Составим и решим уравнение — (+3) * 1 + 3x + 9 * (-2) = 0. В итоге получаем x=+5, то есть СО у азота в соединении +5.
Валентность. Валентные возможности атомов
Валентность – это способность атома присоединять ряд других атомов для образования химической связи.
Валентность может быть определена числом химических связей, образующих атом, или числом неспаренных электронов.
Валентность обозначается римскими цифрами и указывается над химическим элементом справа вверху и не имеет знака (+ или -). Может быть постоянной или переменной.
Для определения валентности применяются определенные правила:
- У металлов главных подгрупп валентность всегда постоянная и определяется по номеру группы.
- У металлов побочных подгрупп и неметаллов валентность переменная. Высшая валентность = номеру группы, а низшая = 8 – номер группы.
Валентность может совпадать со степенью окисления, но не имеет знака «+» или «-», не может быть равна нулю.
Валентные возможности атомов могут определяться:
- Количеством неспаренных электронов;
- Наличием свободных орбиталей;
- Наличием неподеленных пар электронов.
Валентные возможности водорода
Валентные возможности водорода определяются одним неспаренным электроном на единственной орбитали. Водород обладает слабой способностью отдавать или принимать электроны, поэтому для него характерны в основном ковалентные химические связи. Ионные связи он может создавать с металлами, образуя гидриды. Ковалентные химические связи образуются за счет общих электронных пар. Поскольку у водорода всего один электрон, он способен образовывать только одну связь. По этой причине для него характерна валентность равная I.
Валентные возможности углерода
На внешнем энергетическом уровне у углерода 4 электрона: 2 спаренных и 2 неспаренных. Это состояние атома называется основным. По числу неспаренных электронов можно сказать, что углерод проявляет валентность равную II. Однако такая валентность проявляется только в некоторых соединениях.
В органических соединениях и некоторых органических веществах углерод проявляет валентность равную IV. Эта валентность характерна для возбужденного состояния С. Из основного в возбужденное состояние он может переходить при получении дополнительной энергии. Один электрон с s-подуровня переходит на p-подуровень, где есть свободная орбиталь.
Атом С способен присоединять и отдавать электроны с образованием ковалентных связей. Валентные возможности углерода очень широкие, он может принимать значение степени окисления от +4 до -4.
Валентные возможности азота
У азота на валентном энергетическом уровне находится 5электронов: 3 неспаренных и 2 спаренных. Исходя из этого, валентность азота может быть равна III. В возбужденное состоянии атом азота не может переходить. Однако азот может выступать в качестве донора при образовании ковалентных химических связей, обеспечивая своей электронной паре атом, имеющий свободную орбиталь. В этом случае валентность у азота будет равна IV, причем для азота, как элемента пятой группы, это максимальная валентность. Валентность V он проявлять не способен.
Валентные возможности фосфора
В отличие от азота, фосфор имеет свободные 3d-орбитали, на которые могут переходить электроны. На внешнем энергетическом уровне находятся 3 неспаренных электрона. Атом фосфора способен переходить из основного состояния в возбужденное. Электроны с p-подуровня переходят на d-подуровень. В этом случае атом Р приобретает валентность, равную V. Таким образом, строение электронной оболочки атома увеличивает валентные возможности Р, по сравнению с азотом, от I до V.
Валентные возможности кислорода
На последнем энергетическом уровне у кислорода 2 неспаренных электрона. В соединениях чаще всего проявляет валентность II. У кислорода нет d-подуровня, поэтому переход электронов невозможен. Валентные возможности очень ограничены – проявляет II и III валентности.
Валентные возможности серы
Сера, так же, как и кислород, р в VI группе главной подгруппе ПСХЭ. Поэтому на валентном энергетическом уровне у серы 2 неспаренных электрона. Напрашивается вывод, что валентность серы равна II. Однако у серы есть и d-подуровень, который расширяет ее валентные возможности. Сера способна переходить из основного состояния в возбужденное, при этом может быть либо 4 неспаренных электрона, либо 6.
Таким образом, сера способна проявлять валентности II, IV, VI.
Опираясь на этот материал, можно определить все возможные валентности для любого химического элемента.
Смотри также:
- Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
- Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Источник
