Какие свойства ионной связи отличают ее от ковалентной

Разница Между 2020
Ключевое отличие: Ионная связь представляет собой химическую связь между двумя разными (то есть металлом и неметаллом) атомами, в которой один атом отдает электрон другому. Ковалентная связь – другая
Содержание:
Ключевое отличие: Ионная связь представляет собой химическую связь между двумя разными (то есть металлом и неметаллом) атомами, в которой один атом отдает электрон другому. Ковалентная связь – другая сильная химическая связь. Это имеет место схожих атомов (то есть двух неметаллов). В ковалентной связи два атома объединяются, чтобы разделить электрон, вместо того чтобы атом брал электрон у другого.
Чтобы создать молекулы или соединения, атомы образуют связи друг с другом. Связь – это химический процесс, возникающий из-за притяжения между двумя или более атомами. На самом деле химическая связь вызвана электростатической силой притяжения между противоположными зарядами, либо между электронами и ядрами, либо в результате дипольного притяжения. Прочность этих химических связей можно слабо классифицировать как «сильные связи» или «слабые связи». Двумя распространенными примерами «сильных связей» являются ионные и ковалентные связи.
Ионная связь представляет собой химическую связь между двумя разными (то есть металлом и неметаллом) атомами, в которой один атом отдает электрон другому. Следовательно, оба атома становятся ионами, так как у одного атома на один электрон меньше, а у другого – дополнительный. Ион металла, потерявший электрон, имеет положительный заряд. Неметаллический ион, получивший электрон, имеет отрицательный заряд. Когда противоположности притягиваются, эти ионы сильно притягиваются друг к другу настолько сильно, что становятся связанными.
Ионные соединения обычно находятся в форме твердых веществ, то есть солей. Они хорошо растворимы в воде и имеют высокую температуру плавления. Когда они находятся в воде, они также имеют высокую электрическую проводимость.
Ковалентная связь – другая сильная химическая связь. Это имеет место схожих атомов (то есть двух неметаллов). В ковалентной связи два атома объединяются, чтобы разделить электрон, вместо того чтобы атом брал электрон у другого. Ковалентная связь – это устойчивый баланс сил притяжения и отталкивания между двумя атомами, когда они делят электрон. Ковалентные связи могут быть далее классифицированы на одинарные, двойные и тройные ковалентные связи, в зависимости от того, сколько электронов является общим. Каждый общий электрон образует одну связь.
Ковалентная связь включает в себя множество видов взаимодействия, включая σ-связь, π-связь, связь металл-металл, агостические взаимодействия и трехцентровые двухэлектронные связи. Когда у атома есть электрон во внешней оболочке, а другим атомам требуется, чтобы электрон заполнил его внешнюю оболочку, два атома соединяются, чтобы разделить электрон. Следовательно, оба атома имеют полную внешнюю оболочку и, соответственно, стабильную электронную конфигурацию.
Химические связи сделаны так, что атом может иметь полную внешнюю оболочку, поскольку полная внешняя оболочка означает стабильную электронную конфигурацию. В ионной связи, когда атом металла имеет один электрон в своей внешней оболочке, а неметаллу нужен электрон для завершения своей внешней оболочки, атом металла отдает свой электрон неметаллу. Аналогично, в ковалентной связи они одинаково делят электрон.
Ионная связь | Ковалентная связь | |
Определение | Химическая связь между двумя разнородными атомами, в которой атом отдает электрон другому. | Ковалентная связь представляет собой химическую связь, которая включает в себя обмен электронами между двумя одинаковыми атомами. |
Вхождение | Металл и неметалл | Два неметалла |
полярность | Высоко | Низкий |
Форма молекулы | Нет определенной формы, решетчатые структуры | Определенная форма |
Электрическая проводимость | Высоко | Обычно нет |
Теплопроводность | Высоко | Обычно низкий |
Температура плавления вещества | Зависит, но обычно выше, чем ковалентные соединения | Зависит, но обычно ниже, чем ионные соединения |
Точка кипения вещества | Высоко | Зависит, но обычно ниже, чем ионные соединения |
Растворимость в воде | Высоко | Зависит, но обычно ниже, чем ионные соединения |
Состояние вещества при комнатной температуре | Обычно твердый | Твердый, жидкий, газ |
Источник
Химические связи – это приоритетная проблема в современной химии. От полученных знаний зависит выяснение причин разнообразия соединений, также строения и возникновения веществ. Выявленные типы: ионный, ковалентный, металлический, водородный.
Химические вещества состоят из не связанных между собой атомов химических элементов. Такое строение имеют только благородные газы: гелий, неон, аргон, криптон, ксенон и радон. Чаще всего химические вещества состоят не из отдельных атомов, а из их соединений, которые образуют различные группировки. Такие объединения атомов могут состоят из нескольких единиц, сотен, тысяч или даже больше атомов. Сила, которая держит эти атомы в составе таких группировок, называется химическая связь.
Химическая связь – связь отдельных атомов между собой за счет силы взаимного притяжения из-за разности электродных потенциалов в более сложные структуры (молекулы, ионы, радикалы, кристаллы и др.).
Причиной образования химической связи
- энергия более сложных структур меньше суммарной энергии отдельных, образующих ее атомов. Когда образуется сложное вещество, то суммарная энергия атомов падает, а когда атомы находятся в не связанном состоянии энергия их выше, так как компенсационного эффекта для образования молекулы не происходит.
Например: взаимодействуют атомы А и В. Энергия такого атома выше, чем соединения АВ, потому что при взаимодействии более электроотрицательный атом оттягивает на себя электроотрицательность и происходит смещение электронной плотности, а значит и понижение энергии всей молекулы. Поэтому в молекуле АВ энергия ниже, чем у отдельных атомов А и В.
E(АВ)
Поэтом при образовании химических связей между отдельными атомами выделятся энергия.
Химические связи – определение, возникновение
Теорию отдельно выдвинули Гильберт Ньютон Льюис и Вальтер Коссель в 1916 году. Для описания соединения двух атомов используется термин «химическая связь». В образовании участвуют электроны, которые расположены на внешних энергетических уровнях, а потому наименее связанные с ядром – это валентные электроны. При соединении образуется три вида частиц:
- молекула – небольшого размера электронейтральная частица вещества с характерными для него химическими свойствами;
- ионы – заряженные частицы, атомы и группы связанных атомов с обилием (анионы) или дефицитом (катионы) электронов;
- свободный радикал – частица с ненасыщенной (свободной) валентностью.
Возникновение химической связи между атомами ведёт к образованию частиц: молекул, ионов и свободных радикалов. При этом уменьшается полная энергия системы – объединение атомов в частицу протекает энергетически выгодно. Образование связи на примере водородной молекулы (Рис. 1):
- Пребывание двух мелких частиц на дальнем друг от друга промежутке – энергия взаимосвязи приближается к нулю (взаимосвязи нет).
- Сближение атомов на отдаление, соизмеримое с размером электронного пространства – вступают силы притяжения и отталкивания.
- Начало действия силы притяжения между электронной оболочкой одного атома и ядром другого атома, конкурирующие силы отталкивания между ядрами и между электронами.
- Силы притяжения преобладают над силами отталкивания – сближаются атомы, а потенциальная энергия снижается до возникновения стабильной молекулы при r = r0.
- Дальнейшее сближение – энергия системы стремительно повышается за счёт преобладания сил отталкивания.
Энергетический минимум идентичен устойчивому состоянию системы – в этой ситуации из пары обособленных водородных частиц получается молекула H2. Во время реакции производится 436 кДж/моль.
Как определить тип связи
Характеристики химических связей между частицами веществ зависят от электроотрицательности – возможности сохранять валентные электроны. Этот показатель зависит от заряженности ядра и радиуса атома. Для количественной оценки применяют шкалу Полинга (Табл. 1).
Таблица 1
Определение вида взаимосвязи по разнице электроотрицательност (ЭО):В многообразии источников попадаются разные таблицы. Использовать можно каждую шкалу, потому что важнее разница электроотрицательностей, которая в среднем сходна в изобретённых системах, а не значение.
- Δ ЭО = 0 – неполярная ковалентная;
- Δ ЭО
- Δ ЭО ≥ 1,7 – ионная.
Химические связи различаются по связываемым атомам, образующимся частицам, кристаллической решётке, характере вещества. Выделяют 4 типа:
- Ковалентная (полярная и неполярная).
- Ионная.
- Механическая.
- Водородная.
Определяют тип по веществу, принимающему участие в связи. Если это 2 неметалла, то связь ковалентная. Если метал с неметаллом, то ионный тип, но если 2 металла, то металлический тип. Водородная связь – соединение молекул водорода с фтором, хлором, кислородом или азотом.
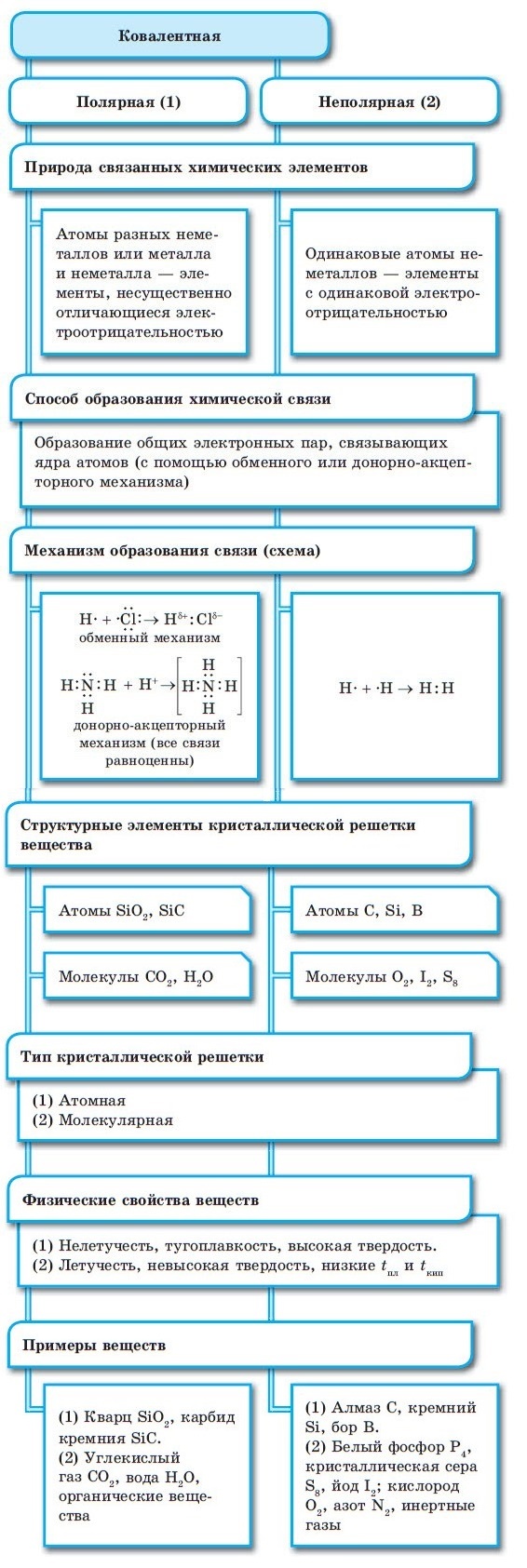
Ковалентная химическая связь
Между атомами элементов неметаллов возникает ковалентных характер связи. Если атомы неметаллов, образующие ковалентную связь, относятся к разным химическим элементам, такую связь называют ковалентной полярной. Причина такого названия, потому что атомы разных элементов имеют различную способность притягивать к себе общую электронную пару. Это приводит к смещению общей электронной пары в сторону одного из атомов, в результате чего на нем формируется частичный отрицательный заряд. На другом атоме формируется частичный положительный заряд.
Ковалентный тип – это химическая связь, в результате которой возникают общие пары электронов. Два пути появления:
- Обменный способ – каждая частица предоставляет по одному электрону в совместное использование.
- Донорно-акцепторный механизм – одна частица предоставляет уже по 2 электрона, а второй атом отдаёт свободную орбиталь.
Пример обменного способа – объединение атомов в молекулу водорода. Сближаясь, электронные оболочки перекрываются, а электронная плотность между ядрами повышается. Идёт притяжение, и энергия системы понижается. При близком сближении ядра отталкиваются – появляется расстояние (Рис. 2).
Характеристики ковалентной связи:
- Полярность – неравномерное сосредоточение между частицами с разной электроотрицательностью электронной плотности.
- Кратность – количество общих электронных пар между двумя атомами.
- Длина – протяжённость между центральными частями ядер атомов.
- Насыщаемость – возможность атомов создавать условное число связей.
- Энергия связи – мера прочности, энергия, требуемая для разрыва связи во всех молекулах, составляющих 1 моль вещества.
Ковалентная связь включает две разновидности по полярности: полярная и неполярная. Определяют по электроотрицательности атомов – одинаковая она или нет.
Характеристика:
1. Неполярная ковалентная – связь между одинаковыми мелкими частицами (неметаллами) с размеренным распространением электронной плотности и равной электроотрицательностью. Примеры: Cl2, H2, I2, O2, N2 (Рис. 3).
2. Полярная ковалентная – это соединение неравных частиц (неметаллов) с разницей в электроотрицательности и смещением общей пары электронов. Примеры: NH3, HCl, CO2, H2O (Рис. 4).
Полярность – характеристика, определяющая физические или химические свойства вещества. Она влияет на механизм реакций, реакционную способность ближайших связей. Полярность молекулы, температуры плавления и кипения, а также растворимость – показатели, зависящие от полярности связей.
Ионная связь
Ионный тип – тип, при котором разница электроотрицательности атомов больше 1,7–2 по шкале Полинга. Если точнее, то притяжение появляется между ионами с разными зарядами. В возникновении ионного типа участвуют металлы, неметаллы. Примеры: NaCl, LiF, K2O, другие (Рис. 5).
Главные характеристики: ненаправленность и ненасыщаемость. Ионная связь во многом сходна с ковалентной, поэтому считается предельным случаем. Энергия связи (прочность) доходит до 800 кДж/моль.
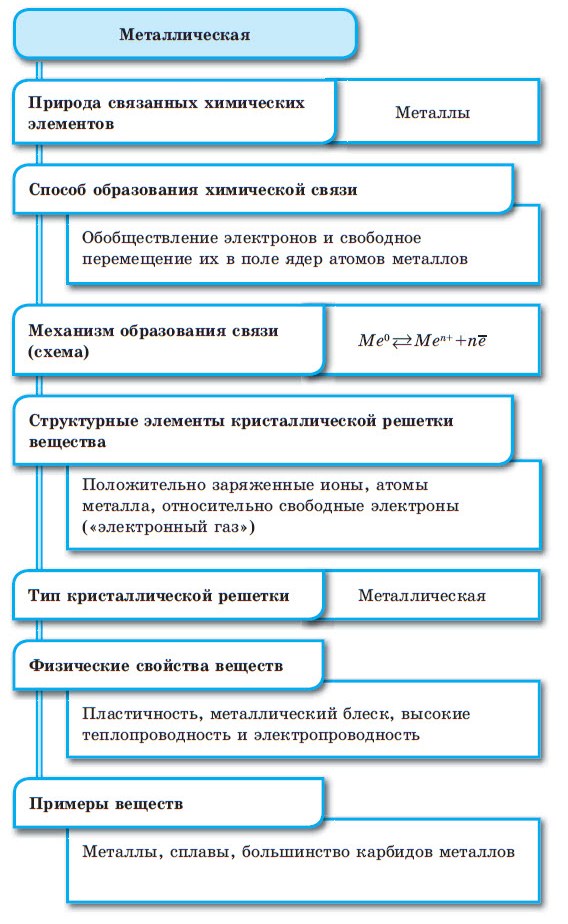
Металлическая связь
Характеристики металлов: блеск, ковкость, пластичность и сравнительно высокая температура плавления, тепло- и электропроводность. Общность этих качеств объясняется сходством организации атомов:
- малое количество электронов на внешнем уровне;
- слабое притяжение между валентными электронами и ядром;
- низкая ионизация и электроотрицательность.
Металлический тип – это связь сравнительно свободных отрицательно заряженных частиц между ионами металлов с образованием кристаллической решётки. Примеры – Fe, Na, Ca, Sc и Au3Cu, другие (Рис. 6).
Общность металлического и ковалентного вида связей – обобществление валентных электронов в основе. Различия заключаются в меньшей прочности и отсутствии направленности. Прочность (энергия) у металлической связи в 3–4 раза ниже этого же показателя у ковалентного типа. Образование металлической связи между атомами металлов возможна из-за наличия кинетической энергии внутри каждого атома металла, при увеличении центробежной силы электроны последнего электронного слоя вылетают за пределы атома и связывают атомы металлов между собой. Каждый атом, который потерял электрон превращается в положительно заряженную частицу – протон. И происходит взаимное притяжение протона и электрона, который только что покинул атом. Электроны могут притягиваться обратно и таким образом происходит снова образование атома. Существованием свободных электронов объяснятся свойство металлов к электропроводности (электрический ток – направленное движение электронов). Поэтому металлическую кристаллическую решетку химически невозможно разрушить, её можно только механически распилить.
Водородная связь
Водородные соединения с электроотрицательными атомами фтора, хлора, азота, кислорода образуются благодаря водородным связям. В молекуле общая пара электронов движется к более электроотрицательному атому. Классический пример – жидкий фторид водорода (Рис. 7).
Энергия водородной связи составляет до 40 кДж/моль, поэтому этот тип в 10–20 раз слабее ковалентного. Водородные связи возникают между или внутри молекул. От этого зависят физико-химические свойства вещества.
Источник
Ключевые слова конспекта. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Силы, которые удерживают атомы в молекулах, называются химическими связями.
Образование химической связи происходит в том случае, если этот процесс сопровождается выигрышем энергии. Эта энергия возникает, если каждый атом, образующий химическую связь, получает устойчивую электронную конфигурацию.
По способу образования и существования химическая связь может быть ковалентной (полярной, неполярной), ионной, металлической.
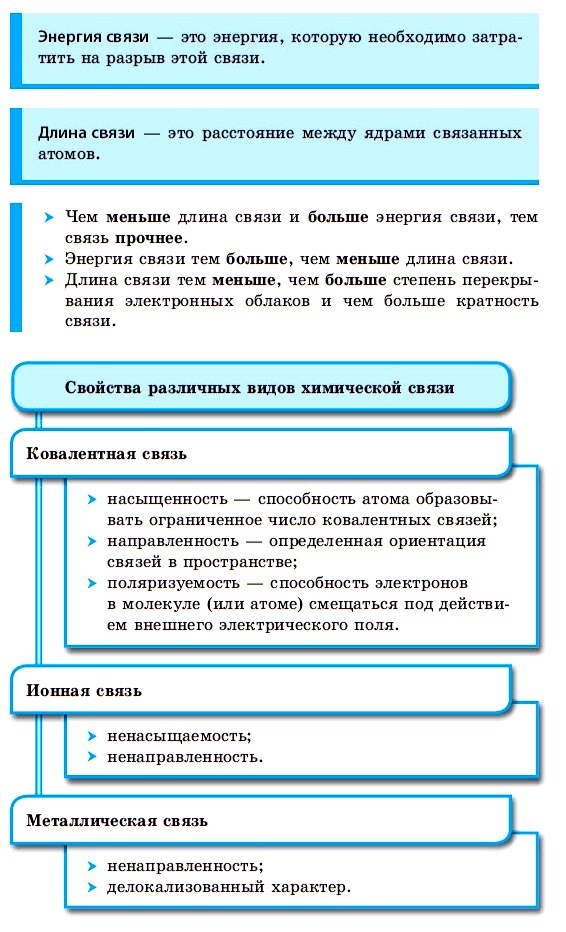
Ковалентная химическая связь
■ Ковалентная химическая связь — это связь, возникающая между атомами путем образования общих электронных пар за счет неспаренных электронов.
Внешние уровни большинства элементов периодической системы (кроме благородных газов) содержат неспаренные электроны, то есть являются незавершенными. В процессе химического взаимодействия атомы стремятся завершить свой внешний электронный уровень.
Например, электронная формула атома водорода: 1s1. Ее графический вариант: ![]()
Таким образом, атом водорода в химических реакциях стремится завершить свой внешний 1 s-уровень одним s-электроном. При сближении двух атомов водорода происходит усиление притяжения электронов одного атома к ядру другого атома. Под действием этой силы расстояния между ядрами атомов сокращаются и в результате их электронные орбитали перекрывают друг друга, создавая общую электронную орбиталь — молекулярную. Электроны каждого из атомов водорода через область перекрывания орбиталей мигрируют от одного атома к другому, то есть образуют общую электронную пару. Ядра будут сближаться до тех пор, пока нарастающие силы отталкивания одноименных зарядов не уравновесят силы притяжения.
Переход электронов с атомной орбитали на молекулярную сопровождается снижением энергии системы (более выгодное энергетическое состояние) и образованием химической связи:

Подобным образом образуются общие электронные пары при взаимодействии атомов р-элементов. Так образуются все двухатомные молекулы простых веществ. При образовании F2 и Cl2 перекрываются по одной р-орбитали от каждого из атомов (образуется одинарная связь), а при взаимодействии атомов азота перекрываются по три р-орбитали от каждого и в молекуле азота N2 образуется тройная связь.
Электронная формула атома хлора: 1s22s22p63s23p5. Графическая формула:
Таким образом, на внешней орбитали атом хлора содержит один неспаренный р-электрон. Взаимодействие двух атомов хлора будет происходить по следующей схеме:![]()
Электронная формула атома азота: 1s22s22p3. Графическая формула:

На внешней орбитали атома азота находятся 3 неспаренных р-электрона. Взаимодействие двух атомов азота будет происходить по следующей схеме:![]()
Прочность связей в молекуле определяется количеством общих электронных пар у ее атомов. Двойная связь прочнее одинарной, тройная — прочнее двойной.
С увеличением количества связей между атомами сокращается расстояние между ядрами атомов, которое называют длиной связи, и увеличивается количество энергии, необходимое для разрыва связи, которое называется энергией связи. Например, в молекуле фтора связь одинарная, ее длина составляет 1,42 нм (1 нм = 10–9 м), а в молекуле азота связь тройная, ее длина — 0,11 нм. Энергия связи в молекуле азота в 7 раз превышает энергию связи в молекуле фтора.
При взаимодействии атома водорода с атомом хлора оба атома будут стремиться завершить свои внешние энергетические уровни: водород — 1 s-уровень и хлор — 3р-уровень. В результате их сближения происходит перекрывание 1 s-орбитали атома водорода и 3р-орбитали атома хлора, а из соответствующих неспаренных электронов формируется общая электронная пара:
В молекулах Н2 и HCl область перекрывания орбиталей атомов водорода расположена в одной плоскости — на прямой, соединяющей центры атомных ядер. Такая связь называется σ-связью (сигма-связью):
Однако если в молекуле формируется двойная связь (с участием двух электронных орбиталей), то одна связь будет σ-связью, а вторая будет образована между орбиталями, расположенными параллельно друг другу. Параллельные орбитали перекроются с образованием двух общих участков, расположенных сверху и снизу от линии, соединяющей центры атомов.
Химическая связь, образующаяся в результате бокового перекрывания орбиталей — в двух местах, называется π-связью (пи-связью):
При образовании ковалентной связи меду атомами с одинаковой электроотрицательностью (Н2, F2, O2, N2) общая электронная пара будет располагаться на одинаковом расстоянии от атомных ядер. При этом общие электронные пары принадлежат в равной степени обоим атомам одновременно, и ни на одном из атомов не будет избыточного отрицательного заряда, который несут на себе электроны. Такой вид ковалентной связи называется неполярной.
■ Ковалентная неполярная связь — вид химической связи, образующийся между атомами с одинаковой электроотрицательностью.
В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):
В результате на атомах соединения образуются частичные заряды Н+0,18 и Cl–0,18; а в молекуле возникают два полюса — положительный и отрицательный. Такую ковалентную связь называют полярной.
■ Ковалентная полярная связь — вид ковалентной связи, образующейся при взаимодействии атомов, электроотрицательность которых отличается незначительно.
Образовавшийся частичный заряд на атомах в молекуле обозначают греческой буквой 8 (дельта), а направление смещения электронной пары — стрелкой:![]()
Ионная химическая связь
В случае химического взаимодействия между атомами, электроотрицательность которых резко отличается (например, между металлами и неметаллами), происходит почти полное смещение электронных облаков к атому с большей электроотрицательностью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион:
Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
■ Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.
Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:![]()
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
Ионы могут быть как простыми (одноатомными): Cl– , Н+, Na+, так и сложными (многоатомными): NH4–. Заряд иона принято записывать вверху после знака химического элемента. Вначале записывается величина заряда, а затем его знак.
Металлическая связь
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
- на внешнем энергетическом уровне присутствуют 1—3 электрона (исключения: атомы олова и свинца (4 электрона), атомы сурьмы и висмута (5 электронов), атом полония (6 электронов));
- атом имеет сравнительно большой радиус;
- атом имеет большое количество свободных орбиталей (например, у Na один валентный электрон располагается на 3-м энергетическом уровне, который имеет десять орбиталей (одну s-, три р- и пять d-орбиталей).
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.
■ Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов:

Конспект урока «Химическая связь: ковалентная, ионная, металлическая».
Следующая тема: «Валентность химических элементов».
Источник
