Какие свойства ионной отличают от ковалентной
Разница Между 2020
Ключевое отличие: Ионная связь представляет собой химическую связь между двумя разными (то есть металлом и неметаллом) атомами, в которой один атом отдает электрон другому. Ковалентная связь – другая
Содержание:
Ключевое отличие: Ионная связь представляет собой химическую связь между двумя разными (то есть металлом и неметаллом) атомами, в которой один атом отдает электрон другому. Ковалентная связь – другая сильная химическая связь. Это имеет место схожих атомов (то есть двух неметаллов). В ковалентной связи два атома объединяются, чтобы разделить электрон, вместо того чтобы атом брал электрон у другого.
Чтобы создать молекулы или соединения, атомы образуют связи друг с другом. Связь – это химический процесс, возникающий из-за притяжения между двумя или более атомами. На самом деле химическая связь вызвана электростатической силой притяжения между противоположными зарядами, либо между электронами и ядрами, либо в результате дипольного притяжения. Прочность этих химических связей можно слабо классифицировать как «сильные связи» или «слабые связи». Двумя распространенными примерами «сильных связей» являются ионные и ковалентные связи.
Ионная связь представляет собой химическую связь между двумя разными (то есть металлом и неметаллом) атомами, в которой один атом отдает электрон другому. Следовательно, оба атома становятся ионами, так как у одного атома на один электрон меньше, а у другого – дополнительный. Ион металла, потерявший электрон, имеет положительный заряд. Неметаллический ион, получивший электрон, имеет отрицательный заряд. Когда противоположности притягиваются, эти ионы сильно притягиваются друг к другу настолько сильно, что становятся связанными.
Ионные соединения обычно находятся в форме твердых веществ, то есть солей. Они хорошо растворимы в воде и имеют высокую температуру плавления. Когда они находятся в воде, они также имеют высокую электрическую проводимость.
Ковалентная связь – другая сильная химическая связь. Это имеет место схожих атомов (то есть двух неметаллов). В ковалентной связи два атома объединяются, чтобы разделить электрон, вместо того чтобы атом брал электрон у другого. Ковалентная связь – это устойчивый баланс сил притяжения и отталкивания между двумя атомами, когда они делят электрон. Ковалентные связи могут быть далее классифицированы на одинарные, двойные и тройные ковалентные связи, в зависимости от того, сколько электронов является общим. Каждый общий электрон образует одну связь.
Ковалентная связь включает в себя множество видов взаимодействия, включая σ-связь, π-связь, связь металл-металл, агостические взаимодействия и трехцентровые двухэлектронные связи. Когда у атома есть электрон во внешней оболочке, а другим атомам требуется, чтобы электрон заполнил его внешнюю оболочку, два атома соединяются, чтобы разделить электрон. Следовательно, оба атома имеют полную внешнюю оболочку и, соответственно, стабильную электронную конфигурацию.
Химические связи сделаны так, что атом может иметь полную внешнюю оболочку, поскольку полная внешняя оболочка означает стабильную электронную конфигурацию. В ионной связи, когда атом металла имеет один электрон в своей внешней оболочке, а неметаллу нужен электрон для завершения своей внешней оболочки, атом металла отдает свой электрон неметаллу. Аналогично, в ковалентной связи они одинаково делят электрон.
Ионная связь | Ковалентная связь | |
Определение | Химическая связь между двумя разнородными атомами, в которой атом отдает электрон другому. | Ковалентная связь представляет собой химическую связь, которая включает в себя обмен электронами между двумя одинаковыми атомами. |
Вхождение | Металл и неметалл | Два неметалла |
полярность | Высоко | Низкий |
Форма молекулы | Нет определенной формы, решетчатые структуры | Определенная форма |
Электрическая проводимость | Высоко | Обычно нет |
Теплопроводность | Высоко | Обычно низкий |
Температура плавления вещества | Зависит, но обычно выше, чем ковалентные соединения | Зависит, но обычно ниже, чем ионные соединения |
Точка кипения вещества | Высоко | Зависит, но обычно ниже, чем ионные соединения |
Растворимость в воде | Высоко | Зависит, но обычно ниже, чем ионные соединения |
Состояние вещества при комнатной температуре | Обычно твердый | Твердый, жидкий, газ |
Источник
Энергетические схемы образования молекулы гелия и иона гелия
Задание 71.
Нарисуйте энергетическую схему образования молекулы Не2 и молекулярного иона Не2+ по методу молекулярных орбиталей. Как метод МО объясняет устойчивость нона Не2+ и невозможность существования молекулы Не2.
Решение:
Заполнение МО происходит при соблюдении принципа Паулии правила Хунда: сначала заполняется та орбиталь, которой соответствует наиболее низкая энергия, затем – орбитали с большими значениями полной энергии.
Схема образования молекулы Не2 имеет вид:
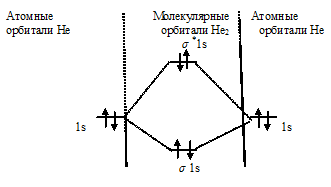
Определим порядок связи:
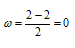
Так как порядок связи равен нулю, то молекула Не2 должна быть энергетически неустойчивой, поскольку здесь из четырёх электронов, которые должны разместиться на МО, два займут связывающую ( 1s), а два – разрыхляющую ( *1s) МО. Следовательно, образование молекулы Не2 не будет сопровождаться выделением энергии. Действительно молекулы Не экспериментально не получены.
Схема образования иона Не2+ имеет вид:
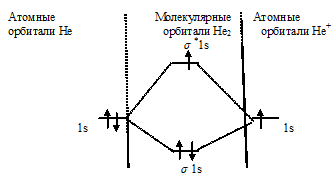
Определим порядок связи: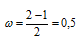
В молекулярном ионе Не2+ порядок связи равен 0,5, следовательно, образование данного иона будет сопровождаться выделением энергии. При его образовании два электрона занимают связывающую МО, а третий электрон – занимает разрыхляющую МО, что и приводит данную частицу к устойчивому существованию. Действительно существование иона Не2+ экспериментально подтверждено и установлено, что при его образовании выделяется энергия.
Водородная связь
Задание 72.
Какую химическую связь называют водородной? Между молекулами, каких веществ она образуется? Почему Н2О и НЕ, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги?
Решение:
Водородной связью называют связь, которая возникает между молекулами, в которых атомы водорода связаны с атомами фтора, кислорода, азота. Она характерна для молекул HF, H2O, NH3, молекул карбоновых кислот, спиртов, аминокислот, амидов, сахаров, аминов фенолов. Например, при образовании молекулы HF возникает связь H — F, осуществляемая общей электронной парой, которая смещена к атому более электроотрицательного элемента – фтора: 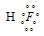 В результате такого распределения электронной плотности молекула фтороводорода представляет из себя диполь, положительный полюс которого – это атом водорода:
В результате такого распределения электронной плотности молекула фтороводорода представляет из себя диполь, положительный полюс которого – это атом водорода: 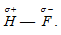 . Из-за смещения общей электронной пары к атому фтора, ядро атома водорода частично обнажается и частично освобождается 1s-орбиталь атома водорода. В связи с тем, что у атома водорода нет экранирующей электронной оболочки, а ядро атома представляет собой протон, напряжённость электрического поля вблизи оголенного протона настолько велика, что он может интенсивно притягивать к себе отрицательный полюс соседней молекулы HF. Поскольку этот отрицательный полюс соседней молекулы не что иное, как атом фтора, имеющий три несвязывающие электронные пары, а 1s-орбиталь атома водорода частично вакантна, то между атомом водорода одной молекулы и атомом фтора другой, соседней, возникает донорно-акцепторное взаимодействие. В результате этого взаимодействия возникает связь между двумя молекулами HF, дополнительная связь. Это и есть водородная связь. Её обозначают точками или пунктирной линией: F — H … F. Система из трёх атомов линейна. Эта связь менее прочная и более длинная, чем обычная ковалентная:
. Из-за смещения общей электронной пары к атому фтора, ядро атома водорода частично обнажается и частично освобождается 1s-орбиталь атома водорода. В связи с тем, что у атома водорода нет экранирующей электронной оболочки, а ядро атома представляет собой протон, напряжённость электрического поля вблизи оголенного протона настолько велика, что он может интенсивно притягивать к себе отрицательный полюс соседней молекулы HF. Поскольку этот отрицательный полюс соседней молекулы не что иное, как атом фтора, имеющий три несвязывающие электронные пары, а 1s-орбиталь атома водорода частично вакантна, то между атомом водорода одной молекулы и атомом фтора другой, соседней, возникает донорно-акцепторное взаимодействие. В результате этого взаимодействия возникает связь между двумя молекулами HF, дополнительная связь. Это и есть водородная связь. Её обозначают точками или пунктирной линией: F — H … F. Система из трёх атомов линейна. Эта связь менее прочная и более длинная, чем обычная ковалентная:
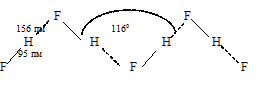
Вещества, молекулы которых соединены водородными связями, образуют системы, отличающиеся от аналогичных веществ, но не образующих водородные связи, некоторыми свойствами (температурами кипения, плавления и молекулярной массой). Обычно их температуры кипения и плавления выше, а молярные массы – больше. Объясняется это тем, что вещества, образующие водородные связи представляют собой высокомолекулярные структуры, например, фтороводород образует ассоциации из бесконечных плоских зигзагообразных цепей.
Ионная связь
Задание 73.
Какую химическую связь называют ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите два примера типичных ионных соединений. Напишите уравнения превращения соответствующих ионов в нейтральные атомы.
Решение:
Ионная связь образуется противоположно заряжёнными ионами, притягиваемыми друг к другу электростатическими силами. Связь этого типа осуществляется в результате взаимного электростатического притяжения противоположно заряжённых ионов. Положительно заряжённые ионы – катионы образуются из атомов элементов с низким потенциалом ионизации; к таким элементам относятся металлы главных подгрупп 1-й и 2-й группы. Металлы других групп и подгрупп тоже способны образовывать катионы. Анионы образуются из атомов – типичных неметаллов, обладающих большим сродством к электрону, например, Cl-, Br-, S2-.
Так, электростатическое взаимодействие в вакууме катиона Na+ и аниона Cl- приводит к образованию существующей в парах двухатомной молекулы NaCl. Взаимодействие этих молекул приводит к их конденсации и образованию ионных кристаллов хлорида натрия NaCl. И в молекуле Na+Cl-, и в кристаллах NaCl почти не происходит обобществления электронов: атом натрия почти полностью отдаёт электрон атому хлора. Оба атома при этом приобретают устойчивые конфигурации благородных газов:
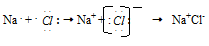
В отличие от ковалентной связи, ионная связь не обладает направленностью. Это объясняется тем, что электрическое поле иона обладает сферической симметрией, т. е. убывает с расстоянием по одному и тому же закону в любом направлении. Поэтому взаимодействие между ионами осуществляется одинаково независимо от направления. Ионная связь не обладает насыщаемостью. Это объясняется тем, что система из двух зарядов, одинаковых по абсолютной величине, но противоположных по знаку, создаёт в окружающем пространстве электрическое поле. Это означает, что два разноимённых иона, притянувшиеся друг к другу, сохраняют электростатически взаимодействовать с другими ионами.
Типичными ионными соединениями являются KCl и NaBr. Схемы превращения ионов в нейтральные атомы:
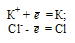
Степень окисления атома
Задание 74.
Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспаренных электронов, в соединениях: СН4, СН3ОН, НСООН, СО2.
Решение:
Степень окисления – это условный заряд атома в соединении, вычисленный из предположения, что все связи в соединении являются чисто ионными, а само соединение состоит из ионов. Валентность атома элементов определяется числом его химических связей в соединении.
СН4 – степень окисления углерода равна -4;
СН3ОН – степень окисления углерода равна -2;
НСООН – степень окисления углерода равна +2;
СО2 – степень окисления углерода равна +4.
Валентность углерода во всех этих соединениях равна четырём.
Конденсированное состояние вещества
Задание 75.
Какие силы молекулярного взаимодействия называют ориентационными, индукционными и дисперсионными? Когда возникают эти силы, и какова их природа?
Решение:
Силы межмолекулярного взаимодействия, называемые также силами Ван-дер-Ваальса, слабее ковалентных сил, но проявляются на больших расстояниях. В основе их лежит электростатическое взаимодействие диполей, но в различных веществах механизм возникновения диполей различен.
Если вещество состоит из полярных молекул, например, молекул Н2О или НСI, то в конденсированном состоянии соседние молекулярные диполи ориентируются друг по отношению к другу противоположно заряженными полюсами, вследствие чего наблюдается их взаимное притяжение. Такой вид межмолекулярного взаимодействия называется ориентационным взаимодействием. Тепловое движение молекул препятствует взаимной ориентации молекул, поэтому с ростом температуры ориентационный эффект ослабевает.
В случае веществ, состоящих из неполярных, но способных к поляризации молекул, например, СО2, наблюдается возникновение наведенных или индуцированных диполей. Причина их появления обычно состоит в том, что каждый атом создает вблизи себя электрическое поле, оказывающее поляризующее действие на ближайший атом соседней молекулы. Молекула поляризуется и образовавшийся индуцированный диполь в свою очередь поляризует соседние молекулы. В результате происходит взаимное притяжение молекул друг к другу. Это индукционное взаимодействие наблюдается также и у веществ с полярными молекулами, но при этом оно обычно значительно слабее ориентационного.
Наконец, движение электронов в атомах, а также колебание ядер, и связанное с этим не-прерывное изменение взаимного положения электронов и ядер вызывает появление мгновенных диполей. Мгновенные диполи возникают в твердых телах и жидкостях согласованно, причем ближайшие друг к другу участки соседних молекул оказываются заряженными электричеством противоположного знака, что приводит к их притяжению. Это явление, называемое дисперсионным взаимодействием, имеет место во всех веществах, находящихся в конденсированном состоянии. В частности, оно обусловливает переход благородных газов при низких температурах в жидкое состояние.
Чем больше полярность молекул, тем больше ориентационные силы. Чем больше деформируемость, чем слабее связаны внешние электроны атомов, т.е. чем эти атомы крупнее, тем значительнее дисперсионные силы. Таким образом, в ряду однотипных веществ дисперсионное взаимодействие возрастает с увеличением размеров атомов, составляющих молекулы этих веществ. Например, в случае НСI на долю дисперсионных сил приходится 81% всего межмолекулярного взаимодействия, для НВг эта величина составляет 95%, а для НI 99,5%. Индукционные силы почти всегда малы.
Источник
- Главная
- Вопросы & Ответы
- Вопрос 2258295
более месяца назад
Просмотров : 8
Ответов : 1
Лучший ответ:

Ионная связь, в отличие от ковалентной, возникает только между атомами разного вида.
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи:































Другие вопросы:
1)Как называется такое скопление населённых пунктов, которое изображено на картосхеме? 2)Какой город является центром? 3)Укажите причины формирования такого скопления городов.
более месяца назад
Смотреть ответ
Просмотров : 128
Ответов : 1
в секции занимается 60 детей, мальчиков в 4 раза больше чем двочек. Сколько мальчиов занимается в секции?
более месяца назад
Смотреть ответ
Просмотров : 10
Ответов : 1
Прозрачные пузырьки заполненые клеточным соком в растительной клетке вакуоли пробовала не подходит в этом слове 8 букв
более месяца назад
Смотреть ответ
Просмотров : 8
Ответов : 1
Решите уравнение:9,5х-(3,2х 1,8х) 3,75=6,9
более месяца назад
Смотреть ответ
Просмотров : 8
Ответов : 1
подбери и запиши двусложные слова которые нельзя перенести содной строки на другую
более месяца назад
Смотреть ответ
Просмотров : 7
Ответов : 1
Источник
