Какие свойства имеют вещества с молекулярными кристаллическими решетками

Темы кодификатора ЕГЭ: Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения.
Молекулярно-кинетическая теория
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно изучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом.
Если частицы расположены близко друг к другу, но хаотично, больше взаимодействуют между собой, совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости.
Если же частицы расположены близко к друг другу, но более упорядоченно, и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другие положения, то мы имеем дело с твердым веществом.
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 оС она замерзает – переходит из жидкого состояния в твердое, и при 100 оС закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.

Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.

Пластичность – это способность вещества деформироваться без разрушения.

Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.

В твердом веществе частицы вещества могут располагаться хаотично, либо более упорядоченно. Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным. Примеры аморфных веществ – уголь, слюдяное стекло.

Аморфный бор
Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом, а саму структуру – кристаллической решеткой. Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлах кристаллической решетки.
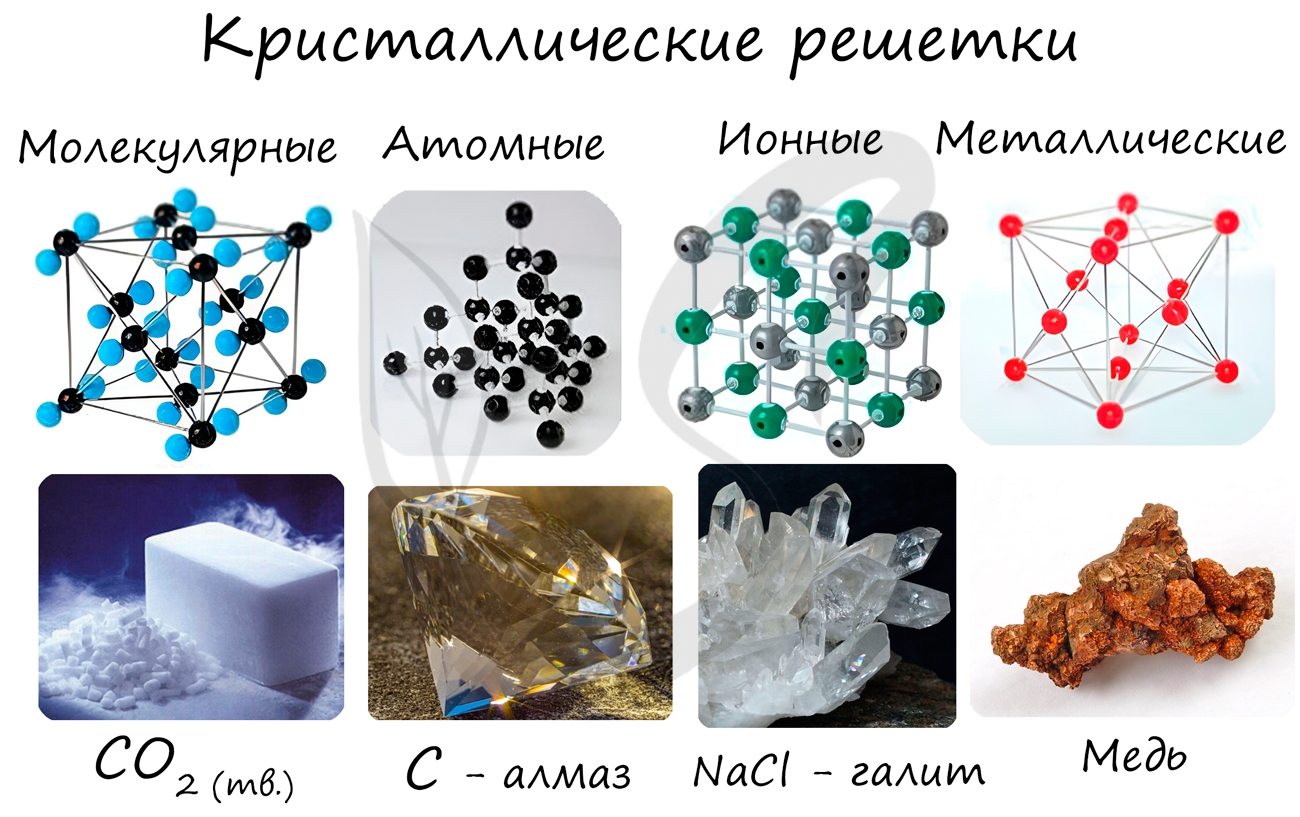
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку, различают атомную, молекулярную, ионную и металлическую кристаллическую структуру.
Атомная кристаллическая решетка

Атомная кристаллическая решетка образуется, когда в узлах кристалла расположены атомы. Атомы соединены между собой прочными ковалентными химическими связями. Соответственно, такая кристаллическая решетка будет очень прочной, разрушить ее непросто. Атомную кристаллическую решетку могут образовывать атомы с высокой валентностью, т.е. с большим числом связей с соседними атомами (4 или больше). Как правило, это неметаллы: простые вещества — кремния, бора, углерода (аллотропные модификации алмаз, графит), и их соединения (бороуглерод, оксид кремния (IV) и др.). Поскольку между неметаллами возникает преимущественно ковалентная химическая связь, свободных электронов (как и других заряженных частиц) в веществах с атомной кристаллической решеткой в большинстве случаев нет. Следовательно, такие вещества, как правило, очень плохо проводят электрический ток, т.е. являются диэлектриками. Это общие закономерности, из которых есть ряд исключений.

Связь между частицами в атомных кристаллах: ковалентная полярная или неполярная.
В узлах кристалла с атомной кристаллической структурой расположены атомы.
Фазовое состояние атомных кристаллов при нормальных условиях: как правило, твердые вещества.
Вещества, образующие в твердом состоянии атомные кристаллы:
- Простые вещества с высокой валентностью (расположены в середине таблицы Менделеева): бор, углерод, кремний, и др.
- Сложные вещества, образованные этими неметаллами: кремнезем (оксид кремния, кварцевый песок) SiO2; карбид кремния (корунд) SiC; карбид бора, нитрид бора и др.
Физические свойства веществ с атомной кристаллической решеткой:
— прочность;
— тугоплавкость (высокая температура плавления);
— низкая электропроводность;
— низкая теплопроводность;
— химическая инертность (неактивные вещества);
— нерастворимость в растворителях.
Молекулярная кристаллическая решетка

Молекулярная кристаллическая решетка – это такая решетка, в узлах которой располагаются молекулы. Удерживают молекулы в кристалле слабые силы межмолекулярного притяжения (силы Ван-дер-Ваальса, водородные связи, или электростатическое притяжение). Соответственно, такую кристаллическую решетку, как правило, довольно легко разрушить. Вещества с молекулярной кристаллической решеткой – легкоплавкие, непрочные. Чем больше сила притяжения между молекулами, тем выше температура плавления вещества. Как правило, температуры плавления веществ с молекулярной кристаллической решеткой не выше 200-300К. Поэтому при нормальных условиях большинство веществ с молекулярной кристаллической решеткой существует в виде газов или жидкостей. Молекулярную кристаллическую решетку, как правило, образуют в твердом виде кислоты, оксиды неметаллов, прочие бинарные соединения неметаллов, простые вещества, образующие устойчивые молекулы (кислород О2, азот N2, вода H2O и др.), органические вещества. Как правило, это вещества с ковалентной полярной (реже неполярной) связью. Т.к. электроны задействованы в химических связях, вещества с молекулярной кристаллической решеткой – диэлектрики, плохо проводят тепло.

Связь между частицами в молекулярных кристаллах: межмолекулярные водородные связи, электростатические или межмолекулярные силы притяжения.
В узлах кристалла с молекулярной кристаллической структурой расположены молекулы.
Фазовое состояние молекулярных кристаллов при нормальных условиях: газы, жидкости и твердые вещества.
Вещества, образующие в твердом состоянии молекулярные кристаллы:
- Простые вещества-неметаллы, образующие маленькие прочные молекулы (O2, N2, H2, S8 и др.);
- Сложные вещества (соединения неметаллов) с ковалентными полярными связями (кроме оксидов кремния и бора, соединений кремния и углерода) — вода H2O, оксид серы SO3 и др.
- Одноатомные инертные газы (гелий, неон, аргон, криптон и др.);
- Большинство органических веществ, в которых нет ионных связей — метан CH4, бензол С6Н6 и др.
Физические свойства веществ с молекулярной кристаллической решеткой:
— легкоплавкость (низкая температура плавления):
— высокая сжимаемость;
— молекулярные кристаллы в твердом виде, а также в растворах и расплавах не проводят ток;
— фазовое состояние при нормальных условиях – газы, жидкости, твердые вещества;
— высокая летучесть;
— малая твердость.
Ионная кристаллическая решетка

В случае, если в узлах кристалла находятся заряженные частицы – ионы, мы можем говорить о ионной кристаллической решетке. Как правило, с ионных кристаллах чередуются положительные ионы (катионы) и отрицательные ионы (анионы), поэтому частицы в кристалле удерживаются силами электростатического притяжения. В зависимости от типа кристалла и типа ионов, образующих кристалл, такие вещества могут быть довольно прочными и тугоплавкими. В твердом состоянии подвижных заряженных частиц в ионных кристаллах, как правило, нет. Зато при растворении или расплавлении кристалла ионы высвобождаются и могут двигаться под действием внешнего электрического поля. Т.е. проводят ток только растворы или расплавы ионных кристаллов. Ионная кристаллическая решетка характерна для веществ с ионной химической связью. Примеры таких веществ – поваренная соль NaCl, карбонат кальция – CaCO3 и др. Ионную кристаллическую решетку, как правило, в твердой фазе образуют соли, основания, а также оксиды металлов и бинарные соединения металлов и неметаллов.
Связь между частицами в ионных кристаллах: ионная химическая связь.
В узлах кристалла с ионной решеткой расположены ионы.
Фазовое состояние ионных кристаллов при нормальных условиях: как правило, твердые вещества.
Химические вещества с ионной кристаллической решеткой:
- Соли (органические и неорганические), в том числе соли аммония (например, хлорид аммония NH4Cl);
- Основания;
- Оксиды металлов;
- Бинарные соединения, в составе которых есть металлы и неметаллы.
Физические свойства веществ с ионной кристаллической структурой:
— высокая температура плавления (тугоплавкость);
— растворы и расплавы ионных кристаллов – проводники тока;
— большинство соединений растворимы в полярных растворителях (вода);
— твердое фазовое состояние у большинства соединений при нормальных условиях.
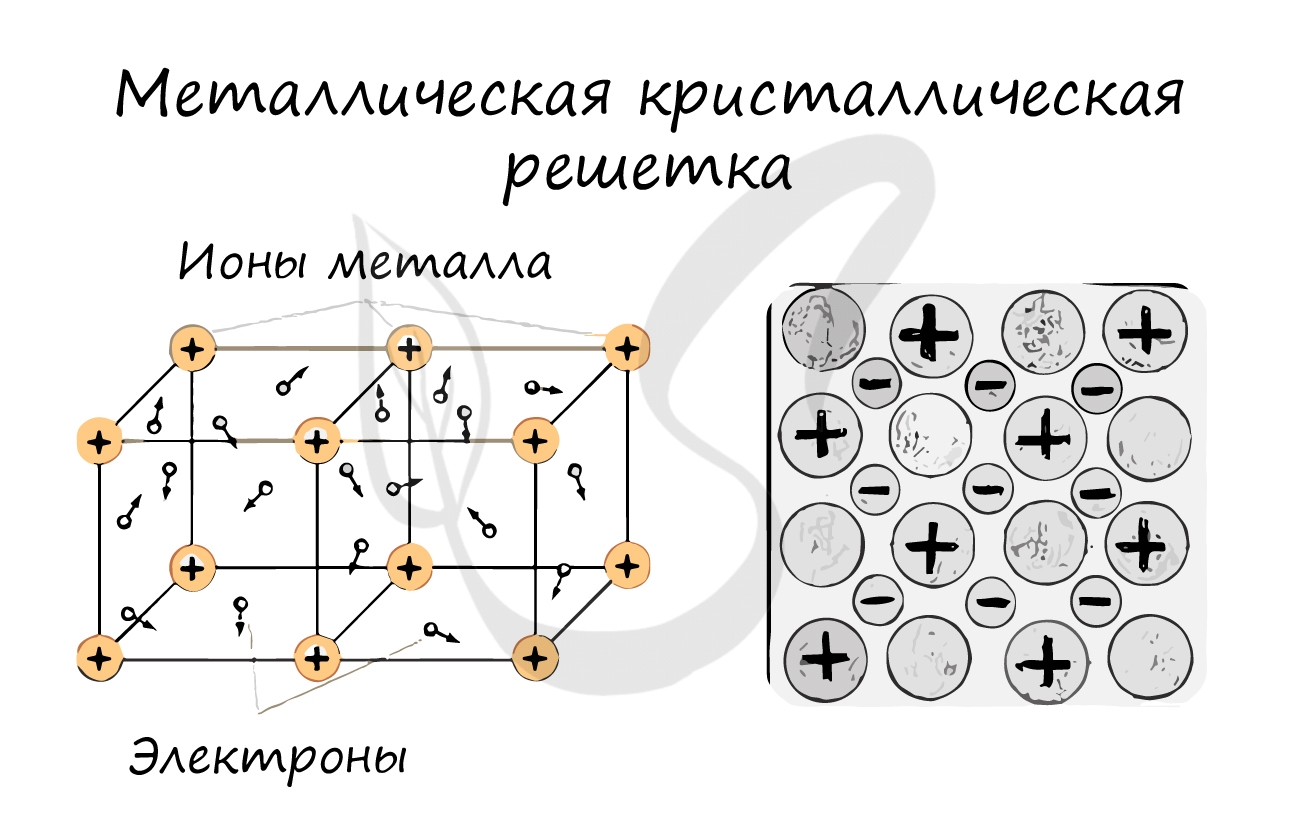
Металлическая кристаллическая решетка

И, наконец, металлы характеризуются особым видом пространственной структуры – металлической кристаллической решеткой, которая обусловлена металлической химической связью. Атомы металлов довольно слабо удерживают валентные электроны. В кристалле, образованном металлом, происходят одновременно следующие процессы: часть атомов отдает электроны и становится положительно заряженными ионами; эти электроны хаотично перемещаются в кристалле; часть электронов притягивается к ионам. Эти процессы происходят одновременно и хаотично. Таким образом, возникают ионы, как при образовании ионной связи, и образуются общие электроны, как при образовании ковалентной связи. Свободные электроны перемещаются хаотично и непрерывно по всему объему кристалла, как газ. Поэтому иногда их называют «электронным газом». Из-за наличия большого числа подвижных заряженных частиц металлы проводят ток, тепло. Температура плавления металлов сильно варьируется. Металлы также характеризуются своеобразным металлическим блеском, ковкостью, т.е. способностью изменять форму без разрушения при сильном механическом воздействии, т.к. химические связи при этом не разрушаются.

Связь между частицами: металлическая химическая связь.
В узлах кристалла с металлической решеткой расположены ионы металлов и атомы.
Фазовое состояние металлов при обычных условиях: как правило, твердые вещества (исключение — ртуть, жидкость при обычных условиях).
Химические вещества с металлической кристаллической решеткой — простые вещества-металлы.
Физические свойства веществ с металлической кристаллической решеткой:
— высокая тепло- и электропроводность;
— ковкость и пластичность;
— металлический блеск;
— металлы, как правило, нерастворимы в растворителях;
— большинство металлов – твердые вещества при нормальных условиях.
Сравнение свойств веществ с различными кристаллическими решетками
Тип кристаллической решетки (или отсутствие кристаллической решетки) позволяет оценить основные физические свойства вещества. Для примерного сравнения типичных физических свойств соединений с разными кристаллическими решетками очень удобно использовать химические вещества с характерными свойствами. Для молекулярной решетки это, например, углекислый газ, для атомной кристаллической решетки — алмаз, для металлической — медь, и для ионной кристаллической решетки — поваренная соль, хлорид натрия NaCl.

Сводная таблица по структурам простых веществ, образованных химическими элементами из главных подгрупп таблицы Менделеева (элементы побочных подгрупп являются металлами, следовательно, имеют металлическую кристаллическую решетку).

Итоговая таблица связи свойств веществ со строением:

Источник
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки
кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают
пространственное расположение атомов.
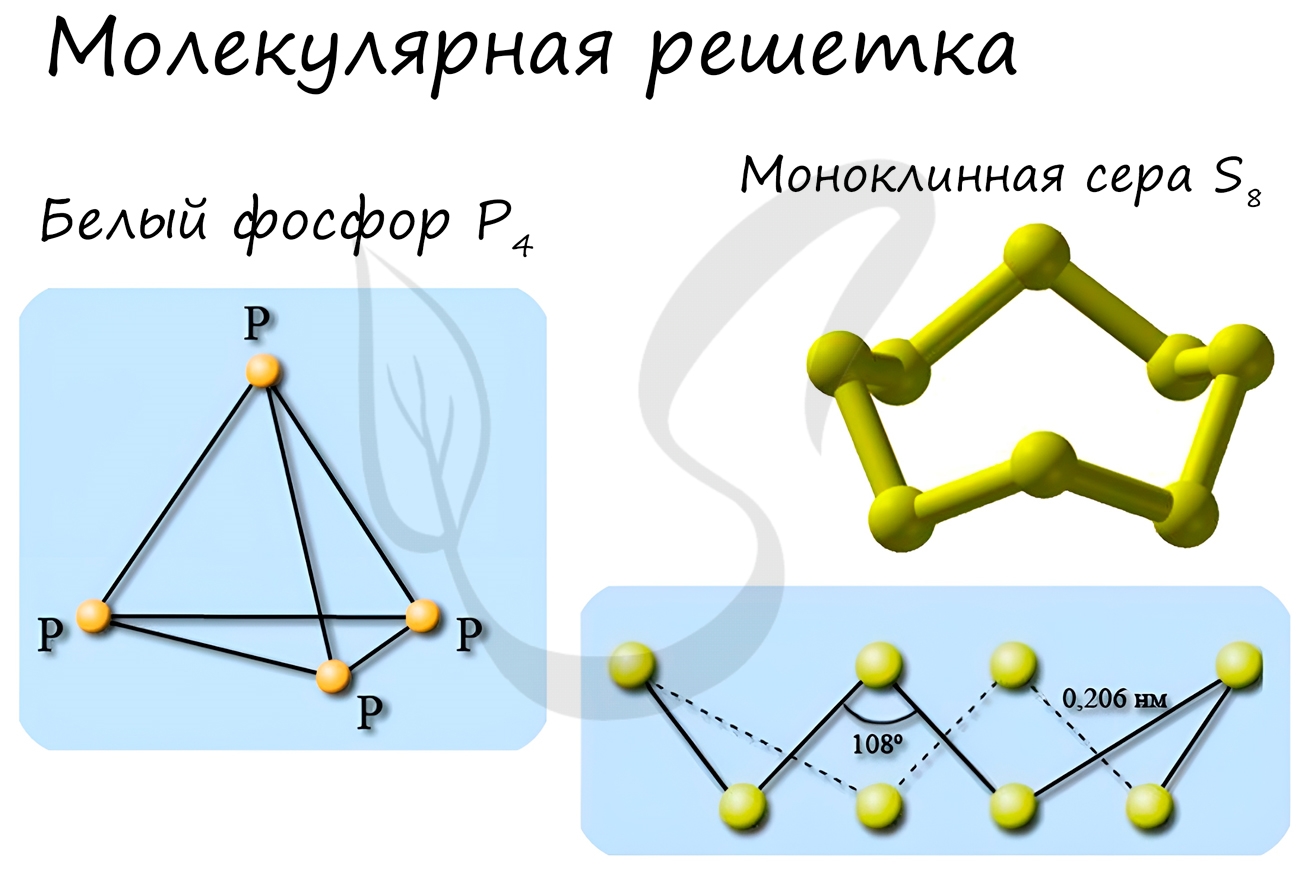
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей.
Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с
молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие
температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2.
Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы
подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли,
оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью – NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко
растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.
Примеры: NaCl, MgCl2, NH4Br, KNO3, Li2O, Na3PO4.

Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят
электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные,
нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Эта лекция будет посвящена
следующим понятиям: “вещества молекулярного и немолекулярного
строения”, “кристаллические решётки”.
Молекулярные
вещества
Молекулярные
вещества –
это вещества, мельчайшими структурными частицами которых являются молекулы
Молекулы – наименьшая частица молекулярного
вещества, способная существовать самостоятельно и сохраняющая его химические
свойства.
Молекулярные
вещества имеют низкие температуры плавления и кипения и находятся в стандартных
условиях в твердом, жидком или газообразном состоянии.
Например,
Вода – жидкость, tпл=0°С;
tкип=100°С
Вода
– самое известное и весьма распространенное вещество на нашей планете:
поверхность Земли на 3/4 покрыта водой, человек
на 65 % состоит из воды, без воды невозможна жизнь, так как в водном растворе
протекают все клеточные процессы организма. Вода – молекулярное вещество. Это
одно из немногих веществ, которое в природных условиях встречается в твердом,
жидком и газообразном состояниях, и единственное вещество, для которого в
каждом из этих состояний есть свое название. Особенностями строения воды
вызваны ее необычные свойства. Например, при замерзании вода увеличивается в
объеме, поэтому лед плавает в своем расплаве – жидкой воде, а наибольшая
плотность воды наблюдается при 4 oС, поэтому зимой большие
водоемы до дна не промерзают. На свойствах воды основана и сама шкала
температур Цельсия (0 o – температура замерзания,
100 o – температура кипения). С причинами этих явлений и с
химическими свойствами воды вы познакомитесь позже.
Немолекулярные
вещества
Немолекулярные
вещества –
это вещества, мельчайшими структурными частицами которых являются атомы или ионы.
Немолекулярные
вещества находятся в стандартных условиях в твердом агрегатном состоянии и
имеют высокие температуры плавления и кипения.
Например, Поваренная соль – твердое вещество, tпл=801°С;
tкип=1465°С; Железо
Железо – серебристо-белый, блестящий,
ковкий металл. Это немолекулярное вещество. Среди металлов железо занимает
второе место после алюминия по распространенности в природе и первое место по
значению для человечества. вместе с другим металлом – никелем – оно образует
ядро нашей планеты. Чистое железо не имеет широкого практического применения.
Знаменитая Кутубская колонна, расположенная в окрестностях Дели, высотой около
семи метров и весом 6,5 т, имеющая возраст почти 2800 лет (она поставлена в IX
в. до н. э.) – один из немногих примеров использования чистого железа (99,72
%); возможно, что именно чистотой материала и объясняется долговечность и
коррозионная устойчивость этого сооружения.

В
виде чугуна, стали и других сплавов железо используется буквально во всех
отраслях техники. Его ценные магнитные свойства используются в генераторах
электрического тока и электромоторах. Железо является жизненно необходимым
элементом для человека и животных, так как оно входит в состав гемоглобина
крови. При его недостатке клетки тканей получают недостаточно кислорода, что
ведет к очень тяжелым последствиям.
Для большинства веществ характерна способность в
зависимости от условий находиться в одном из трёх агрегатных состояний:
твёрдом, жидком, газообразным.
Например, вода при нормальном давлении в интервале
температур 0-100°С является жидкостью, при температуре выше 100°С находится в
газообразном состоянии, а при температуре ниже 0°С является твёрдым веществом.
Вещества в твёрдом состоянии различают аморфные и кристаллические.
Характерной особенностью аморфных тел является
отсутствие определенной температуры плавления, то есть отсутствует четкий
переход от твердого состояния к жидкому: при нагревании аморфное тело
становится только более текучим. К аморфным относят смола, воск, парафин,
стекло, большинство пластмасс и т.д.
Для кристаллических веществ характерна конкретная
температура плавления, т.е. вещество с кристаллическим строением переходит из
твёрдого состояния в жидкое не постепенно, а резко, при достижении конкретной
температуры, например, сахар, лёд, поваренная соль. Если
скорость роста кристаллов мала при охлаждении – образуется стеклообразное
состояние (аморфное).
Разница в физических свойствах аморфных и
кристаллических твёрдых веществ обусловлена строением. В аморфном веществе
отсутствует порядок в расположение частиц.

Рис. Примеры решеток кристаллических и аморфных тел
– кварц аморфный и кристаллический.
Таким образом, в случае кристаллических
веществ можно говорить о таком понятии, как кристаллическая решётка.
При низких температурах, когда тепловое движение
затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую
решётку.
Кристаллическая решетка – это пространственный
каркас, соединяющий точки пространства, в которых находятся частицы, образующие
кристалл
В самой кристаллической решетке различают узлы –
точки пространства, в которых находятся частицы, образующие кристалл и меж
узловое пространство.
В зависимости от того, какие частицы в узлах
кристаллической решётки, различают: молекулярную,
атомную, ионную и металлические кристаллические решётки.
Пример вещества с атомной кристаллической решёткой:

Пример вещества с ионной кристаллической решёткой – кристаллическая решётка поваренной соли NaCl:

Пример вещества с молекулярной кристаллической решёткой:

Пример вещества с металлической кристаллической решёткой:


Свойства веществ с различной кристаллической решёткой (таблица)
Между положением элемента в периодической системе и
кристаллической решёткой его соответствующего простого вещества существует
тесная взаимосвязь.

Выполните задания по данной теме:
1. Какой тип
кристаллической решётки у следующих широко используемых в быту веществ: вода,
уксусная кислота (CH3COOH), сахар (C12H22O11),
калийное удобрение (KCl), речной
песок (SiO2) –
температура плавления 17100C, аммиак
(NH3), поваренная соль? Сделайте обобщённый вывод: по
каким свойствам вещества можно определить тип его кристаллической решётки?
2. По
формулам приведённых веществ: SiC, CS2, NaBr, C2H2 –
определите тип кристаллической решётки (ионная, молекулярная) каждого
соединения и на основе этого опишите физические свойства каждого из четырёх
веществ.
3. Тренажёр
№1. “Кристаллические решётки”
4. Тренажёр
№2. “Тестовые задания”
5. Тест
(самоконтроль):
A.
Вещества,
имеющие молекулярную кристаллическую решётку, как правило:
a).
тугоплавки и хорошо растворимы в воде
б).
легкоплавки и летучи
в).
Тверды и электропроводны
г).
Теплопроводны и пластичны
B.
Понятия
«молекула» не применимо по отношению к структурной единице вещества:
a).
вода
б).
кислород
в).
алмаз
г).
озон
C.
Атомная
кристаллическая решётка характерна для:
a).
алюминия и
графита
б).
серы и йода
в).
оксида кремния и хлорида
натрия
г).
алмаза и бора
D.
Если
вещество хорошо растворимо в воде, имеет высокую температуру плавления, электропроводно,
то его кристаллическая решётка:
а).
молекулярная
б).
атомная
в).
ионная
г).
металлическая
Источник
