Какие свойства имеет спирт

Спирты — сложные органические соединения, углеводороды, обязательно 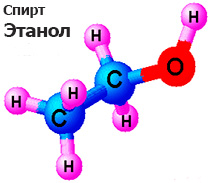 содержащие один или несколько гидроксилов (групп ОН—), связанных с углеводородным радикалом.
содержащие один или несколько гидроксилов (групп ОН—), связанных с углеводородным радикалом.
История открытия
По мнению историков, уже за 8 веков до нашей эры человек употреблял напитки, содержащие этиловый спирт. Их получали методом сбраживания фруктов или меда. В чистом виде этанол был выделен из вина арабами примерно в VI-VII веках, а европейцами — на пять столетий позже. В XVII веке перегонкой древесины был получен метанол, а в XIX веке химики установили, что спирты — это целая категория органических веществ.
Классификация
— По количеству гидроксилов спирты делят на одно-, двух-, трех-, многоатомные. Например, одноатомный этанол; трехатомный глицерин.
— По тому, с каким числом радикалов связан атом углерода, соединенный с группой ОН—, спирты разделяют на первичные, вторичные, третичные.
— По характеру связей радикала спирты бывают предельными, непредельными, ароматическими. В ароматических спиртах гидроксил связан не напрямую с бензольным кольцом, а через другой (другие) радикалы.
— Соединения, в которых ОН— прямо связана с бензольным циклом, считаются отдельным классом фенолов.
Свойства
 В зависимости от того, сколько в молекуле углеводородных радикалов, спирты могут быть жидкими, вязкими, твердыми. Водорастворимость уменьшается с ростом количества радикалов.
В зависимости от того, сколько в молекуле углеводородных радикалов, спирты могут быть жидкими, вязкими, твердыми. Водорастворимость уменьшается с ростом количества радикалов.
Простейшие спирты смешиваются с водой в любых пропорциях. Если же в молекулу входит более 9 радикалов, то вообще не растворяются в воде. Все спирты хорошо растворяются в органических растворителях.
— Спирты горят, выделяя большое количество энергии.
— Вступают в реакции с металлами, в результате чего получаются соли — алкоголяты.
— Взаимодействуют с основаниями, проявляя качества слабых кислот.
— Реагируют с кислотами и ангидридами, проявляя оснóвные свойства. Результатом реакций являются сложные эфиры.
— Воздействие сильными окислителями приводит к образованию альдегидов или кетонов (в зависимости от вида спирта).
— При определенных условиях из спиртов получают простые эфиры, алкены (соединения с двойной связью), галогенуглеводороды, амины (производные от аммиака углеводороды).
Спирты токсичны для человеческого организма, некоторые — ядовиты (метилен, этиленгликоль). Этилен оказывает наркотическое воздействие. Опасны и пары спиртов, поэтому работы с растворителями на основе спирта должны производиться с соблюдением техники безопасности.
Тем не менее, спирты участвуют в естественном метаболизме растений, животных и человека. К категории спиртов относятся такие жизненно важные вещества как витамины A и D, стероидные гормоны эстрадиол и кортизол. Более половины липидов, поставляющих энергию нашему организму, имеют в своей основе глицерин.
Применение
— В органическом синтезе.
— Биотопливо, добавки в топливо, ингредиент тормозной жидкости, гидравлических жидкостей.
— Растворители.
— Сырье для производства ПАВ, полимеров, пестицидов, антифризов, взрывчатых и отравляющих веществ, бытовой химии.
— Душистые вещества для парфюмерии. Входят в состав косметических и медицинских средств.
— Основа алкогольных напитков, растворитель для эссенций; сахарозаменитель (маннит и т.п.); краситель (лютеин), ароматизатор (ментол).
В нашем магазине можно купить спирты разного вида.
Бутиловый спирт
Одноатомный спирт. Применяется в качестве растворителя; пластификатора при  изготовлении полимеров; модификатора формальдегидных смол; сырья для органического синтеза и получения душистых веществ для парфюмерии; добавки к топливу.
изготовлении полимеров; модификатора формальдегидных смол; сырья для органического синтеза и получения душистых веществ для парфюмерии; добавки к топливу.
Фурфуриловый спирт
Одноатомный спирт. Востребован для полимеризации смол и пластиков, как растворитель и пленкообразователь в лакокрасочной продукции; сырье для органического синтеза; связующий и уплотняющий агент при производстве полимербетона.
Изопропиловый спирт (пропанол-2)
Вторичный одноатомный спирт. Активно используется в медицине, металлургии, химпроме. Заменитель этанола в парфюмерных, косметических, дезинфицирующих продуктах, средствах бытовой химии, антифризах, очистителях.
Этиленгликоль
Двухатомный спирт. Применяется при производстве полимеров; красок для типографий и текстильного производства; входит в состав антифризов, тормозных жидкостей, теплоносителей. Используется для осушения газов; как сырье для органического синтеза; растворитель; средство для криогенной «заморозки» живых организмов.
Глицерин
Трехатомный спирт. Востребован в косметологии, пищепроме, медицине, как сырье в орг. синтезе; для изготовления взрывчатого вещества нитроглицерина. Применяется в сельском хозяйстве, электротехнике, текстильной, бумажной, кожевенной, табачной, лакокрасочной индустрии, в производстве пластиков и средств бытовой химии.
Маннит
Шестиатомный (многоатомный) спирт. Применяется как пищевая добавка; сырье для изготовления лаков, красок, олиф, смол; входит в состав ПАВ, парфюмерных продуктов.
Источник
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов

Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
- слабые кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- отрыв воды (элиминирование) – дегидратация
- окисление
- образование сложных эфиров — этерификация
1. Кислотные свойства
Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды.
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
![]()
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому спирты не взаимодействуют с растворами щелочей.
Многоатомные спирты также не реагируют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
![]()
Например, этанол взаимодействует с калием с образованием этилата калия и водорода.
![]()
Видеоопыт взаимодействия спиртов (метанола, этанола и бутанола) с натрием можно посмотреть здесь.
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
Например, этилат калия разлагается водой:
CH3OH > первичные спирты > вторичные спирты > третичные спирты
Многоатомные спирты также реагируют с активными металлами:

Видеоопыт взаимодействия глицерина с натрием можно посмотреть здесь.
1.3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).
Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди:
Видеоопыт взаимодействия этиленгликоля с гидроксидом меди (II) можно посмотреть здесь.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
Например, этанол реагирует с бромоводородом.

Видеоопыт взаимодействия этилового спирта с бромоводородом можно посмотреть здесь.
третичные > вторичные > первичные > CH3OH.
Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами.
Например, этиленгликоль реагирует с бромоводородом:

2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
Например, при взаимодействии этанола с аммиаком образуется этиламин.
![]()
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.

Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):

Многоатомные спирты вступают в реакции этерификации с органическими и неорганическими кислотами.
Например, этиленгликоль реагирует с уксусной кислотой с образованием ацетата этиленгликоля:

2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат:
Например, глицерин под действием азотной кислоты образует тринитрат глицерина (тринитроглицерин):
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140оС) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен:
В качестве катализатора этой реакции также используют оксид алюминия.
Отщепление воды от несимметричных спиртов проходит в соответствии с правилом Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
Например, в присутствии концентрированной серной кислоты при нагревании выше 140оС из бутанола-2 в основном образуется бутен-2:
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
Например, при дегидратации этанола при температуре до 140оС образуется диэтиловый эфир:
![]()
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Первичный спирт → альдегид → карбоновая кислота
Метанол → формальдегид → углекислый газ
Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол < первичные спирты < вторичные спирты < третичные спирты
Продукты окисления многоатомных спиртов зависят от их строения. При окислении оксидом меди многоатомные спирты образуют карбонильные соединения.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, этанол окисляется оксидом меди до уксусного альдегида

Видеоопыт окисления этанола оксидом меди (II) можно посмотреть здесь.
Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона

Третичные спирты окисляются только в жестких условиях.
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, при окислении пропанола-1 образуется пропаналь

Видеоопыт каталитического окисления этанола кислородом можно посмотреть здесь.
Например, пропанол-2 окисляется кислородом при нагревании в присутствии меди до ацетона
Третичные спирты окисляются только в жестких условиях.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот, вторичные спирты окисляются до кетонов, метанол окисляется до углекислого газа.
При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси.
Третичные спирты окисляются только в жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов. При этом происходит разрыв углеродной цепи и могут образоваться углекислый газ, карбоновая кислота или кетон, в зависимости от строения спирта.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Первичный спирт R-СН2-ОН | R-COOH/ R-CHO | R-COOK/ R-CHO |
| Вторичный спирт R1-СНОН-R2 | R1-СО-R2 | R1-СО-R2 |
Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ
![]()
Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота

Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон

4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
Например, уравнение сгорания метанола:
2CH3OH + 3O2 = 2CO2 + 4H2O
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола и первичных спиртов образуются альдегиды, при дегидрировании вторичных спиртов образуются кетоны.
Например, при дегидрировании этанола образуется этаналь

Например, при дегидрировании этиленгликоля образуется диальдегид (глиоксаль)

Источник
Здравствуйте дорогие подписчики и гости моего канала. Сегодня вас ждет статья, посвященная такому классу органических соединений, как спирты. Это весьма обширный класс веществ, часто встречающийся, как в окружающем мире, так и в тестах ЕГЭ. В этой статье я постараюсь обобщить различные элементы школьной программы относительно данной группы веществ, чтобы помочь тем, кто сдает экзамен или просто удовлетворить интерес тех, кто решил ознакомиться с современной школьной программой профильного уровня.
Начнем с определения!
Спирты – это органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (-OH), соединённых с углеводородным радикалом.
В зависимости от числа гидроксогрупп, в молекуле спирта, представителей данного класса органических соединений делят на:
Одноатомные спирты (алканолы) – это органические соединения в которых углеводородный радикал связан с одной группой –OH.
Общая формула предельных одноатомных спиртов:
CnH2n+1-OH
Двухатомные спирты (гликоли или диолы) – это органические соединения в которых две гидроксильные группы связаны с углеводородным радикалом.
Общая формула двухатомных спиртов:
CnH2n(OH)2
Гомологический ряд двухатомных спиртов (гликолей), может быть представлен так:
Трехатомный спирты (алкантриолы) – это органические вещества, содержащие в своем составе три гидроксильные группы, связанные с углеводородным радикалом.
К таким соединениям относится например глицерин:
Если в молекуле спирта содержится более трех гидроксильных групп, его относят к полиатомным спиртам, например шестиатомный спирт сорбит:
По характеру углеводородного радикала выделяют следующие спирты:
– Предельные спирты, содержащие в молекуле лишь насыщенный углеводородный радикал, например:
CH3-OH метанол
CH3-CH2-OH этанол
CH3-CH2-CH2-OH пропанол
– Непредельные спирты, содержащие в молекуле кратные (двойные или тройные) связи, между атомами углерода.
H2C=CH-OH виниловый спирт
CH2=CH-CH2-OH пропен-2-ол-1
– Ароматические спирты, содержащие в молекуле бензольное кольцо и гидроксогруппу, связанные друг с другом не на прямую, а через атомы углерода, например:
Так же не забываем, что по характеру углерода с которым соединена -OH группа, одноатомные спирты делят на:
Уже первые члены гомологического ряда предельных одноатомных спиртов, несмотря на небольшие значения относительных молекулярных масс, представляют собой жидкости. Это объясняется образованием между молекулами особой химической водородной связи.
Водородная связь – это межмолекулярная связь между атомом водорода одной молекулы и атомом сильного электроотрицательного элемента (например фтора, кислорода, азота) другой молекулы.
За счет водородной связи молекулы простейших спиртов ассоциированы в жидкости:
Поговорим подробнее о некоторых конкретных представителях класса спиртов:
Метанол (метиловый спирт или древесный спирт) – это бесцветная жидкость, со специфическим запахом, ядовит (при приеме внутрь вызывает слепоту и негативно воздействует на нервную и сердечно – сосудистую систему). Однако, несмотря на это метанол находит широкое применение:
- Он является отличным растворителем многих веществ.
- Применяется для синтеза формальдегида и формалина.
- Используется для синтеза некоторых эфиров.
- Применяется как добавка к моторному топливу.
- Используется при производстве красок.
Этанол (Этиловый спирт) – бесцветная прозрачная жидкость, со специфическим запахом, летучая и горючая. Является депрессантом – психоактивным веществом, угнетающим ЦНС человека. Применение:
- Широко применяется как растворитель.
- Входит в состав моющих средств, для стекол и сантехники.
- Служит сырьем для получения многих химических веществ, таких как: ацетальдегид, диэтиловый эфир, уксусная кислота, этилацетат, этилен и др..
- Используется для приготовления различных напитков в алкогольной промышленности.
- Является наполнителем в спиртовых термометрах.
- В медицине применяется как дезинфицирующее средство.
Этиленгликоль – это прозрачная, бесцветная жидкость, слегка маслянистой консистенции. Не имеет запаха. Токсичен! Попадание его в организм, может привести к необратимым последствиям и смерти. Применение:
- В качестве растворителя красящих веществ.
- При производстве автомобильных антифризов (низкозамерзающих жидкостей).
- При производстве целлофана.
- В производстве синтетических волокон.
- Может входить в состав средств, для мытья окон.
Глицерин – представляет собой густую и прозрачную жидкость, маслянистой консистенции. Не ядовит. Неограниченно растворим в воде, более того, очень гигроскопичен (если оставить глицерин в открытом сосуде, его масса может увеличиться до 40%, за счет поглощённой влаги из воздуха). Применение:
- Широко используется в косметической промышленности, в составе кремов, гелей, помад и т.д.
- В кожевенной промышленности (используется для защиты кожи от высыхания).
- Используется как пищевая добавка (E422) в пищевой промышленности.
- В пиротехники, глицерин используется для производства взрывчатого вещества – нитроглицерина.
- В медицине, как сосудорасширяющее средство.
Теперь поговорим о способах получения спиртов:
1. Гидратация алкенов.
2. Щелочной гидролиз галагеналканов.
Например:
Или:
Однако, не путайте взаимодействие хлоралканов с водным и спиртовым раствором щелочи, так как во втором случае произойдет дегидрогалогенирование, то есть отщепление атомов водорода и галогена, от галогеналкана:
3. Восстановление карбонильных соединений (альдегидов).
Альдегиды – это класс органических веществ, чье название происходит от латинских слов «alcohol dehydrogenatus», что означает «спирт лишенный водорода» или «алкоголь дегидрированый». Таким образом, при гидрирование или восстановление альдегидов, мы получаем спирты.
При гидрирование родственных альдегидам соединений, кетонов, можно получить двухатомные спирты:
4. Метанол можно получить из синтез – газа (смеси угарного газа и водорода).
5. Этанол можно получить ферментативным брожением углеводов.
Это очень древняя химическая реакция, которая известна людям с незапамятных времен.
Химические свойства спиртов:
1. Взаимодействие со щелочными и щелочноземельными металлами.
Водород гидроксильной группы спиртов способен восстанавливаться щелочными и щелочноземельными металлами (такими как Li, Na, K, Ca, Sr, Ba).
В результате подобных химических реакций получаются соли – алкоголяты. При этом соли метанола, носят название – метилаты, этанола – этилаты и т.д.
Важно не забывать, что алкоголяты, как соли очень слабой кислоты и сильного основания могут быть полностью гидролизованы водой.
С водными растворами щелочей спирты не взаимодействуют.
2. Взаимодействие спиртов с кислотами (этерификация).
– Возможно взаимодействие спиртов с органическими кислотами, приводящие к образованию сложных эфиров.
– Так же возможно взаимодействие спиртов с неорганическими кислотами.
Реакция с азотной кислотой будет протекать по схеме:
3. Взаимодействие с галогенводородами.
При этом происходит замещение гидроксильной группы на галоген, что ведет к образованию галогеналканов.
4. Взаимодействие с альдегидами.
В данном случае не обязательно запоминать то, как записывается данная реакция. Но о возможности протекания такой реакции, забывать, ни в коем случае, не стоит.
5. Дегидратация.
В зависимости от условий возможны два варианта протекания данной реакции.
6. Взаимодействие с аммиаком.
Эта реакция крайне важна, так лежит в основе промышленного способа получения некоторых аминов.
7. Окисление спиртов оксидом меди (II).
При этом первичные спирты окисляются до альдегидов, а вторичные до кетонов:
Третичные спирты оксидом меди (II) не окисляются.
8. Окисление перманганатом калия в кислой среде.
При этом, происходит полное окисление спирта до карбоновой кислоты:
5C2H5OH + 4KMnO4 + 6H2SO4 = 5CH3COOH + 11H2O + 2K2SO4 + 4MnSO
Вторичные спирты при такой реакции окисляются до кетонов:
5CH3- CH(OH)- CH3 +2KMnO4+3H2SO4=5 CH3-C(O)- CH3 +K2SO4+2MnSO4+8H20
Метанол окисляется до углекислого газа и воды:
CH3OH + KMnO4 + H2SO4 = CO2 + MnSO4 + K2SO4 + H2O.
9. Окисление бихроматом калия в кислой среде.
Так как бихромат калия более мягкий окислитель, чем перманганат калия, окисление первичных спиртов в нем идет до альдегидов.
3 C2H5OH + K2Cr2O7 + 4 H2SO4 → Cr2(SO4)3 + 3 CH3CHO + K2SO4 + 7 H2O
10. Окисление многоатомных спиртов свежеполученным осадком гидроксида меди (II).
Это качественная реакция сопровождающаяся образованием ярко – синего растворимого в воде комплекса.
11. Взаимодействие с кислородом (горение).
Как и при горение большинства органических веществ, в результате реакции выделяется углекислый газ и вода:
C2H5OH + 3O2 → 2CO2 + 3H2O
Вот собственно и все, что необходимо знать о спиртах, для удачной сдачи экзаменов! Конечно во второй части теста ЕГЭ возможно встретится и с более экзотическими реакциями, но такой шанс не велик.
До новых встреч!
Источник



