Какие свойства имеет ромбическая сера

СЕРА S


Cера в природе
Самородная сера
Украина,
Поволжье, Центральная Азия и др
Сульфиды
PbS – свинцовый блеск
Cu2S – медный блеск
ZnS – цинковая обманка
FeS2 – пирит, серный колчедан, кошачье золото
H2S – сероводород (в минеральных источниках и
природном газе)
Белки
Волосы,
кожные покровы, ногти…
Сульфаты
CaSO4 x 2H2O – гипс
MgSO4 x 7H2O – горькая соль (английская)
Na2SO4 x 10H2O – глауберова соль (мирабилит)
Физические
свойства
Твердое
кристаллическое вещество желтого цвета, нерастворима в воде, водой не
смачивается (плавает на поверхности), t°кип = 445°С
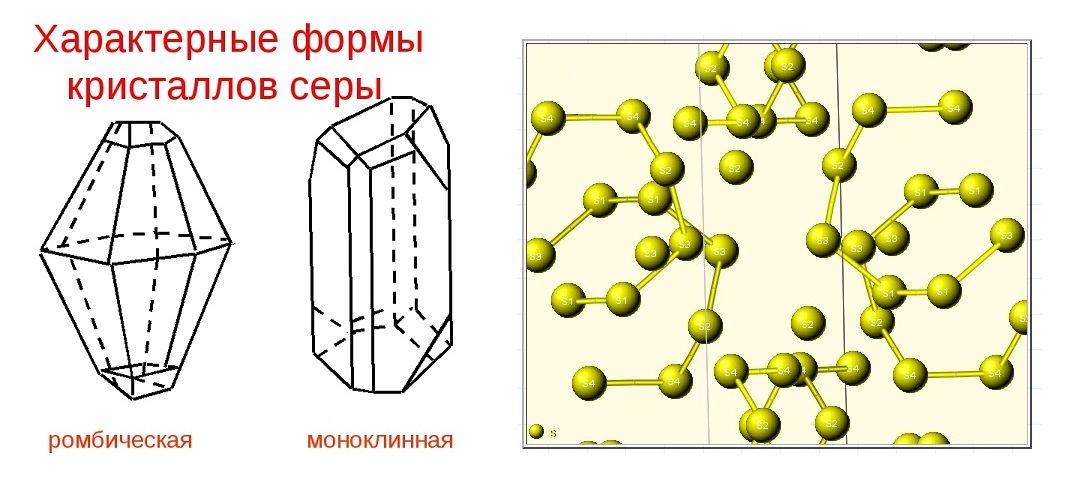
Аллотропия
Для серы характерны несколько аллотропных модификаций:

Ромбическая (a – сера) – S8 t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая | Моноклинная (b – сера) – S8 темно-желтые t°пл. = 119°C; ρ = 1,96 г/см3. Устойчивая при температуре | Пластическая Sn коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании |
|
| ПОЛУЧЕНИЕ ПЛАСТИЧЕСКОЙ СЕРЫ |
Взаимопревращение аллотропных модификаций серы
Строение атома серы
Размещение
электронов по уровням и подуровням
Основное состояние 1s22s22p63s23p4 | ||
Размещение электронов по | Степень | Валентность |
+2, -2 | В основном состоянии II | |
+4 | Первое возбуждённое состояние IV | |
+6 | Второе возбуждённое состояние VI | |
Получение серы
1.
Промышленный метод – выплавление из руды с помощью водяного пара.
2.
Неполное окисление сероводорода (при недостатке кислорода).
2H2S + O2= 2S + 2H2O
3. Реакция Вакенродера
2H2S + SO2 = 3S + 2H2O
Химические свойства
серы
Сера – S0 + 2ē -> S-2 | Сера – восстановитель S – 2ē -> S+2; S – 4ē -> S+4; S – 6ē -> S+6 |
1) Сера реагирует со щелочными металлами 2Na + S -> Na2S ОПЫТ c остальными металлами (кроме Au, Pt) – при повышенной t°: 2Al + 3S –t°-> Al2S3 Zn + S –t°-> ZnS ОПЫТ Cu + S –t°-> CuS ОПЫТ 2) H2 + S -> H2S 2P + 3S -> P2S3 C + 2S -> CS2 | 1) S + O2 2S + 3O2 –t°;pt-> 2S+6O3 2) S + Cl2-> S+2Cl2 3) c кислотами – окислителями: S + 2H2SO4(конц) -> 3S+4O2 + 2H2O S + 6HNO3(конц) -> H2S+6O4 + 6NO2 Реакции 4) 3S0 + 6KOH -> K2S+4O3 + 2K2S-2 + 3H2O |
Тренажёр
№1 – Характеристика серы по её положению в периодической системе Д. И.
Менделеева
Тренажёр №2 – Химические
свойства серы
Тренажёр
№3 – Взаимодействие серы с металлами
Применение
Вулканизация
каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями
сельского хозяйства, для медицинских целей (серные мази для лечения кожных
заболеваний), для получения серной кислоты и т.д.
Применение серы и её соединений
ЗАДАНИЯ
№1. Закончите уравнения реакций:
S + O2
S + Na
S + H2
Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
№2. Осуществите превращения по схеме:
H2S → S → Al2S3 → Al(OH)3
№3. Закончите уравнения реакций, укажите, какие свойства проявляет сера (окислителя или восстановителя):
Al + S = (при нагревании)
S + H2 = (150-200)
S + O2 = (при нагревании)
S + F2 = (при обычных условиях)
S + H2SO4(к) =
S + KOH =
S + HNO3 =
Это интересно…
Содержание
серы в организме человека массой 70 кг – 140 г.
В
сутки человеку необходимо 1 г серы.
Серой
богаты горох, фасоль, овсяные хлопья, пшеница, мясо, рыба, плоды и сок манго.
Сера
входит в состав гормонов, витаминов, белков, она есть в хрящевой ткани, в
волосах, ногтях. При недостатке серы в организме наблюдается хрупкость ногтей и
костей, выпадение волос.
Следите
за своим здоровьем!
Знаете ли вы…
·
Соединения
серы могут служить лекарственными препаратами
·
Сера
– основа мази для лечения грибковых заболеваний кожи, для борьбы с чесоткой.
Тиосульфат натрия Na2S2O3 используется
для борьбы с нею
·
Многие
соли серной кислоты содержат кристаллизационную воду: ZnSO4×7H2O и CuSO4×5H2O.
Их применяют как антисептические средства для опрыскивания растений и
протравливания зерна в борьбе с вредителями сельского хозяйства
·
Железный
купорос FeSO4×7H2O используют при анемии
·
BaSO4 применяют
при рентгенографическом исследовании желудка и кишечника
·
Алюмокалиевые
квасцы KAI(SO4) 2×12H2O –
кровоостанавливающее средство при порезах
·
Минерал Na2SO4×10H2O носит
название «глауберова соль» в честь открывшего его в VIII веке
немецкого химика Глаубера И.Р. Глаубер во время своего
путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался
принимать пищу. Один из местных жителей направил его к источнику. Как только он
выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту
воду, из нее выкристаллизовалась соль Na2SO4×10H2O.
Сейчас ее применяют как слабительное в медицине, при окраске хлопчато-
бумажных тканей. Соль также находит применение в производстве стекла
·
Тысячелистник
обладает повышенной способностью извлекать из почвы серу и стимулировать
поглощение этого элемента с соседними растениями
·
Чеснок
выделяет вещество – альбуцид, едкое соединение серы. Это вещество предотвращает
раковые заболевания, замедляет старение, предупреждает сердечные заболевания.
Источник
| ОПИСАНИЕ |
|---|
| Человек. У рабочих, занятых в производстве элементарной серы, в серных карьерах, на обогатительных фабриках, т. е. подвергающихся длительному воздействию серной пыли, аэрозоля элементарной серы и серусодержащих газов, наблюдаются профессиональные интоксикации. Жалобы на выделения из носа, жжение в глазах, слезотечение, светобоязнь, раздражительность, периодические головные боли, чаще в затылочной и лобно-теменных областях, головокружение, потливость, плохой сон и аппетит, диспептические расстройства, неприятные и болевые ощущения в области сердца. Много жалоб на тупые боли в правой подреберной области- периодического характера, усиливающиеся при физической нагрузке. |
| Объективно – гиперемия конъюнктивы, иногда с изъязвлениями, инъекция роговой оболочки, болезненность при пальпации в эпигастрии и правом подреберье, локальные симптомы со стороны желчного пузыря, увеличение печени, лейкоцитоз, моноцитоз, снижение уровня SH-групп, глутатиона и гемоглобина в периферической крови, угнетение пероксидазы крови, оживление сухожильных и периостальных рефлексов, нередко с расширенной рефлексогенной зоной, тремор пальцев вытянутых рук; красный стойкий местный дермографизм, иногда с наклонностью к разлитому, общий или локальный гипергидроз. При проведении ортостатической пробы учащение пульса, при проведении клиностатической пробы замедление пульса; чаще выявлялось изменение ортостатического рефлекса. Снижение кожной температуры на коже пальцев кистей. Нарастание частоты вегето-сосудистой дистонии и астено-вегетативного синдрома с увеличением стажа работы. |
| При обследовании в клинических условиях выявлен синдромокомплекс, включавший сочетанную патологию гепатогастральной, легочной, сердечно-сосудистой и нервной систем. Реэнцефалографически – отклонения в состоянии церебральной гемодинамики, в основном в виде изменений тонуса артериальных сосудов и асимметрии пульсового кровенаполнения полушарий мозга (изменение удавалось отметить еще в доклинический период). Нарушения нейроэндокринной регуляции регионарного кровообращения. Состояние подкожной васкуляризации по данным кожной термометрии изменено: асимметрия кожной температуры в симметричных точках, понижение в дистальных отделах рук. При капилляроскопии перикапиллярный отек, иногда в сочетании с капилляроскопической картиной спастико-атонического синдрома. |
| Кислотообразующая функция желудка изменена в сторону ровышения секреции соляной кислоты. При рентгенологическом и гастроскопическом исследовании желудка – изменение рельефа слизистых, в некоторых случаях язвенная болезнь с локализацией язвы в луковице двенадцатиперстной кишки. При дуоденальном зондировании в содержимом желчного пузыря увеличенное количество слизи, лейкоцитов, кристаллов холестерина и билирубината кальция. |
| У многих найдены изменения функционального состояния печени. Гипоальбуминемия, снижение альбумино-глобулинового индекса в сыворотке крови. Устойчивость белковых коллоидов по показателям пробы Вельтмана нарушена, активность трансаминаз повышена. На фоне явлений хронического гепатита либо гепатохолецистита нарушения внутрипеченочной гемодинамики, выявленные реогепатографически – изменения тонуса и эластичности средних и мелких артерий. Изменение гемодинамики в печени наступает раньше появления обменных расстройств. |
| При длительном вдыхании серной пыли возможны пневмокониозы. У значительного числа работающих находили преобладание дегенеративно-трофической формы амфодонтоза с ретракцией и атрофией десны, обнажением шеек и корней зубов и отложение зубного камня, катаральные и язвенные стоматиты. Все эти явления развивались на фоне выраженной анемии слизистой оболочки рта (Брилинский; Брилинский, Щепаняк; Кузьмина, Ивонина; Ивонина, Филатова; Чучмай и др.; Щепаняк и др.). |
| Местное действие. Человек. У рабочих серных рудников выявлены везикулезные высыпания на кистях рук и шелушение кожи, полностью исчезающее во время отпускного периода. Изредка порошкообразная С. может вызывать экземы. |
Показано 1 — 7 из 7 записей.
Источник
 Сера принадлежит к числу элементов, которые в свободном состоянии образуют несколько аллотропических видоизменений.
Сера принадлежит к числу элементов, которые в свободном состоянии образуют несколько аллотропических видоизменений.
Чистая природная сера — твердое, кристаллическое вещество желтого цвета с уд. весом 2,07, плавящееся при 112,8°. Она нерастворима в воде, но довольно хорошо растворяется в сероуглероде, бензоле и некоторых других жидкостях. При испарении этих жидкостей сера выделяется из раствора в виде прозрачных желтых кристаллов ромбической, системы, имеющих, форму октаэдров, у которых обычно часть углов или ребер как бы срезана (рис. 3). Такая сера называется ромбической. Продажная черенковая сера состоит из таких же кристаллов, но только очень мелких и плохо образованных.
Что такое сера
Химически очень активное вещество, природная сера состоит из стабильных изотопов 32S (95,02%), 33S (0,75%), 34S (4,21%) и 36S (0,02%). Известны искусственные радиоактивные изотопы 29S, 30S, 31S, 36S, 37S и 38S. Серу с давних времен применяли как краску, отбеливания тканей, для дезинфекции, для получения греческого огня (дымный порох) и т.д.
Ромбическая сера имеет желтый цвет, практически нерастворима в воде, но растворяется в органических соединения, толуол, четыреххлористый углерод и т.д.
 Рис. 2. Получение пластической серы
Рис. 2. Получение пластической серы
Совершенно иной формы кристаллы получаются, если медленно охлаждать расплавленную серу в каком-нибудь сосуде и, когда она частично затвердеет, слить еще не успевшую застыть часть серы. При этих условиях стенки сосуда оказываются покрытыми изнутри множеством длинных темно-жёлтый игольчатых кристаллов моноклинической системы (рис, 4). Эта моноклиническая сера имеет уд. вес 1,96 и плавится при 119°.
Однако она может оставаться без изменения только при температуре выше 96°. При обыкновенной температуре кристаллы моноклинической серы скоро светлеют и приобретают все свойства ромбической серы. Хотя внешне эти кристаллы сохраняют еще призматическую форму, но они уже состоят из мельчайших кристалликов-октаэдров, на которые и распадаются при сотрясении.
Температура их плавления и удельный вес становятся такими же, как и у ромбической серы.
Очень интересны изменения, которые претерпевает сера, если медленно нагревать ее до точки кипения. При 112,8° она плавится, превращаясь в желтую легкоподвижную жидкость. При дальнейшем нагревании жидкость темнеет, приобретая красновато-бурый цвет, и при температуре около 250° становится настолько густой, что некоторое время не выливается из опрокинутого сосуда. Выше 300° жидкая сера снова становится подвижной, но цвет ее остается таким же темным. Наконец, при 444,6° сера закипает, образуя оранжево-желтые пары. При охлаждении те же явления повторяются в обратном порядке.
 Рис. 3. Кристаллы ромбической серы
Рис. 3. Кристаллы ромбической серы
Если расплавленную серу, нагретую до кипения, вылить тонкой струей в холодную воду, то она превращается в мягкую резиноподобную коричневую массу, растягивающуюся в нити. Эта модификация серы называется пластической серой. Пластическая сера уже через несколько часов становится хрупкой, приобретает желтый цвет и постепенно превращается в ромбическую серу.
Кроме трех рассмотренных видоизменений серы, известны также и другие, на которых мы не будем останавливаться. Все они неустойчивы и довольно быстро превращаются в ромбическую серу. Поэтому в природе сера встречается только в ромбической форме.
Результаты определения молекулярного веса серы по понижению точки замерзания ее растворов в бензоле приводят к заключению, что молекулы серы при этих условиях состоят из восьми атомов (S8). Из таких же молекул построены, невидимому, и кристаллы серы. Таким образом, различие в свойствах кристаллических модификаций серы обусловливается не различным числом атомов в молекулах (как, например, в молекулах кислорода и озона), а неодинаковой структурой кристаллов (полиморфизм) .
 Рис. 4. Кристалл моноклинической серы
Рис. 4. Кристалл моноклинической серы
Пары серы при низких температурах состоят главным образом из молекул S6, а выше 800° — из молекул S2.
Сера является типичным металлоидом. Со многими металлами, например с медью, железом, цинком и др., она соединяется непосредственно с выделением значительного количества тепла.
Сера соединяется также почти со всеми металлоидами, но далеко не так легко и энергично, как с металлами.С кислородом сера дает несколько окислов, из которых два самые важные —SO2и SO3— являются ангидридами кислот сернистой H2SO3и серной H2SO4.Соединение серы с водородом — газ сероводород H2S — в водном растворе также обладает кислотными свойствами.
Применение серы
Сера широко используется в народном хозяйстве. В виде серного цвета она применяется в больших количествах для уничтожения некоторых вредителей садовых культур.
В резиновой промышленности сера применяется для превращения каучука в резину; свои ценные свойства — упругость, эластичность и др. — каучук приобретает только после смешивания с серой и нагревания до определенной температуры. Такой процесс называется вулканизацией.
Каучук с очень большим содержанием серы называют эбонитом. Он представляет собой твердое вещество, являющееся очень хорошим электрическим изолятором. Затем сера применяется для приготовления черного пороха, спичек, бенгальских огней, ультрамарина (синяя краска), сероуглерода и целого ряда других веществ. В странах, богатых серой, она является также исходным сырьем для получения серной кислоты. В медицине сера применяется для лечения некоторых кожных болезней.
119 120 121
Вы читаете, статья на тему Свойства и применение серы
Источник

Чистая желтая сера
Сера — минерал из класса самородных элементов. Сера представляет собой пример хорошо выраженного энантиоморфного полиморфизма. В природе образует 2 полиморфные модификации: a-сера ромбическая и b-сера моноклинная. При атмосферном давлении и температуре 95,6°С a-сера переходит в b-серу. Сера жизненно необходима для роста растений и животных, она входит в состав живых организмов и продуктов их разложения, ее много, например, в яйцах, капусте, хрене, чесноке, горчице, луке, волосах, шерсти и т.д. Она присутствует также в углях и нефти.
СТРУКТУРА
Кристаллическая структура и две сингонии серы
Самородная сера обычно представлена a-серой, которая кристаллизуется в ромбической сингонии, ромбо-дипирамидальный вид симметрии. Кристаллическая сера имеет две модификации; одну из них, ромбическую, получают из раствора серы в сероуглероде (CS2) испарением растворителя при комнатной температуре. При этом образуются ромбовидные просвечивающие кристаллы светложелтого цвета, легко растворимые в CS2. Эта модификация устойчива до 96° С, при более высокой температуре стабильна моноклинная форма. При естественном охлаждении расплавленной серы в цилиндрических тиглях вырастают крупные кристаллы ромбической модификации с искаженной формой (октаэдры, у которых частично «срезаны» углы или грани). Такой материал в промышленности называется комовая сера. Моноклинная модификация серы представляет собой длинные прозрачные темножелтые игольчатые кристаллы, также растворимые в CS2. При охлаждении моноклинной серы ниже 96° С образуется более стабильная желтая ромбическая сера.
СВОЙСТВА

Самородная сера
Самородная сера жёлтого цвета, при наличии примесей — жёлто-коричневая, оранжевая, бурая до чёрной; содержит включения битумов, карбонатов, сульфатов, глины. Кристаллы чистой серы прозрачны или полупрозрачны, сплошные массы просвечивают в краях. Блеск смолистый до жирного. Твердость 1-2, спайности нет, излом раковистый. Плотность 2,05 -2,08 г/см3, хрупкая. Легко растворима в канадском бальзаме, в скипидаре и керосине. В HCl и H2SO4 нерастворима. HNO3 и царская водка окисляют серу, превращая её в H2SO4. Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов.
Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами.
Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться.
Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд.
МОРФОЛОГИЯ

Самородная сера
Образует усечённо-дипирамидальные, реже дипирамидальные, пинакоидальные или толстопризматические кристаллы, а также плотные скрытокристаллические, сливные, зернистые, реже тонковолокнистые агрегаты. Главные формы на кристаллах: дипирамиды (111) и (113), призмы (011) и (101), пинакоид (001). Также сростки и друзы кристаллов, скелетные кристаллы, псевдосталактиты, порошковатые и землистые массы, налёты и примазки. Для кристаллов характерны множественные параллельные срастания.
ПРОИСХОЖДЕНИЕ

Самородная сера
Сера образуется при вулканических извержениях, при выветривании сульфидов, при разложении гипсоносных осадочных толщ, а также в связи с деятельностью бактерий. Главные типы месторождений самородной серы — вулканогенные и экзогенные (хемогенно-осадочные). Экзогенные месторождения преобладают; они связаны с гипсо-ангидритами, которые под воздействием выделений углеводородов и сероводорода восстанавливаются и замещаются серно-кальцитовыми рудами. Такой инфильтрационно-метасоматический генезис имеют все крупнейшие месторождения. Самородная сера часто образуется (кроме крупных cкоплений) в результате окисления H2S. Геохимические процессы её образования существенно активизируются микроорганизмами (сульфатредуцирующими и тионовыми бактериями). Сопутствующие минералы — кальцит, арагонит, гипс, ангидрит, целестин, иногда битумы. Среди вулканогенных месторождений самородной серы главное значение имеют гидротермально-метасоматические (например, в Японии), образованные сероносными кварцитами и опалитами, и вулканогенно-осадочные сероносные илы кратерных озёр. Образуется также при фумарольной деятельности. Образуясь в условиях земной поверхности, самородная сера является всё же не очень устойчивой и, постепенно окисляясь, даёт начало сульфатам, гл. образом гипсу.
Используется в производстве серной кислоты (около 50% добываемого количества). В 1890 г. Герман Фраш предложил плавить серу под землёй и извлекать на поверхность через скважины, и в настоящее время месторождения серы разрабатывают главным образом путём выплавки самородной серы из пластов под землёй непосредственно в местах её залегания. Сера также в больших количествах содержится в природном газе (в виде сероводорода и сернистого ангидрида), при добыче газа она откладывается на стенках труб, выводя их из строя, поэтому её улавливают из газа как можно быстрее после добычи.
ПРИМЕНЕНИЕ

Сера входит в состав спичечной головки
Примерно половина производимой серы используется в производстве серной кислоты. Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.
Сера (англ. Sulphur) — S
| Молекулярный вес | 32.06 г/моль |
| Происхождение названия | Латинское sulfur (происходящее из эллинизированного написания этимологического sulpur), предположительно, восходит к индоевропейскому корню *swelp — «гореть» |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
| Strunz (8-ое издание) | 1/B.03-10 |
| Nickel-Strunz (10-ое издание) | 1.CC.05 |
| Dana (7-ое издание) | 1.3.4.1 |
| Dana (8-ое издание) | 1.3.5.1 |
| Hey’s CIM Ref. | 1.51 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | жёлтый, серно-жёлтый, коричневато- или зеленовато-жёлтый, оранжевый, белый |
| Цвет черты | бесцветный |
| Прозрачность | прозрачный, полупрозрачный |
| Блеск | смоляной, жирный |
| Спайность | несовершенная по {001}, {110} и {111} |
| Твердость (шкала Мооса) | 1.5 — 2.5 |
| Излом | неровный, раковистый |
| Прочность | очень хрупкая |
| Отдельность | отдельность по {111} |
| Плотность (измеренная) | 2.07 г/см3 |
| Радиоактивность (GRapi) |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | двухосный (+) |
| Показатели преломления | nα = 1.958 nβ = 2.038 nγ = 2.245 |
| Максимальное двулучепреломление | δ = 0.287 |
| Оптический рельеф | очень высокий |
| Плеохроизм | видимый |
| Рассеивание | относительно слабое r<v |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | mmm (2/m 2/m 2/m) — ромбо-дипирамидальный |
| Пространственная группа | Fddd |
| Сингония | Ромбическая (орторомбическая) |
| Параметры ячейки | a = 10.468Å, b = 12.870Å, c = 24.49Å |
| Двойникование | Двойники по {101}, {011}, {110} довольно редки |
mineralpro.ru
28.07.2016
Источник



