Какие свойства имеет оксид кремния
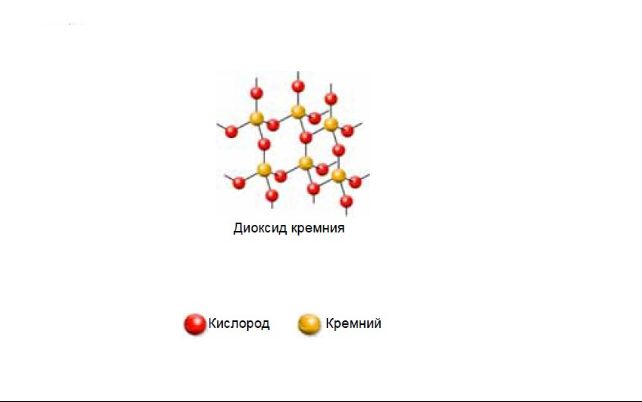
| Диоксид кремния | |
|---|---|
 | |
| | |
| Систематическое наименование | оксид кремния (IV) |
| Традиционные названия | кремнезём |
| Хим. формула | SiO2 |
| Рац. формула | SiO2 |
| Температура | |
| • плавления | 1600 °C |
| • кипения | 2950 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| ГОСТ | ГОСТ 9428-73 |
| Рег. номер CAS | 7631-86-9 |
| PubChem | 24261 |
| Рег. номер EINECS | 231-545-4 |
| SMILES | O=[Si]=O |
| InChI | 1S/O2Si/c1-3-2 VYPSYNLAJGMNEJ-UHFFFAOYSA-N |
| Кодекс Алиментариус | E551 |
| RTECS | VV7565000 |
| ChEBI | 30563 |
| ChemSpider | 22683 |
| Токсичность | Пыль SiO2 чрезвычайно токсична и канцерогенна при вдыхании, поражает лёгкие, приводит к силикозу |
| Пиктограммы ECB | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Диоксид кремния (кремнезём, SiO2; лат. silica) — оксид кремния (IV). Бесцветные кристаллы с температурой плавления +1713…+1728 °C, обладающие высокой твёрдостью и прочностью.
Диоксид кремния — главный компонент почти всех земных горных пород, в частности, кизельгура. Из кремнезёма и силикатов состоит 87 % массы литосферы. В крови и плазме человека концентрация кремнезёма составляет 0,001 % по массе.

Свойства
- Относится к группе кислотных оксидов.
- При нагревании взаимодействует с основными оксидами и щелочами.
- Молярная масса: 60,084 г/моль
- Реагирует с плавиковой кислотой.
- SiO2 относится к группе стеклообразующих оксидов, то есть склонен к образованию переохлаждённого расплава — стекла.
- Диэлектрик (электрический ток не проводит, если не имеет примесей и не нагревается).
Полиморфизм
Диоксид кремния имеет несколько полиморфных модификаций.
Самая распространённая из них на поверхности земли — α-кварц — кристаллизуется в тригональной сингонии. При нормальных условиях диоксид кремния чаще всего находится в полиморфной модификации α-кварца, которая при температуре выше +573 °C обратимо переходит в β-кварц. При дальнейшем повышении температуры кварц переходит в тридимит и кристобалит. Эти полиморфные модификации устойчивы при высоких температурах и низких давлениях.
В природе также встречаются формы — опал, халцедон, кварцин, лютецит, аутигенный кварц, которые относятся к группе кремнезёма. Опал (SiO2·nH2O) в шлифе бесцветен, изотропен, имеет отрицательный рельеф, отлагается в морских водоёмах, входит в состав многих кремнистых пород. Халцедон, кварцин, лютецит — SiO2 — представляют собой скрытокристаллические разновидности кварца. Образуют волокнистые агрегаты, розетки, сферолиты, бесцветные, голубоватые, желтоватые. Отличаются между собой некоторыми свойствами — у халцедона и кварцина — прямое погасание, у лютецита — косое, у халцедона — отрицательное удлинение.
При высоких температуре и давлении диоксид кремния сначала превращается в коэсит (который в 1953 году был синтезирован американским химиком Лорингом Коэсом), а затем — в стишовит (который в 1961 году был синтезирован С. М. Стишовым, а в 1962 году был обнаружен в кратере Бэрринджера (кратере Аризонского метеорита). Согласно некоторым исследованиям, стишовит слагает значительную часть мантии, так что вопрос о том, какая разновидность SiO2 наиболее распространена на Земле, пока не имеет однозначного ответа.
Также имеет аморфную модификацию — кварцевое стекло.
Химические свойства
Диоксид кремния SiO2 — кислотный оксид, не реагирующий с водой.
Химически стоек к действию кислот, но реагирует с газообразным фтороводородом:
SiO2 + 4HF → SiF4 + 2H2O
и плавиковой кислотой:
SiO2 + 6HF → H2[SiF6] + 2H2O
Эти две реакции широко используют для плавления стекла.
При сплавлении SiO2 с щелочами и основными оксидами, а также с карбонатами активных металлов образуются силикаты — соли не имеющих постоянного состава очень слабых, нерастворимых в воде кремниевых кислот общей формулы xH2O·ySiO2 (довольно часто в литературе упоминаются не кремниевые кислоты, а кремниевая кислота, хотя фактически речь при этом идёт об одном и том же веществе).
Например, может быть получен ортосиликат натрия:
SiO2 + 4NaOH → Na4SiO4 + 2H2O
метасиликат кальция:
SiO2 + CaO → CaSiO3
или смешанный силикат кальция и натрия:
Na2CO3 + CaCO3 + 6SiO2 → Na2CaSi6O14 + 2CO2
Из силиката Na2CaSi6O14 (Na2O·CaO·6SiO2) изготовляют оконное стекло.
Большинство силикатов не имеет постоянного состава. Из всех силикатов растворимы в воде только силикаты натрия и калия. Растворы этих силикатов в воде называют жидким стеклом. Из-за гидролиза эти растворы характеризуются сильно щелочной средой. Для гидролизованных силикатов характерно образование не истинных, а коллоидных растворов. При подкислении растворов силикатов натрия или калия выпадает студенистый белый осадок гидратированных кремниевых кислот.
Главным структурным элементом как твёрдого диоксида кремния, так и всех силикатов, выступает группа [SiO4/2], в которой атом кремния Si окружен тетраэдром из четырёх атомов кислорода О. При этом каждый атом кислорода соединён с двумя атомами кремния. Фрагменты [SiO4/2] могут быть связаны между собой по-разному. Среди силикатов по характеру связи в них фрагментов [SiO4/2] выделяют островные, цепочечные, ленточные, слоистые, каркасные и другие.
Получение
Синтетический диоксид кремния получают нагреванием кремния до температуры +400…+500 °C в атмосфере кислорода, при этом кремний окисляется до диоксида SiO2. А также термическим оксидированием при больших температурах.
В лабораторных условиях синтетический диоксид кремния может быть получен действием кислот, даже слабой уксусной, на растворимые силикаты. Например:
Na2SiO3 + 2CH3COOH → 2CH3COONa + H2SiO3↓
кремниевая кислота сразу распадается на воду и SiO2, выпадающий в осадок.
Натуральный диоксид кремния в виде песка используется там, где не требуется высокая чистота материала.
Применение
Аморфный непористый диоксид кремния применяется в пищевой промышленности в качестве вспомогательного вещества E551, препятствующего слёживанию и комкованию, в парафармацевтике (зубные пасты), в фармацевтической промышленности в качестве вспомогательного вещества (внесён в большинство фармакопей), для стабилизации суспензий и линиментов, в качестве загустителя мазевых основ, наполнителя таблеток и суппозиториев. Он входит в состав композиции пломбировочных материалов, снижает гигроскопичность сухих экстрактов, замедляет выход БАВ из различных лекарственных форм; в качестве пищевых добавок и сорбента, а также матриц для создания лекарственных форм с заданными свойствами – так как нет кристаллической структуры (аморфен) – безопасен, а также в качестве пищевой добавки или лекарственного препарата в качестве энтеросорбента Полисорб МП с широким спектром применения с учётом высокой удельной поверхности сорбции (в интервале 300-400 м² ) на 1 г основного вещества.
Диоксид кремния применяют в производстве стекла, керамики, абразивов, бетонных изделий, для получения кремния, как наполнитель в производстве резин, при производстве кремнезёмистых огнеупоров, в хроматографии и другом.
Кристаллы кварца обладают пьезоэлектрическими свойствами и поэтому используются в радиотехнике, ультразвуковых установках, в зажигалках.
Искусственно полученные плёнки диоксида кремния используются в качестве изолятора при производстве микросхем и других электронных компонентов.
Также используется для производства волоконно-оптических кабелей. Используется чистый плавленый диоксид кремния с добавкой в него некоторых специальных ингредиентов.
Кремнезёмная нить также используется в нагревательных элементах электронных сигарет, так как хорошо впитывает жидкость и не разрушается под нагревом спирали.
Также диоксид кремния нашёл наиболее широкое применение в шинной промышленности, производстве РТИ и пластмасс, химической промышленности, машиностроении, а в ряде конкретных операций:
- как носитель катализаторов и химических средств защиты растений;
- в качестве сорбентов и фильтровальных порошков для регенерации нефтепродуктов;
- как высококачественный флюс в процессах цветной металлургии;
- как сырьё для производства экологически чистого стекла, стеклотары и хрусталя;
- как наполнитель в бумагу и картон для получения гигиенически чистых упаковочных материалов для пищевой промышленности;
- фильтрующие порошки для пива, масел, соков, матирующие добавки в лаки и краски;
- для получения карбида кремния в машиностроении – керамические двигатели, детали для авиастроительного комплекса;
- для получения кристаллического кремния в электронной и электротехнической промышленностях, керамические электроизоляторы, стекловолокна, волоконная оптика, супертонкое волокно;
- для синтеза искусственных цеолитов в нефтехимии — крекинг нефти и прочее.
Крупные прозрачные кристаллы кварца используются в качестве полудрагоценных камней; бесцветные кристаллы называют горным хрусталём, фиолетовые — аметистами, жёлтые — цитрином.
В микроэлектронике диоксид кремния является одним из основных материалов. Его применяют в качестве изолирующего слоя, а также в качестве защитного покрытия. Получают в виде тонких плёнок термическим окислением кремния, химическим осаждением из газовой фазы, магнетронным распылением.
Пористые кремнезёмы
Пористые кремнезёмы получают различными методами.
Силохром получают путём агрегирования аэросила, который, в свою очередь, получают сжиганием силана (SiH4). Силохром характеризуется высокой чистотой, низкой механической прочностью. Характерный размер удельной поверхности 60—120 м²/г. Применяется в качестве сорбента в хроматографии, наполнителя резин, катализе.
Силикагель получают путём высушивания геля кремниевой кислоты. В сравнении с силохромом обладает меньшей чистотой, однако может обладать чрезвычайно развитой поверхностью: обычно от 300 м²/г до 700 м²/г .
Кремниевый аэрогель приблизительно на 99,8 % состоит из воздуха и может иметь плотность до 1,9 кг/м³ (всего в 1,5 раза больше плотности воздуха).
Токсичность
Хотя и сам диоксид кремния считается нетоксичным, однако его пыль является токсичной и канцерогенной при вдыхании (как и пыль асбеста) . Вдыхание пыли приводит к бронхиту, воспалению лёгких (силикоз) и онкологическим заболеваниям.
Источник
Кремний проявляет переменную валентность (II, IV), поэтому может образовывать два оксида кремния – монооксид и диоксид. Они отличаются физическими и химическими свойствами. Подробнее об оксидах кремния говорим в этой статье.

Монооксид
Формула оксид кремния (II) – SiO. Это вязкое, похожее на смолу вещество. Сохраняет аморфное состояние и не окисляется при обычных условиях. Не образует соли, не проводит электричество.

Рис. 1. Монооксид кремния.
Монооксид получают двумя способами:
- нагреванием (температура выше 400°C) кремния при недостатке кислорода:
2Si + O2 → 2SiO;
- методом Чохральского при восстановлении диоксида при высоких температурах:
SiO2 + Si → 2SiO.
В твёрдом состоянии монооксид представляет собой тёмно-коричневый порошок. Проявляет прочность и инертность в реакциях с кислотами. Растворим в плавиковой кислоте.
Химические свойства монооксида кремния:
- разлагается при нагревании:
2SiO → 2Si + O2;
- реагирует с парами воды при нагревании до 500°C:
SiO + H2O → SiO2 + H2;
- взаимодействует с углекислым газом при нагревании:
SiO + СО2 → SiO2 + CO;
- реагирует с хлором при температуре 800°C, образуя жидкий хлорид кремния:
2SiO + 4Cl2 → 2SiCl4 + O2.
Монооксид не встречается на Земле в естественной среде. Однако газообразный монооксид входит в состав межзвёздных пылевых облаков.
Диоксид
Оксид кремния (IV) – SiO2. Это твёрдое кристаллическое тугоплавкое вещество, нерастворимое в воде. Не проводит электрический ток.
Формулу диоксида имеют песок, кварц, горный хрусталь, яшма, агат, аметист и другие горные породы. Диоксид входит в состав 87 % литосферы.

Рис. 2. Яшма.
Диоксид кремния имеет немолекулярное строение. Кристаллическая решётка состоит из атомов кремния и кислорода, связанных ковалентными связями. К каждому атому кремния присоединено четыре атома кислорода, а каждый атом кислорода связан с двумя атомами кремния.

Рис. 3. Схема строения кристаллической решётки диоксида кремния.
Диоксид можно получить в лаборатории, нагрев кремний до 400-500°C в присутствии кислорода:
Si + O2 → SiO2.
Диоксид образуется при действии кислот на растворимые силикаты. В результате образующаяся кремниевая кислота распадается на воду и диоксид:
- Na2SiO3 + 2CH3COOH → 2CH3COONa + H2SiO3↓;
- H2SiO3 → H2O + SiO2.
При нормальных условиях реагирует только с плавиковой кислотой. Со щелочами и основными оксидами реагирует при нагревании. Не реагирует с водой. Основные свойства с химическими уравнениями представлены в таблице.
Взаимодействие | Описание | Уравнение |
С неметаллами | Реагирует с водородом и углеродом с образованием кремния и карборунда соответственно | – SiO2 + 2Н2 → Si + 2H2O; – SiO2 + 3С → SiC + 2CO |
С активными металлами | Реагирует при температуре выше 1000°С с образованием кремния. При избытке металла образуются силициды | – SiO2 + 2Mg → Si + 2MgO; – SiO2 + 4Mg → Mg2Si + 2MgO |
С фтороводородом | Реагирует с газом и плавиковой кислотой при нормальных условиях | – SiO2 + 4HF → SiF4 + 2H2O; – SiO2 + 6HF → H2[SiF6] + 2H2O |
Со щелочами | Сплавляется с образованием силикатов | SiO2 + 4NaOH → Na4SiO4 + 2H2O |
С оксидами | Реагирует при высоких температурах | SiO2 + MgO → MgSiO3 |
С карбонатами щелочных металлов | Взаимодействует при нагревании | SiO2 + K2CO3 → K2SiO3 + CO2 |
Диоксид кремния используется для производства стекла, силикагеля, бетона.
Что мы узнали?
Кремний образует два оксида – монооксид и диоксид. Монооксид – аморфное вещество, не образующее соли. Взаимодействует при нагревании с водяным паром, углекислым газом, хлором. Разлагается на простые вещества при нагревании. Диоксид – песок и его производные. Это кристаллическое вещество с немолекулярным строением. Не реагирует с водой, кислотами (исключение – плавиковая кислота). Взаимодействует с неметаллами, металлами, фтороводородом, щелочами, оксидами, карбонатами. Оксиды кремния – диэлектрики.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
Средняя оценка: 4.5. Всего получено оценок: 284.
Источник
Редакция: 26.11.2019
Кремнезем, по латыни Silicondioxide, silica – это двуокись кремния. Что же представляет собой такое соединение? Это твердые кристаллы без цвета, не имеющие запаха, они достаточно твердые, прочные, пластичные и тугоплавкие. В природе это самый обычный кварц, мельчайшие прозрачные песчинки, которые образуются при окислении кремния (Si).
SiO₂ – молекулярная (химическая) формула диоксида кремния.
Свойства диоксида кремния
Это соединение – высший, четырехвалентный кислотный оксид кремния. Он обладает идеальной устойчивостью к действию кислорода, различных кислот (при температуре плавления, равной 1 600 ºС, растворяется плавиковой кислотой, щелочами). Диоксид кремния не растворяется водой, является диэлектриком (не проводит ток).
Siliconiumdioxide- идеальный нейтрализатор щелочи.
Производство кремнезема для пищевой промышленности
В пищевой промышленности SiO₂ используют как добавку в пищу, которая имеет собственный индекс в европейской системе кодов – Е551.
Диоксид кремния в чистом виде не применяется в пищевой промышленности. В ней используют порошковый SiliconDioxide, другими словами, «белую сажу», аморфный кремнезем. Производство Е551 осуществляется на специализированных заводах двумя методами искусственного синтезирования: нагреванием Si в кислородной среде при температуре, равной пятистам градусам по Цельсию, происходит окислительная реакция, в результате которой получается белая сажа, и в специальных стерилизаторах при tº 1 000 ºС происходит реакция паров SiliconаTetrachloridа в пламени водорода (второй метод).
Синтезированный Silicondioxide относится к группе эмульгаторов, которые обеспечивают однородность смесям несмешивающихся веществ в природе, таких, как масло (растительного и животного происхождения) и жир с водой.
Применение эмульгатора Е551 в пищевом производстве разрешено во всех странах без исключения (в том числе в РФ, Беларуси, Украине, европейских странах) при условии, что его содержание в готовом продукте не превышает лимита, т.е. 30 гр/кг. Он не наносит вред здоровью, безопасен в употреблении.
Особые требования предъявляются к упаковке и условиям хранения пищевой добавки.
Для упаковки применяют мешки, изготовленные из прочного полиэтилена или специальной оберточной бумаги (kraft), а также полипропилена (обязательное присутствие вставки из полиэтилена).
Хранить пищевую добавку Е551 следует в сухом, закрытом помещении при установленном режиме влажности и определенной вентиляции.
Использование диоксида кремния
Пока уникальные свойства вещества не были изучены, оно главным образом применялось для изготовления строительных материалов, таких как бетон и цемент.
Но по мере исследования Siliconаdioxide учеными, медиками, физиологами, химиками стали известны и другие его признаки. Вещество стали применять в радиотехнике, в производстве огнеупорных материалов и резины.
Благодаря своим свойствам вещество нашло широкое применение в различных отраслях промышленности, в том числе пищевой, фармацевтической, косметологической.
| Кремний диоксид кристаллический | Аморфный (порошкообразный) кремний диоксид | Кремний диоксид коллоидный |
|---|---|---|
| Вещество широко распространено в природе. Оно содержится в горных породах – минералах, в агате, яшме, халцедоне, аметисте, горном хрустале. Широко применяется в строительстве, а также в производстве стекла, керамических и бетонных изделий. В этих индустриях не важна его чистота. | Это вещество встречается в природе в чистом виде достаточно редко. Это трепел (кизельгур), который образовывается на морском дне на протяжении длительного времени. В наши дни получают синтетическим способом в заводских условиях. Его используют главным образом в промышленных целях. | Вещество нашло широкое применение в медицине, как абсорбент (Siliciumdioxidecolloidal выводит токсичные вещества из организма) и загуститель (в изготовлении мазей, гелей, вазелина, суспензий). В косметологии (в составе зубных паст, как отбеливающее средство; в скрабах, пудрах, лосьонах). Его получение происходит в промышленных условиях из высокодисперсной двуокиси кремния. |
В пищевой промышленности эмульгатор используют как антикоагулятор (стабилизатор) и нейтрализатор, а также как загуститель. Он помогает продуктам сохранять сыпучесть, предотвращает образование комков и слеживание:
- диоксид кремния добавляют в готовые сыпучие продукты, такие как сахар, соль, мука, специи, а также сухое молоко и сливки, крахмал, яичный порошок, различные приправы и пряности, и другие;
- в молочной продукции при изготовлении сыров (для сохранения их структуры) также применяют кремнезем;
- незаменимым компонентом он является и в производстве кофе, какао;
- Е551 входит и в состав пива как абсорбент, способствует осветлению напитка, повышает его выдержку;
- широко применяется он и при производстве чипсов, сухариков, всевозможных закусок, усиливает аромат продуктов потребления;
- при изготовлении алкогольных напитков, для стабилизации кислотности и нейтрализации излишка щелочей тоже используют кремнезем;
- производство кондитерских и кулинарных изделий не обходится без применения эмульгатора Е551, им обрабатывают сладкие поверхности, за исключением тех, которые покрыты шоколадом. Он влияет на сроки реализации продукции, продлевает ее (обеспечивает свежесть, не дает слипаться изделиям), усиливает вкусовые качества и аромат.
Влияние на организм человека, польза и вред
До конца влияние на организм двуокиси кремния учеными не изучено, но из их исследований на сегодняшний день можно сделать вывод, что вещество не наносит вред здоровью при его правильном употреблении.
Диоксид кремния полностью выводится из организма, не всасывается в желудочно-кишечный тракт.
Помимо этого, Silicondioxide присутствует в организме, в крови и плазме.
Немецким физиологом на основе его практики было доказано, что кремнезем полезен для человека, он предупреждает и предотвращает атеросклероз, укрепляет и очищает сосуды. Вода кремния имеет не только абсорбирующие свойства, выводит шлаки и токсичные вещества из человеческого организма, но еще и антибактериальные.
Существует теория, что вещество оказывает положительное влияние на организм человека и сокращает риск дальнейшего развития такого заболевания, как болезнь Альцгеймера. Однако это лишь гипотеза, которую следует доказать ученым.
Ясно одно, что существенный вред здоровью может нанести пыль диоксида кремния при ее вдыхании (только на промышленных производствах). Она может послужить развитию таких заболеваний, как силикоз легких. Умеренное использование пищевой добавки Е551 безопасно для здоровья.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Источник
