Какие свойства характерны только для ферментов
К ферментам применимы три основных критерия, характерных для неорганических катализаторов:
1) они остаются относительно неизменными после реакции, то есть освобождаются вновь и могут реагировать с новыми молекулами субстрата;
2) ферменты оказывают свое действие в ничтожно малых концентрациях;
Например: 1 молекулареннина (содержится в слизистой оболочке желудка теленка) створаживает около 106 молекул казеиногена молока за 10 минутпри 37 0C;
3) наличие фермента (катализатора) не оказывает влияния как на величину константы равновесия, так и на изменения свободной энергии. Катализаторы лишь повышают скорость реакций (точку равновесия не сдвигают).
1. Термолабильность ферментов.Скорость химической реакции зависит от температуры. Реакции, катализируемые ферментами, так же чувствительны к изменениям температуры. Скорость химической реакции повышается в два раза при повышении температуры на 10 0C. Ускорение реакции идет до 45 0C, затем, в связи с денатурацией белка-фермента, снижается. При 100 0C почти все ферменты полностью утрачивают свою активность.
Оптимальной температурой для ферментов теплокровных является 37-40 0C. При низких температурах (0° и ниже) ферменты не разрушаются, не денатурируют, но активность их снижается до нуля рис. 4.3.).
Рис.4.3. Влияние температуры на скорость катализируемой ферментом реакции.
а – повышение скорости реакции как функция температуры;
б – понижение скорости реакции как функция денатурации белка-фермента; стрелка (→) указывает оптимум температуры.
2. Зависимость активности ферментов от рН среды.
Ферменты обычно активны в узких пределах значений рН, как правило, рН 6,0-8,0. Каждый фермент имеет свой оптимум рН. рН-оптимум действия ферментов лежит в пределах физиологических значений. Исключением является пепсин, рН-оптимум которого – 2,0. Объясняется это функцией пепсина, т.к. в желудочном соке содержится свободная соляная кислота, создающая кислое значение рН.
Влияние изменений рН среды на активность фермента заключается в том, что изменяется степень ионизации кислотных и основных групп (-COOH, -SH, имидазольной, -NH2 и т.д.).
При разных значениях рН активный центр может находиться в частично ионизированной или неионизированной форме, что сказывается на третичной структуре белка и соответственно на формировании активного фермент-субстратного комплекса (рис.4.4).
Рис.4.4. Влияние рН на скорость катализируемой ферментом реакции (стрелка указывает оптимум рН).
3. Специфичность ферментов.Ферменты обладают высокой специфичностью действия и этим существенно отличаются от неорганических катализаторов. Например: измельченная платина или палладий могут катализировать восстановление десятков соединений различной структуры. А фермент обычно проявляет свою активность только при полном соответствии активного центра и субстрата, только при «узнавании» обычно протекает одна высокоспецифичная реакция среди тысячи других химических реакций, осуществляемых в живой клетке. В зависимости от механизма действия различают ферменты с относительной или групповой и абсолютной специфичностью. Так, для действия некоторых гидролитических ферментов характерна относительная специфичность.
Например, пепсин расщепляет белки животного и растительного происхождения, хотя они могут отличаться по химическому строению, аминокислотному составу и физико-химическим свойствам. Однако пепсин не расщепляет жиры и углеводы; пепсин разрывает пептидную связь – СО–NH – между аминокислотами.
Липаза, катализирующая гидролиз жиров на глицерин и жирные кислоты, разрывает сложноэфирные связи. Аналогично групповой специфичностью обладают трипсин, химотрипсин, пептидазы, ферменты, гидролизирующие α-гликозидные связи в полисахаридах. Указанные ферменты пищеварительные, их групповая специфичность имеет биологический смысл.
Абсолютная специфичность – это способность фермента катализировать превращение только единственного субстрата. Например: аргиназа, расщепляющая в организме аргинин; уреаза, катализирующая распад мочевины и др.
Стереохимическая специфичность: оксидазы (аминокислот) действуют только на свой специфический стереоизомер – L- или D-аминокислот. Специфичностью обладают также ферменты, катализирующие синтетические реакции.
Источник
К ферментам
применимы три основных критерия, характерных и для неорганических
катализаторов. В частности, они остаются неизмененными после реакции, т.е.
освобождаясь, могут вновь реагировать с новыми молекулами субстрата (хотя
нельзя исключить побочных влияний условий среды на активность фермента).
Ферменты способны оказывать действие в ничтожно малых концентрациях (например,
одна молекула фермента реннина, содержащегося в слизистой оболочке желудка
теленка, створаживает около 106молекул казеиногена молока за 10 мин
при температуре 37°С). Наличие либо отсутствие фермента или любого другого
катализатора не оказывает влияния на величину константы равновесия и свободной
энергии (ΔG). Катализаторы лишь повышают скорость, с которой система
приближается к термодинамическому равновесию, не сдвигая точки равновесия.
Химические реакции с высокой константой равновесия и отрицательной величиной
ΔG принято называть экзергоническими. Реакции с низкой константой
равновесия и соответственно положительной величиной ΔG (они обычно не
протекают спонтанно) называются эндерго-ническими. Для начала и завершения этих
реакций необходим приток энергии
извне. В живых системах экзергонические процессы обычно сопряжены с
эндергоническими реакциями, обеспечивая последние необходимым количеством
энергии.
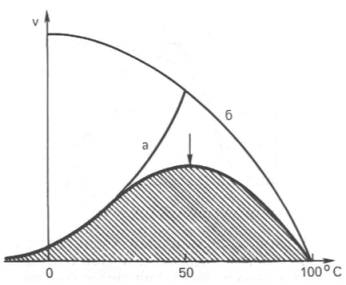
Рис. 4.16. Зависимость скорости катализируемой
ферментом реакции от температуры.
а – повышение
скорости реакции как функция температуры; б – снижение скорости реакции как
функция денатурации белка-фермента; стрелка указывает оптимум температуры.
Ферменты,
являясь белками, обладают рядом характерных для этого класса органических
соединений свойств, отличающихся от свойств неорганических катализаторов.
Термолабильность ферментов. Скорость химических реакций зависит от температуры, поэтому
катализируемые ферментами реакции также чувствительны к изменениям температуры.
Установлено, что скорость большинства биохимических реакций повышается в 2 раза
при повышении температуры на 10°С и, наоборот, снижается в 2 раза при понижении
температуры на 10°С. Этот показатель получил название температурного
коэффициента. Однако вследствие белковой природы фермента тепловая денатурация
при повышении температуры будет снижать эффективную концентрацию фермента с
соответствующим снижением скорости реакции. Так, при температуре, не
превышающей 45–50°С, скорость реакции увеличивается согласно теории химической
кинетики. При температуре выше 50°С на скорость реакции большое влияние
начинает оказывать тепловая денатурация белка-фермента, приводящая к полному
прекращению ферментативного процесса (рис. 4.16).
Таким
образом, термолабильность, или чувствительность к повышению температуры,
является одним из характерных свойств ферментов, резко отличающих их от
неорганических катализаторов. В присутствии последних скорость реакции возрастает
экспоненциально при повышении температуры (см. кривую «а» на рис. 4.16). При
температуре 100°С почти все ферменты утрачивают свою активность (исключение
составляет, очевидно, только один фермент мышечной ткани – миокиназа, которая
выдерживает нагревание до 100°С). Оптимальной для действия большинства
ферментов теплокровных животных является температура 40°С; в этих условиях
скорость реакции оказывается максимальной вследствие увеличения кинетической
энергии реагирующих молекул. При низких температурах (0°С и ниже) ферменты, как
правило, не разрушаются, хотя активность их падает почти до нуля. Во всех
случаях имеет значение время воздействия соответствующей температуры. В
настоящее время для пепсина, трипсина и ряда других ферментов доказано
существование прямой зависимости
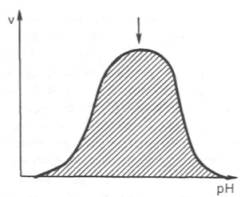
Рис. 4.17. Зависимость
скорости катализируемой ферментом реакции от рН (стрелка указывает оптимум рН).
между
скоростью инактивации фермента и степенью денатурации белка. Следует отметить,
что на термолабильность ферментов определенное влияние оказывает концентрация
субстрата, рН среды и другие факторы. Зависимость
активности ферментов от рН среды. Ферменты обычно наиболее активны в
пределах узкой зоны концентрации водородных ионов, соответствующей для животных
тканей в основном выработанным в процессе эволюции физиологическим значениям рН
среды 6,0–8,0. При графическом изображении на кривой колоколообразной формы
имеется определенная точка, в которой фермент проявляет максимальную
активность; эту точку называют оптимумом рН среды для действия данного фермента
(рис. 4.17). При определении зависимости активности фермента от концентрации
водородных ионов реакцию проводят при разных значениях рН среды, обычно при
оптимальной температуре и наличии достаточно высоких (насыщающих) концентраций субстрата.
В табл. 4.3 приводятся оптимальные значения рН среды для ряда ферментов.
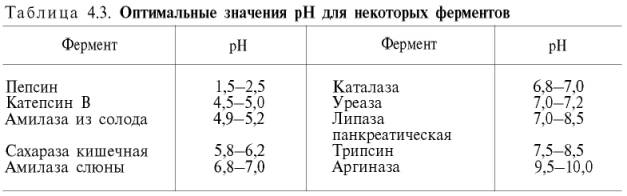
Из данных
табл. 4.3 видно, что рН-оптимум действия ферментов лежит в пределах
физиологических значений. Исключение составляют пепсин, рН-оптимум которого 2,0
(при рН 6,0 он не активен и не стабилен). Объясняется это, во-первых,
структурной организацией молекулы фермента и, во-вторых, тем, что пепсин
является компонентом желудочного сока, содержащего свободную соляную кислоту,
которая создает оптимальную кислую среду для действия этого фермента. С другой
стороны, рН-оптимум аргиназы лежит в сильнощелочной зоне (около 10,0); такой
среды нет в клетках печени, следовательно, in vivo аргиназа
функционирует, по-видимому, не в своей оптимальной зоне рН среды.
Согласно
современным представлениям, влияние изменений рН среды на молекулу фермента
заключается в воздействии на состояние и степень ионизации
кислотных и основных групп (в частности, СООН-группы дикар-боновых аминокислот,
SH-группы цистеина, имидазольного азота гисти-дина, NH2-группы
лизина и др.). При резких сдвигах от оптимума рН среды ферменты могут
подвергаться конформационным изменениям, приводящим к потере активности
вследствие денатурации или изменения заряда молекулы фермента. При разных
значениях рН среды активный центр может находиться в частично ионизированной
или неионизированной форме, что сказывается на третичной структуре белка и
соответственно на формировании активного фермент-субстратного комплекса. Имеет
значение, кроме того, состояние ионизации субстратов и кофакторов.
Специфичность ферментов. Ферменты обладают высокой специфичностью действия. Это
свойство часто существенно отличает их от неорганических катализаторов. Так,
мелкоизмельченные платина и палладий могут катализировать восстановление (с
участием молекулярного водорода) десятков тысяч химических соединений различной
структуры. Высокая специфичность ферментов обусловлена, как было отмечено,
конфор-мационной и электростатической комплементарностью между молекулами
субстрата и фермента и уникальной структурной организацией активного центра,
обеспечивающими «узнавание», высокое сродство и избирательность протекания
одной какой-либо реакции из тысячи других химических реакций, осуществляющихся
одновременно в живых клетках.
В зависимости
от механизма действия различают ферменты с относительной (или групповой) и
абсолютной специфичностью. Так, для действия некоторых гидролитических
ферментов наибольшее значение имеет тип химической связи в молекуле субстрата.
Например, пепсин в одинаковой степени расщепляет белки животного и
растительного происхождения, несмотря на то что эти белки существенно
отличаются друг от друга как по химическому строению и аминокислотному составу,
так и по физико-химическим свойствам. Однако пепсин не расщепляет ни углеводы,
ни жиры. Объясняется это тем, что точкой приложения, местом действия пепсина
является пептидная —СО—NH-связь. Для действия липазы, катализирующей гидролиз
жиров на глицерин и жирные кислоты, подобным местом является сложноэфирная
связь. Аналогичной групповой специфичностью обладают трипсин, химотрипсин,
пептидазы, ферменты, гидроли-зующие α-гликозидные связи (но не
β-гликозидные связи, имеющиеся в целлюлозе) в полисахаридах, и др. Обычно
эти ферменты участвуют в процессе пищеварения, и их групповая специфичность,
вероятнее всего, имеет определенный биологический смысл. Относительной
специфичностью наделены также некоторые внутриклеточные ферменты, например
гексокиназа, катализирующая в присутствии АТФ фосфорилиро-вание почти всех
гексоз, хотя одновременно в клетках имеются и специфические для каждой гексозы
ферменты, выполняющие такое же фос-форилирование (см. главу 10).
Абсолютной
специфичностью действия называют способность фермента катализировать
превращение только единственного субстрата. Любые изменения (модификации) в
структуре субстрата делают его недоступным для действия фермента. Примерами
таких ферментов могут служить аргиназа, расщепляющая в естественных условиях (в
организме) аргинин, уреаза, катализирующая распад мочевины, и др.
Имеются
экспериментальные доказательства существования так называемой стереохимической
специфичности, обусловленной существованием оптически изомерных L- и D-форм или
геометрических (цис-и транс-) изомеров
химических веществ. Так,
известны оксидазы L- и
D-аминокислот, хотя в природных белках обнаружены только L-ами-нокислоты.
Каждый из видов оксидаз действует только на свой специфический стереоизомер.
Наглядным
примером стереохимической специфичности является бактериальная
аспартатдекарбоксилаза, катализирующая отщепление СО2 только от
L-аспарагиновой кислоты с превращением ее в L-аланин. Сте-реоспецифичность
проявляют ферменты, катализирующие и синтетические реакции. Так, из аммиака и
α-кетоглутарата во всех живых организмах синтезируется L-изомер
глутаминовой кислоты, входящей в состав природных белков. Если какое-либо
соединение существует в форме цис-и
транс-изомеров с различным
расположением групп атомов вокруг двойной связи, то, как правило, только один
из этих геометрических изомеров может служить в качестве субстрата для действия
фермента. Например, фумараза катализирует превращение только фумаровой кислоты
(трансизомер), но не действует на
малеиновую кислоту (цис-изомер):
Таким
образом, благодаря высокой специфичности действия ферменты обеспечивают
протекание с большой скоростью лишь определенных химических реакций из
огромного разнообразия возможных превращений в микропространстве клеток и
целостном организме, регулируя тем самым интенсивность обмена веществ.
Источник
Глава IV.3.
Обмен
веществ в организме можно определить как совокупность всех химических
превращений, которым подвергаются соединения, поступающие извне. Эти
превращения включают все известные виды химических реакций: межмолекулярный
перенос функциональных групп, гидролитическое и негидролитическое расщепления
химических связей, внутримолекулярная перестройка, новообразование химических
связей и окислительно – восстановительные реакции. Такие реакции протекают в
организме с чрезвычайно большой скоростью только в присутствии катализаторов.
Все биологические катализаторы представляют собой вещества белковой природы и
носят названия ферменты (далее Ф) или энзимы (Е).
Ферменты не являются
компонентами реакций, а лишь ускоряют достижение равновесия увеличивая скорость
как прямого, так и обратного превращения. Ускорение реакции происходит за счет
снижении энергии активации – того энергетического барьера, который отделяет
одно состояние системы (исходное химическое соединение) от другого (продукт
реакции).
Ферменты ускоряют самые
различные реакции в организме. Так достаточно простая с точки зрения
традиционной химии реакция отщепления воды от угольной кислоты с образованием
СО2 требует участия фермента, т.к. без него она протекает слишком
медленно для регулирования рН крови. Благодаря каталитическому действию
ферментов в организме становится возможным протекание таких реакций, которые
без катализатора шли бы в сотни и тысячи раз медленнее.
Свойства ферментов
1. Влияние на скорость химической реакции: ферменты
увеличивают скорость химической реакции, но сами при этом не расходуются.
Скорость
реакции – это изменение концентрации компонентов реакции в единицу времени. Если она идет в прямом
направлении, то пропорциональна концентрации реагирующих веществ, если в
обратном – то пропорциональна концентрации продуктов реакции. Отношение
скоростей прямой и обратной реакций называется константой равновесия. Ферменты
не могут изменять величины константы равновесия, но состояние равновесия в
присутствии ферментов наступает быстрее.
2. Специфичность действия ферментов. В клетках
организма протекает 2-3 тыс. реакций, каждая из которые катализирутся
определенным ферментом. Специфичность
действия фермента – это способность ускорять протекание одной определенной
реакции, не влияя на скорость остальных, даже очень похожих.
Различают:
Абсолютную – когда Ф катализирует только одну определенную
реакцию (аргиназа –
расщепление аргинина)
Относительную (групповую спец) – Ф катализирует определенный
класс реакций (напр. гидролитическое расщепление) или реакции при участии определенного
класса веществ.
Специфичность ферментов обусловлена их уникальной
аминокислотной последовательностью, от которой
зависит конформация активного центра, взаимодействующего с компонентами
реакции.
Вещество, химическое превращение которого катализируется
ферментом носит название субстрат (S).
3. Активность ферментов – способность в разной
степени ускорять скорость реакции. Активность выражают в:
1) Международных единицах
активности – (МЕ) количество фермента, катализирующего превращение 1 мкМ
субстрата за 1 мин.
2) Каталах (кат) – количество катализатора (фермента), способное
превращать 1 моль субстрата за 1 с.
3) Удельной активности –
число единиц активности (любых из вышеперечисленных) в исследуемом образце к
общей массе белка в этом образце.
4) Реже используют молярную
активность – количество молекул субстрата превращенных одной молекулой фермента
за минуту.
Активность зависит в первую очередь от
температуры. Наибольшую активность тот или иной фермент проявляет при
оптимальной температуре. Для Ф живого организма это значение находится в
пределах +37,0 – +39,0 °С, в зависимости от вида
животного. При понижении температуры, замедляется броуновское движение,
уменьшается скорость диффузии и, следовательно, замедляется процесс образования
комплекса между ферментом и компонентами реакции (субстратами). В случае
повышения температуры выше +40 – +50 °С молекула фермента, которая
является белком, подвергается процессу денатурации. При этом скорость
химической реакции заметно падает (рис. 4.3.1.).
Активность ферментов зависит также от рН среды. Для большинства из них
существует определенное оптимальное значение рН, при котором их активность
максимальна. Поскольку в клетке содержатся сотни ферментов и для каждого из них
существуют свои пределы опт рН, то изменение рН это один из важных факторов
регуляции ферментативной активности. Так, в результате одной химреакции при
участии определенного фермента рН опт которого лежит в перделах 7.0 – 7.2
образуется продукт, который является кислотой. При этом значение рН смещается в
область 5,5 – 6.0. Активность фермента резко снижается, скорость образования
продукта замедляется, но при этом
активизируется другой фермент, для которого эти значения рН оптимальны и продукт
первой реакции подвергается дальнейшему химическому превращению. (Еще пример
про пепсин и трипсин).
Химическая природа ферментов. Строение фермента. Активный
и аллостерический центры
Все ферменты это белки с молекулярной массой от 15
000 до нескольких млн Да. По химическому строению различают простые
ферменты (состоят только из АК) и сложные
ферменты (имеют небелковую часть или простетическую группу). Белковая часть
носит название – апофермент, а
небелковая, если она связана ковалентно с апоферментом, то называется кофермент, а если связь
нековалентная (ионная, водородная) – кофактор.
Функции простетической группы следующие: участие в акте катализа, осуществление
контакта между ферментом и субстратом, стабилизация молекулы фермента в
пространстве.
В роли кофактора обычно выступают неорганические
вещества – ионы цинка, меди, калия,
магния, кальция, железа, молибдена.
Коферменты можно рассматривать как составную часть
молекулы фермента. Это органические вещества, среди которых различают:
нуклеотиды (АТФ, УМФ,
и пр), витамины или их производные (ТДФ
– из тиамина (В1),
ФМН
– из рибофлавина (В2),
коэнзим А – из
пантотеновой кислоты (В3),
НАД и пр) и тетрапиррольные коферменты – гемы.
В процессе катализа реакции в контакт с субстратом
вступает не вся молекула фермента, а определенный ее участок, который
называется активным центром. Эта зона молекулы не состоит из
последовательности аминокислот, а формируется при скручивании белковой молекулы
в третичную структуру. Отдельные участки аминокислот сближаются между собой,
образуя определенную конфигурацию активного центра. Важная особенность строения
активного центра – его поверхность комплементарна поверхности субстрата, т.е.
остатки АК этой зоны фермента способны вступать в химическое взаимодействие с
определенными группами субстрата. Можно представить, что активный центр
фермента совпадает со структурой субстрата как ключ и замок.
В активном центре различают две зоны: центр связывания, ответственный за
присоединение субстрата, и каталитический
центр, отвечающий за химическое превращение субстрата. В состав
каталитического центра большинства ферментов входят такие АК, как Сер, Цис, Гис,
Тир, Лиз. Сложные ферменты в каталитическом центре имеют кофактор или
кофермент.
Помимо активного центра ряд ферментов снабжен
регуляторным (аллостерическим) центром. С этой зоной фермента взаимодействуют
вещества, влияющие на его каталитическую активность.
Механизм действия ферментов
Акт катализа складывается из трех последовательных
этапов.
1.
Образование
фермент-субстратного комплекса при взаимодействии через активный центр.
2.
Связывание
субстрата происходит в нескольких точках активного центра, что приводит к
изменению структуры субстрата, его деформации за счет изменения энергии связей
в молекуле. Это вторая стадия и называется она активацией субстрата. При этом
происходит определенная химическая модификация субстрата и превращение его в
новый продукт или продукты.
3.
В
результате такого превращения новое вещество (продукт) утрачивает способность
удерживаться в активном центре фермента и фермент-субстратный, вернее уже
фермент-продуктный комплекс диссоциирует (распадается).
Виды каталитических реакций:
А+Е = АЕ = БЕ = Е + Б
А+Б +Е = АЕ+Б = АБЕ = АБ + Е
АБ+Е = АБЕ = А+Б+Е, где Е – энзим, А и Б – субстраты, либо
продукты реакции.
Ферментативные эффекторы – вещества, изменяющие
скорость ферментативного катализа и регулирующие за счет этого метаболизм.
Среди них различают ингибиторы – замедляющие скорость реакции и активаторы
– ускоряющие ферментативную реакцию.
В зависимости от механизма торможения реакции
различают конкурентные и неконкурентные ингибиторы. Строение молекулы
конкурентного ингибитора сходно со структурой субстрата и совпадает с
поверхностью активного центра как ключ с замком (или почти совпадает). Степень
этого сходства может даже быть выше чем с субстратом.
Если А+Е = АЕ = БЕ = Е + Б ,
то И+Е = ИЕ ¹
Концентрация способного к катализу фермента при этом
снижается и скорость образование продуктов реакции резко падает (рис. 4.3.2.).
В качестве конкурентных ингибиторов выступает большое
число химических веществ эндогенного и экзогенного происхождения (т.е.
образующихся в организме и поступающих извне – ксенобиотики, соответственно).
Эндогенные вещества являются регуляторами метаболизма и называются
антиметаболитами. Многие из них используют при лечении онкологических и
микробных заболеваний, тк. они ингибируют ключевые метаболичекие реакции
микроорганизмов (сульфаниламиды) и опухолевых клеток. Но при избытке субстрата
и малой концентрации конкурентного ингибитора его действие отменяется.
Второй вид ингибиторов – неконкурентные. Они
взаимодействую с ферментом вне активного центра и избыток субстрата не влияет
на их ингибирующую способность, как в случае с конкурентными ингибиторами. Эти
ингибиторы взаимодействуют или с определенными группами фермента (тяжелые
металлы связываются с тиоловыми группами Цис) или чаще всего регуляторным
центром, что снижает связывающую способность активного центра. Собственно
процесс ингибирования – это полное или частичное подавление активности фермента
при сохранении его первичной и пространственной структуры.
Различают также обратимое и необратимое
ингибирование. Необратимые ингибиторы инактивируют фермент, образуя с его АК
или другими компонентами структуры химическую связь. Обычно это ковалентная связь
с одним из участков активного центра. Такой комплекс практически недиссоциирует
в физиологических условиях. В другом случае ингибитор нарушает конформационную
структуру молекулы фермента – вызывает его денатурацию.
Действие обратимых ингибиторов может быть снято при
переизбытке субстрата или под действием веществ, изменяющих химическую
структуру ингибитора. Конкурентные и неконкурентные ингибиторы относятся в
большинстве случаев к обратимым.
Помимо ингибиторов известны еще активаторы
ферментативного катализа. Они:
1)
защищают
молекулу фермента от инактивирующих воздействий,
2)
образуют
с субстратом комплекс, который более активно связывается с активным центром Ф,
3)
взаимодействуя
с ферментом, имеющим четвертичную структуру, разъединяют его субъединицы и тем
самым открывают доступ субстрату к активному центру.
Распределение ферментов в организме
Ферменты, участвующие в синтезе белков, нуклеиновых
кислот и ферменты энергетического обмена присутствуют во всех клетках
организма. Но клетки, которые выполняют специальные функции содержат и
специальные ферменты. Так клетки островков Лангерганса в поджелудочной железе
содержат ферменты, катализирующие синтез гормонов инсулина и глюкагона.
Ферменты, свойственные только клеткам определенных органов называют
органоспецифическими: аргиназа и урокиназа –
печень, кислая фосфатаза
– простата. По изменению концентрации таких ферментов в крови судят о наличии
патологий в данных органах.
В клетке отдельные ферменты распределены по всей
цитоплазме, другие встроены в мембраны митохондрий и эндоплазматического
ретикулума, такие ферменты образуют компартменты, в которых происходят
определенные, тесно связанные между собой этапы метаболизма.
Многие ферменты образуются в клетках и секретируются
в анатомические полости в неактивном состоянии – это проферменты. Часто в виде
проферментов образуются протеолитические ферменты (расщепляющие белки). Затем
под воздействием рН или других ферментов и субстратов происходит их химическая
модификация и активный центр становится доступным для субстратов.
Существуют также изоферменты – ферменты,
отличающиеся по молекулярной структуре, но выполняющие одинаковую функцию.
Номенклатура и классификация ферментов
Название фермента
формируется из следующих частей:
1.
название
субстрата с которым он взаимодействует
2.
характер
катализируемой реакции
3.
наименование
класса ферментов (но это необязательно)
4.
суффикс
-аза-
пируват – декарбоксил – аза,
сукцинат – дегидроген – аза
Поскольку
уже известно порядка 3 тыс. ферментов их необходимо классифицировать. В
настоящее время принята международная классификация ферментов, в основу которой
положен тип катализируемой реакции. Выделяют 6 классов, которые в свою очередь
делятся на ряд подклассов (в данной книге представлены только выборочно):
1.
Оксидоредуктазы. Катализируют окислительно-восстановительные
реакции. Делятся на 17 подклассов. Все ферменты содержат небелковую часть в
виде гема или производных витаминов В2, В5. Субстрат,
подвергающийся окислению выступает как донор водорода.
1.1.
Дегидрогеназы отщепляют от одного субстрата
водород и переносят на другие субстраты. Коферменты НАД, НАДФ, ФАД, ФМН. Они
акцептируют на себе отщепленный ферментом водород превращаясь при этом в
восстановленную форму (НАДН, НАДФН, ФАДН) и переносят к другому
фермент-субстратному комплексу, где его и отдают.
1.2.
Оксидазы – катализирует перенос водорода на
кислород с образованием воды или Н2О2. Ф. Цитохромокисдаза
дыхательной цепи.
RH + NAD H + O2 = ROH + NAD + H2O
1.3.
Монооксидазы – цитохром
Р450. По своему строению одновременно гемо- и флавопротеид. Он
гидроксилирует липофильные ксенобиотики (по вышеописанному механизму).
1.4.
Пероксидазы и каталазы –
катализируют разложение перекиси
водорода, которая образуется в ходе метаболических реакций.
1.5.
Оксигеназы – катализируют реакции
присоединения кислорода к субстрату.
2.
Трансферазы – катализируют перенос различных радикалов от молекулы донора к
молекуле акцептору.
Аа + Е + В = Еа + А + В = Е + Ва + А
2.1.
Метилтрансферазы (СН3-).
2.2.
Карбоксил- и карбамоилтрансферазы.
2.2.
Ацилтрансферазы – Кофермент А (перенос
ацильной группы -R-С=О).
Пример: синтез
нейромедиатора ацетилхолина (см. главу
“Обмен белков”).
2.3.
Гексозилтрансферазы – катализируют перенос гликозильных остатков.
Пример: отщепление молекулы глюкозы от гликогена под действием фосфорилазы.
2.4.
Аминотрансферазы – перенос аминогрупп
R1- CO – R2 + R1 – CH-NH3 – R2 = R1 – CH-NH3 – R2 + R1- CO – R2
Играют важную роль в превращении
АК. Общим коферментом являнтся пиридоксальфосфат.
Пример: аланинаминотрансфераза
(АлАТ): пируват + глутамат = аланин + альфа-кетоглутарат (см. главу “Обмен белков”).
2.5.
Фосфотрансфереза (киназа) – катализируют
перенос остатка фосфорной кислоты. В большинстве случает донором фосфата
является АТФ. В процессе расщепления глюкозы в основном принимают участие
ферменты этого класса.
Пример: Гексо (глюко)киназа.
3.
Гидролазы – катализируют реакции
гидролиза, т.е. расщепление веществ с присоединением по месту разрыва связи
воды. К этому классу относятся преимущественно пищеварительные ферменты, они
однокомпонентные (не содержат небелковой части)
R1-R2 +H2O = R1H + R2OH
3.1.
Эстеразы – расщепляют эфирные связи. Это большой
подкласс ферментов, катализирующих гидролиз тиоловых эфиров, фосфоэфиров.
Пример: липаза.
3.2.
Гликозидазы
– расщепляют гликозидные связи в молекулах поли- и олигосахаридов.
Пример: амилаза, сахараза, мальтаза.
3.3.
Пептидазы
– катализируют гидролиз пептидных связей.
Пример:
карбоксипептидаза, химотрипсин, трипсин.
3.5.
Амидазы
– расщепляют амидные связи (СО-NH2).
Пример: аргиназа
(цикл мочевины).
4. Лиазы – катализируют реакции расщепления молекул без присоединения воды. Эти
ферменты имеют небелковую часть в виде тиаминпирофосфата (В1) и
пиридоксальфосфата (В6).
4.1.
Лиазы
связи С-С. Их обычно называют декарбоксилазами.
Пример: пируватдекарбоксилаза.
4.2.
Лиазы
связи (гидратазы-дегидратазы) С-О.
Пример:енолаза.
4.3.
Лиазы
связи С-N.
4.4.
Лиазы
связи С-S.
5. Изомеразы – катализируют реакции изомеризации.
Пример: фосфопентозоизомераза, пентозофосфатизомераза(ферменты
неокислительной ветви пентозофосфатного пути).
6. Лигазы катализируют реакции синтеза более сложных веществ из простых. Такие
реакции идут с затратой энергии АТФ. К названию таких ферментов прибавляют
“синтетаза”.
ЛИТЕРАТУРА К ГЛАВЕ IV.3.
1. Бышевский А. Ш., Терсенов
О. А. Биохимия для врача // Екатеринбург: Уральский рабочий, 1994, 384 с.;
2. Кнорре Д. Г., Мызина С.
Д. Биологическая химия. – М.: Высш. шк. 1998, 479 с.;
3. Филиппович Ю. Б., Егорова
Т. А., Севастьянова Г. А. Практикум по общей биохимии // М.: Просвящение, 1982,
311с.;
4. Ленинджер А. Биохимия. Молекулярные основы
структуры и функций клетки // М.: Мир, 1974, 956 с.;
5. Пустовалова Л.М. Практикум по биохимии //
Ростов-на Дону: Феникс, 1999, 540 с.
Источник
