Какие свойства характерны для веществ с ионной кристаллической решеткой
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов. Рассмотрим строение кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия.
Связи между ионами в кристалле очень прочные и устойчивые.Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
Вещества с ионной кристаллической решеткой обладают следующими свойствами:
1. Относительно высокой твердостью и прочностю;
2. Хрупкостью;
3. Термостойкостью;
4. Тугоплавкостью;
5. Нелетучестью.
Примеры: соли – хлорид натрия, карбонат калия, основания – гидрооксид кальция, гидрооксид натрия.
4. Механизм образования ковалентной связи (обменный и донорно-акцепторный).
Каждый атом стремится завершить свой внешний электронный уровень, чтобы уменьшить потенциальную энергию. Поэтому ядро одного атома притягивается к себе электронную плотность другого атома и наоборот, происходит наложение электронных облаков двух соседних атомов.
Демонстрация аппликации и схемы образования ковалентной неполярной химической связи в молекуле водорода. (Учащиеся записывают и зарисовывают схемы).
Вывод: Связь между атомами в молекуле водорода осуществляется за счет общей электронной пары. Такая связь называется ковалентной.
Прочитать стр. 33 в учебнике и записать определение.
Какую связь называют ковалентной неполярной? (Учебник стр. 33).
Составление электронных формул молекул простых веществ неметаллов:
•• ••
•• CI •• CI •• – электронная формула молекулы хлора,
•• ••
CI — CI – структурная формула молекула хлора.
••
•• N •• N •• – электронная формула молекулы азота,
••
N ≡ N – структурная формула молекулы азота.
Электроотрицательность. Ковалентные полярная и неполярная связи. Кратность ковалентной связи.
Но молекулы могут образовывать и разные атомы неметаллов и в этом случае общая электронная пара будет смещаться к более электроотрицательному химическому элементу.
Изучить материал учебника на стр. 34
Вывод: Металлы имеют более низкое значение электроотрицательности, чем неметаллы. И между ними она сильно отличается.
Демонстрация схемы образования полярной ковалентной связи в молекуле хлороводорода.
Общая электронная пара смещена к хлору, как более электроотрицательному. Значит это ковалентная связь. Она образована атомами, электроотрицательности которых несильно отличаются, поэтому это ковалентная полярная связь.
Составление электронных формул молекул йодоводорода и воды:
••
H •• J •• – электронная формула молекулы йодоводорода,
••
H → J – структурная формула молекулы йодоводорода.
••
H •• O •• – электронная формула молекулы воды,
••
H
Н →О – структурная формула молекулы воды.
↑
Н
Самостоятельная работа с учебником: выписать определение электроотрицательности.
Молекулярные и атомные кристаллические решетки. Свойства веществ с молекулярными и атомными кристаллическими решетками
Самостоятельная работа с учебником.
Вопросы для самоконтроля
– Атом, какого химического элемента имеет заряд ядра +11
– Записать схему электронного строения атома натрия
– Внешний слой завершен?
– Как добиться завершения заполнения электронного слоя?
– Составить схему отдачи электрона
– Сравнить строение атома и иона натрия
– Сравнить строение атома и иона инертного газа неона.
– Определить атом, какого элемента с количеством протонов 17.
– Запишите схему электронного строения атома.
– Слой завершен? Как этого добиться.
– Составить схему завершения электронного слоя хлора.
Задание по группам:
1-3 группа: Cоставьте электронные и структурные формулы молекул веществ и укажите тип связи Br2 ; NH3.
4-6 группы: Cоставьте электронные и структурные формулы молекул веществ и укажите тип связи F2 ; HBr.
Два ученика работают у дополнительной доски с этим же заданием для образца к самопроверке.
Устный опрос.
1. Дайте определение понятия «электроотрицательность».
2. От чего зависит электроотрицательность атома?
3. Как изменяется электроотрицательность атомов элементов в периодах?
4. Как изменяется электроотрицательность атомов элементов в главных подгруппах?
5. Сравните электроотрицательность атомов металлов и неметаллов. Отличаются ли способы завершения внешнего электронного слоя, характерные для атомов металлов и неметаллов? Каковы причины этого?
7. Какие химические элементы способны отдавать электроны, принимать электроны?
Что происходит между атомами при отдаче и принятии электронов?
Как называют частицы, образовавшиеся из атома в результате отдачи или присоединения электронов?
8. Что произойдет при встрече атомов металла и неметалла?
9. Как образуется ионная связь?
10. Химическая связь, образуемая за счет образования общих электронных пар называется …
11. Ковалентная связь бывает … и …
12. В чем сходство ковалентной полярной и ковалентной неполярной связи? От чего зависит полярность связи?
13. В чем различие ковалентной полярной и ковалентной неполярной связи?
ПЛАН ЗАНЯТИЯ № 8
Дисциплина: Химия.
Тема:Металлическая связь. Агрегатные состояния веществ и водородная связь.
Цель занятия: Сформировать понятие об химических связях на примере металлической связи. Добиться понимания механизма образования связи.
Планируемые результаты
Предметные: формировании кругозора и функциональной грамотности человека для решения практических задач; умение обрабатывать, объяснять результаты; готовность и способность применять методы познания при решении практических задач;
Метапредметные: использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере;
Личностные: умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
Норма времени:2 часа
Вид занятия:Лекция.
План занятия:
1. Металлическая связь. Металлическая кристаллическая решетка и металлическая химическая связь.
2. Физические свойства металлов.
3. Агрегатные состояния веществ. Переход вещества из одного агрегатного состояния в другое.
4. Водородная связь
Оснащение: Периодическая система химических элементов, кристаллическая решетка, раздаточный материал.
Литература:
1. Химия 11 класс: учеб. для общеобразоват. организаций Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил..
2. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 – изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель: Тубальцева Ю.Н.
Источник
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки
кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
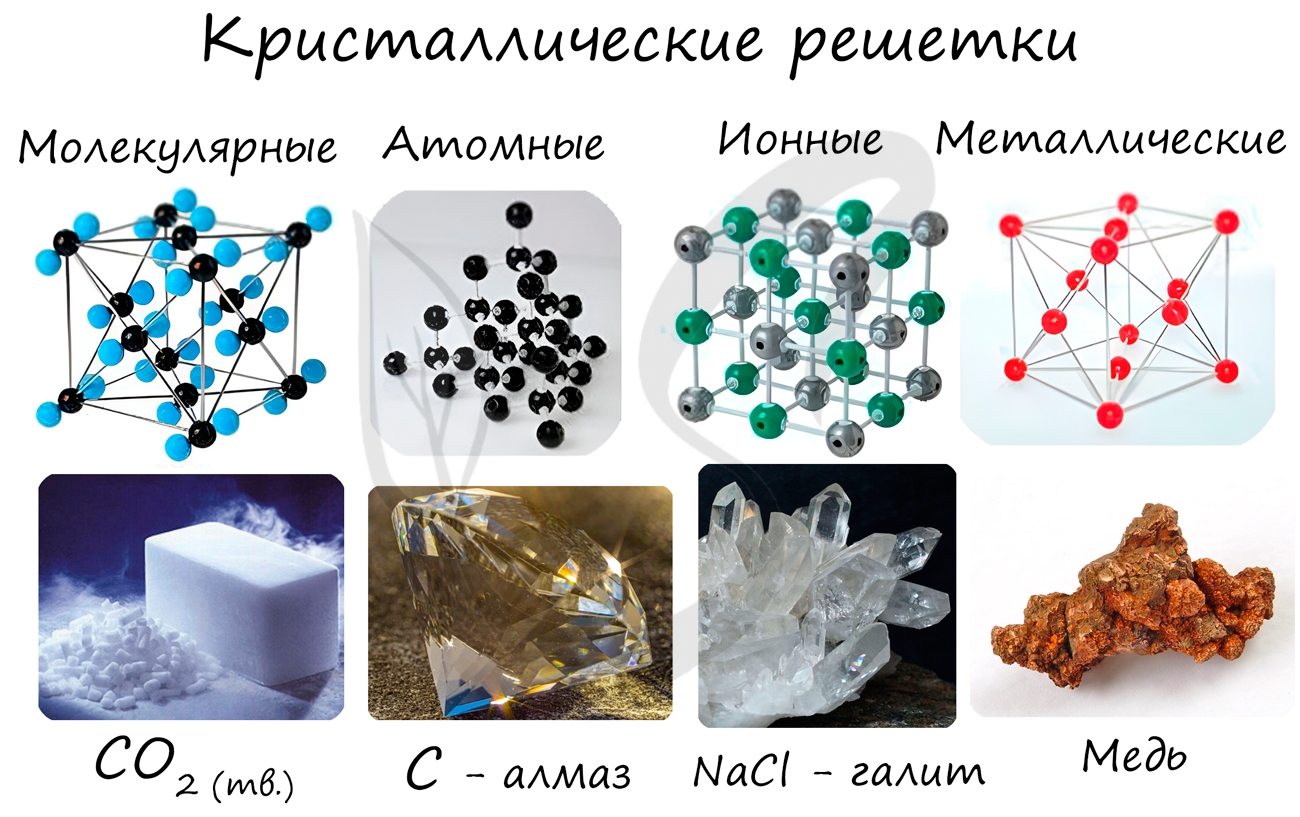
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают
пространственное расположение атомов.
Молекулярная кристаллическая решетка
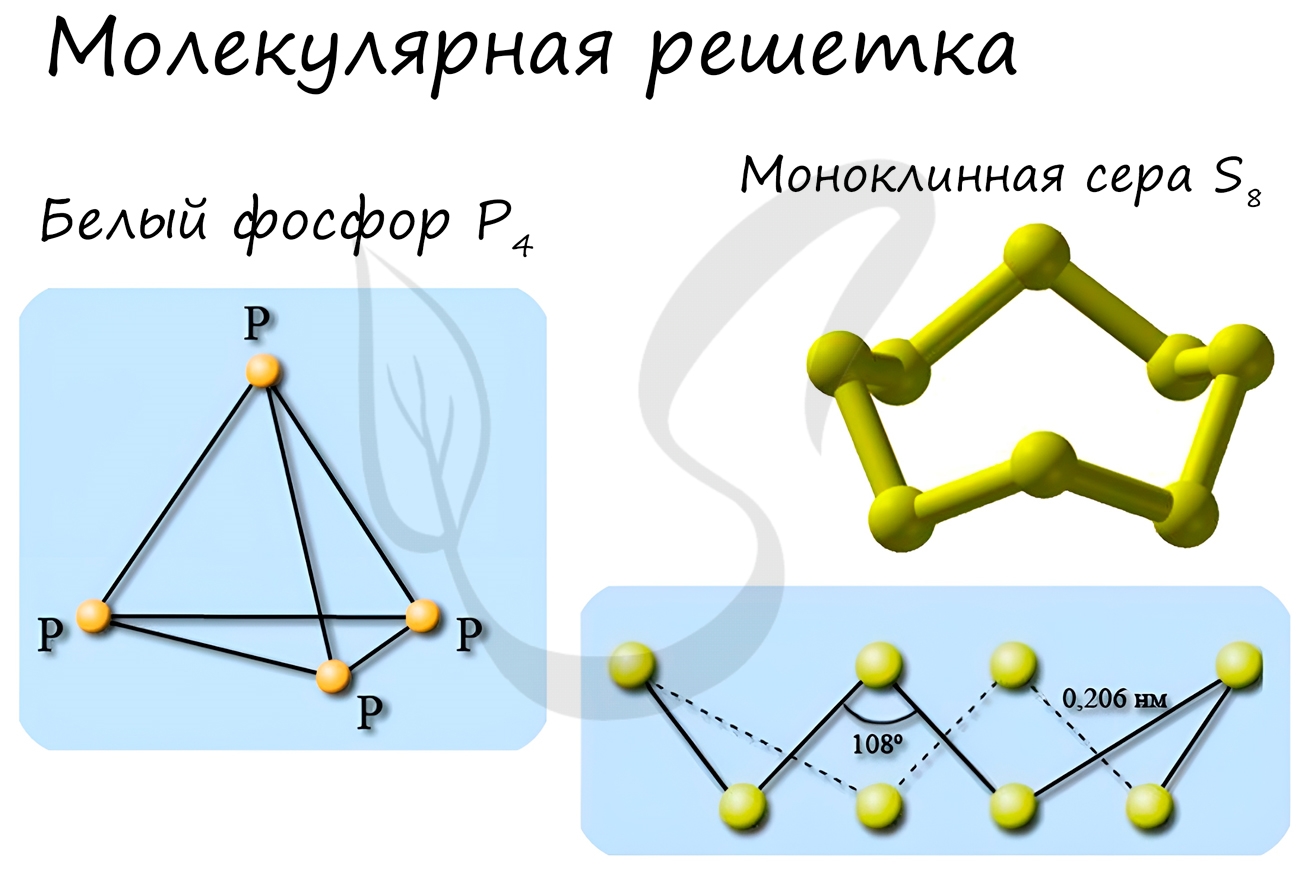
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей.
Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с
молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие
температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2.
Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы
подробно изучили в статье, посвященной классификации веществ.

Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли,
оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью – NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко
растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.
Примеры: NaCl, MgCl2, NH4Br, KNO3, Li2O, Na3PO4.

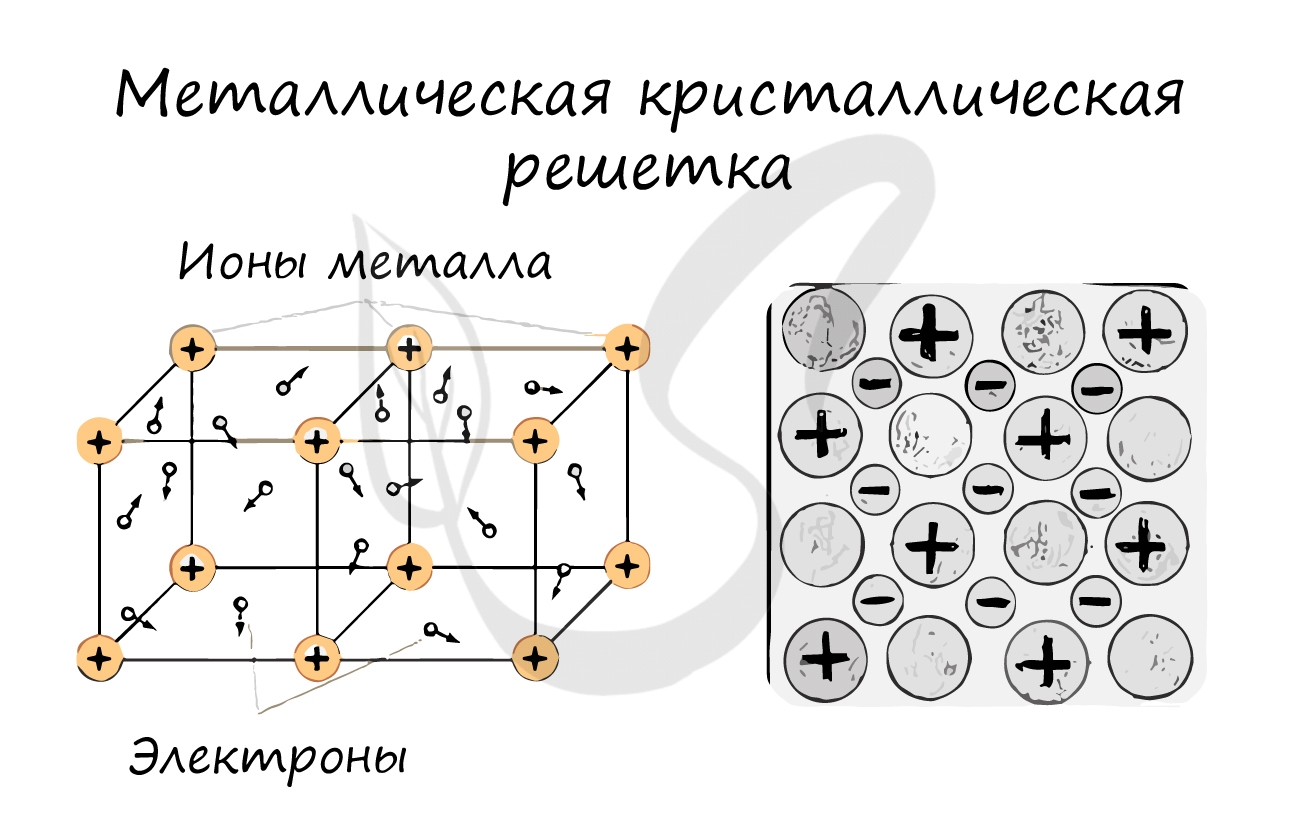
Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят
электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные,
нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
По характеру структуры кристаллические решетки всех веществ относят к одному из четырех основных типов:
а) молекулярная решетка,
б) атомная,
в) ионная,
г) металлическая.
В основу этой классификации положен род структурных частиц (молекулы-атомы-ионы), находящихся в узлах кристаллической решетки.
Молекулярная решетка
В узлах молекулярной решетки находятся полярные или неполярные молекулы, связанные между собой слабыми силами межмолекулярного взаимодействия (силами Ван-дер-Ваальса). Молекулы в кристалле способны совершать незначительные колебания различного характера. Вещества с молекулярным типом решетки, например, органические вещества, кристаллы инертных газов и большинства неметаллов, сухой лед (СО2 тверд.) обладают малой твердостью, низкими температурами плавления и кипения. Эти характеристики объясняются тем, что при приложении незначительной энергии межмолекулярные связи разрываются и кристалл разрушается с образованием отдельных молекул, что и наблюдается при плавлении и при испарении кристаллов. Внутри отдельных молекул атомы связаны значительно более прочными связями (ковалентными полярными или неполярными). Эти связи разрушаются при более высокой температуре, и молекулы распадаются на составляющие их атомы (происходит термическая диссоциация).
Атомная решетка
В узлах атомной кристаллической решетки находятся атомы. Роль сил межмолекулярного взаимодействия здесь играют достаточно прочные ковалентные связи. Выделить из общей массы атомов один невозможно. Вещества с атомным типом кристаллической решетки (алмаз, бор, кремний, карборунд SiC, нитрид алюминия и другие) характеризуются очень большой твердостью, иногда сочетающейся с хрупкостью, нерастворимостью в обычных растворителях, очень высокими температурами плавления и кипения. Все связи в кристалле равноценны. При разрыве этих связей, достигаемом лишь при высокой температуре, кристалл диссоциирует на отдельные атомы: плавление, кипение и термическая диссоциация практически совпадают.
Ионная (координационная) решетка
В узлах ионной кристаллической решетки находятся чередующиеся положительные и отрицательные ионы, связанные между собой силами кулоновского взаимодействия. Особенностью этих сил является их ненасыщаемость. Это приводит к тому, что отдельный ион координирует вокруг себя несколько ионов противоположного заряда. Ионы в кристаллах совершают упорядоченные колебания. Энергия связей между противоположно заряженными ионами очень велика, и такие кристаллы, казалось бы, должны обладать наиболее высокой твердостью и высокими температурами плавления и кипения. На самом деле эти свойства у них ниже, чем у кристаллов с атомной структурой. Причина заключается в том, что наряду с силами притяжения в кристалле действуют силы отталкивания между одноименно заряженными ионами, причем соотношение этих сил приводит к определенному равновесному состоянию. Вещества с ионной решеткой растворимы в той или иной степени в полярных растворителях.
Металлическая решетка
В узлах металлической решетки находятся положительно заряженные ионы металлов, окруженные электронами. Эти электроны, связанные отчасти с ионами силами электростатического взаимодействия, являются «полусвободными», иначе говоря «не прикреплены» к отдельным ионам, а более или менее свободно перемещаются между ними. Этот «электронный газ» обусловливает типичные для металлов свойства: тепло- и электропроводность, серовато-серебристый (у большинства металлов) цвет, металлический блеск (отражательную способность), способность отражать радиоволны, пластичность, ковкость и в то же время достаточную прочность (результат обволакивания ионов «электронным газом»). Подходя к катиону металла, электроны образуют с ним на мгновение электронейтральную частицу, которая быстро разрушается и через мгновение такой же непрочный «атом» образуется с этим или другим электроном и другим ионом металла. Между «атомами» возникают мгновенные ковалентные связи. Это и приводит к возникновению особой металлической связи, промежуточной по характеру между ионной и ковалентной, качественно отличающейся от той и другой и наблюдаемой лишь в куске металла. Энергия электронов в металле недостаточна, чтобы они могли «оторваться» от катионов металла и самопроизвольно покинуть металлическую решетку. Но при подведении энергии извне выход электронов наблюдается: фотоэлектрический эффект, термоэлектронная эмиссия. Прочность и температуры плавления и кипения у металлов не всегда имеют промежуточные значения между этими же свойствами у веществ с атомными и ионными решетками. Это зависит от природы металла. Интересно, что заряд ионов в металлах не всегда отвечает номеру группы периодической системы, в которой металл находится. Например, в кристаллической решетке алюминия ионы имеют средний заряд +2. Это можно объяснить двумя способами:
а) все атомы алюминия отдали по два электрона в «электронный газ»;
б) все атомы отдали по три электрона, но в среднем одна треть образовавшихся ионов Al+3 снова образует «атомы», поэтому средний заряд всех структурных частиц +2.
Таким образом, металлическое состояние в упрощенном представлении подобно атомарному ввиду его суммарной электронейтральности; это сосуществование и взаимосвязь «атомов»-ионов-электронов.
Типы кристаллических решеток и свойства веществ
№ | Тип кристаллической решетки | Структурные частицы кристалла | Характер связи между структурными частицами кристалла | Характер связи в молекулах | Примеры кристаллических веществ | Характерные свойства |
1. | Молекулярная | Полярные молекулы – диполи | 1. Электростатическое взаимодействие диполей. | Ковалентные полярные | HF, H2O, HCl, H2S, PCl3, NH3 (твердые) | Межмолекулярное взаимодействие средней силы. |
| Неполярные молекулы | Силы Ван-дер-Ваальса (слабые) | Ковалентные неполярные и ковалентные полярные | H2, Cl2, O2, N2, F2, СО2, SO3 (образованы молекулами симметричного строения) | Межмолекулярное взаимодействие слабое. Растворимы в неполярных растворителях, очень малая термическая устойчивость, очень слабая электропроводность, легкая летучесть (очень низкие температуры плавления и кипения), очень слабые механические свойства. | ||
2. | Атомная | Атомы | Ковалентные связи | – | C, Si, SiC, AlN, ВеО (образованы элементами, среднее арифметическое номеров групп которых равно 4) | Нерастворимы в обычных растворителях, термически устойчивы, неэлектропроводны, температуры плавления и кипения очень высокие; твердые, но хрупкие, прочность связей между частицами очень высокая. |
3. | Ионная | Ионы: катионы, анионы | 1. Электростатическое взаимодействие. | – | CsF, KCl, CaF2, CsH, NaF, ВаCl2 | Растворимы в полярных растворителях, термическая устойчивость высокая, большая электропроводность в растворах и расплавах, высокие температуры плавления; вещества твердые, но хрупкие, прочность связей между частицами высокая. |
4. | Металлическая | Катионы, «атомы», электроны | 1. Электростатическое притяжение ионов и электронов. | – | Na, K, Cu, Zn, Fe, Pt, Pb | Растворимы в расплавленных металлах, термическая устойчивость различная, электропроводность высокая, температуры плавления и кипения лежат в широких пределах; вещества пластичные, твердость, как и прочность связей между частицами, различная. |
Источник
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами.
Химическая связь подразделяется на
Внутримолекулярные
Межмолекулярные
Характеристики химической связи
Длина связи – расстояние между ядрами атомов в молекуле; зависит от количества электронных уровней у каждого элемента.
Энергия связи – энергия, затрачиваемая на разрушение связи. Чем больше длина связи, тем меньше энергия.
Полярность молекулы определяется разностью электроотрицательностей атомов. Чем больше разность электроотрицательностей, тем больше полярность связи.
Ковалентная неполярная связь
Образуют атомы с одинаковой электроотрицательностью, чаще атомы одного и того же химического элемента (неметалла).Например:Cl2.Как образуется ковалентная неполярная связь?
Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Ковалентная полярная связь
Образуют атомы неметаллов с разной электроотрицательностью. Пример:HCl.
Ионная связь
Образуется между атомами металлов и неметаллов, т.е. между атомами резко отличающимися друг от друга по электроотрицательности.
Пример: NaCl Как образуется ионная связь?
!!!!!Обрати внимание: существуют вещества, в молекуле которых одновременно присутствуют и ионные, и ковалентные связи. Например, NaOH, KNO3.
Металлическая связь
Образуется в металлах или сплавах.
Примеры: Fe
Как образуется металлическая связь?
Атомы металлов слабо удерживают свои внешние электроны. Поэтому эти электроны покидают свои атомы, превращая их в положительно заряженные ионы. Эти электроны передвигаются в пространстве между катионами металлов и удерживают их вместе.
Водородная связь
Связь между атомами водорода одной молекулы и сильно электроотрицательными элементами (O, N, F) другой молекулы.
Ван-Дер-Ваальсова связь
Это силы притяжения между молекулами.
Что такое кристаллическая решетка?
Это каркас вещества, который получится, если частицы вещества соединить линиями.
Ионная кристаллическая решетка
Ионными называют решётки, в узлах которых находятся ИОНЫ.
Свойства веществ с ионными кристаллическими решетками:
1) все вещества при обычных условиях твердые
2) хрупкие
3) имеют высокие температуры кипения и плавления
4) нелетучесть
5) многие растворимы в воде
6) расплавы и растворы проводят электрический ток
Металлические кристаллические решетки
Металлическими называют решётки, которые состоят из положительных ионов и атомов металла и свободных электронов.
Свойства веществ с металлическими кристаллическими решетками
1)Твердость
2)Электро- и теплопроводность
3)Металлический блеск
4)Ковкость, пластичность
Атомная кристаллическая решетка
Это кристаллические решётки, в узлах которых находятся отдельные атомы, соединенные ковалентными связями.
Свойства веществ с атомными решетками:
1) очень высокая твердость, прочность
2) очень высокая Тпл (алмаз 3500°С)
3) тугоплавкость
4) практически нерастворимы
5) нелетучесть
Примеры веществ атомного строения: углерод,алмаз, бор, оксид кремния.
Молекулярные кристаллические решетки
Это решётки, в узлах которых находятся молекулы, связанные слабым межмолекулярным взаимодействием.
Примеры веществ: газы, органические вещества, вода.
Свойства веществ с молекулярными решетками:
1) малая твердость, прочность
2) низкие Тпл и Ткип
3) при комнатной температуре обычно жидкости или газы
4) высокая летучесть
5) растворы и расплавы проводят электрический ток
Источник
