Какие свойства характерны для s элементов

s-Элементы
Элементы IА и IIА подгрупп , у которых заполняется внешний ns-уровень, относятся к s-элементам: ns 1 – Li, Na, K, Rb, Cs, Fr называют щелочными , а ns 2 – Be, Mg, Ca, Sr, Ba, Ra – щелочноземельными . Из приведенных в таб. 8.1 данных следует:
- Степени окисления элементов ns 1 и ns 2 всегда равны номеру группы (+1 и +2).
- В основном состоянии атомы ns 2-элементов не имеют неспаренных электронов, поэтому образованию ковалентной связи в соединениях этих элементов предшествует возбуждение ns 2 → ns 1np 1 с последующей гибридизацией sp-типа, определяющей линейное строение трехатомных молекул ЭX 2.
- Для ns 1-элементов характерно образование двухатомных молекул Э 2(σ св) 2(σ *) 0; для ns 2-элементов образование Э 2 невозможно из-за равной заселенности связывающих и разрыхляющих σ-орбиталей.
- Величины E °s-элементов предопределяют их восстановительные свойства, увеличиваясь при движении в подгруппе сверху вниз. Все s-элементы вытесняют водород из воды и кислот, восстанавливают оксиды металлов и неметаллов до простых веществ.
- Ионность связи Э–Х возрастает в подгруппе сверху вниз, а в случае оснований удлинение связи Э–OH ведет к увеличению основности.
- В соединениях LiX и BeX 2 связь Э–Х преимущественно ковалентная (малополярная).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Таблица 8.1. Важнейшие характеристики s-элементов. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
s -Металлы хранят в инертной атмосфере или под слоем жидких углеводородов, а получают обычно электролизом расплавов. Соли s-элементов окрашивают пламя в цвета: лития – в алый, натрия – в желтый, калия – в сине-фиолетовый, рубидия – в темно-красный, цезия – в бледно-голубой, кальция – в оранжево-красный, стронция – в темно-красный, бария – в светло-зеленый.
Большинство солей растворимо в воде. К нерастворимым относят LiCO 3, KClO 4, ЭCO 3, ЭSO 4, Э 3(PO 4) 2 (Э = Ca, Sr, Ba), некоторые ЭF 2.
Источник
| Группа → | 1 | 2 | 8 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ Период | ||||||||||||||
| 1 |
|
| ||||||||||||
| 2 |
|
| ||||||||||||
| 3 |
|
| ||||||||||||
| 4 |
|
| ||||||||||||
| 5 |
|
| ||||||||||||
| 6 |
|
| ||||||||||||
| 7 |
|
| ||||||||||||
s-Элементы в периодической таблице элементов — химические элементы, электронная оболочка которых включает в себя первые два s-электрона. Такие элементы объединяются в группу, называемую s-блок.
К s-элементам относятся:
- щелочные металлы,
- щелочноземельные металлы,
- водород и гелий.
S-элементы отличаются тем, что в невозбужденном состоянии высокоэнергетичный электрон атомов находится на s-орбитали. Исключая водород и гелий, эти электроны очень легко отщепляются и формируются в положительные ионы при химической реакции. Конфигурация гелия химически стабильна; за счёт этого его относят к инертным газам.
S-элементы (кроме гелия) являются сильными восстановителями и поэтому в свободном виде в природе не встречаются. Элемент в металлическом виде может быть получен только с помощью электролиза расплава соли. Гемфри Дэви, в 1807 и 1808 году, стал первым, кто выделил s-металлы из их солей, за исключением лития, бериллия, рубидия и цезия. Бериллий был впервые выделен из солей независимо двумя учёными: Ф. Вулером и А. А. Бази в 1828 году, в то время как литий был выделен Р. Бунзеном только в 1854 году, который, после изучения рубидия, выделил его спустя 9 лет. Цезий не был выделен в чистом виде вплоть до 1881 года, до того, как Карл Сеттерберг подверг электролизу цианид цезия.
Твёрдость s-элементов в компактном виде (при обычных условиях) может варьироваться от очень малой (все щелочные металлы — их можно разрезать ножом) до довольно высокой (бериллий). Исключая бериллий и магний, металлы очень реакционноспособны и могут быть использованы в сплавах со свинцом в малых количествах (<2 %). Бериллий и магний, ввиду их высокой стоимости, могут быть ценными компонентами для деталей, где требуется твёрдость и лёгкость. Эти металлы являются чрезвычайно важными, поскольку позволяют сэкономить средства при добыче титана, циркония, тория и тантала из их минеральных форм; могут находить своё применение как восстановители в органической химии.
Опасность и хранение[править | править код]
Все элементы, имеющие s-оболочку, являются опасными веществами. Они пожаро-(взрыво-)опасны, требуют особого пожаротушения, исключая бериллий и магний. Храниться должны в инертной атмосфере аргона или углеводородов. Бурно реагируют с водой, продуктом реакции является водород, например:
,
исключая магний, который реагирует медленно, и бериллия, который реагирует только когда его оксидная плёнка снята с помощью ртути. Литий имеет схожие свойства с магнием, так как находится, относительно периодической таблицы, рядом с магнием.
Примечания[править | править код]
- ↑ 1 2 Atomic weights of the elements 2013 (IUPAC Technical Report) (англ.) — IUPAC, 1960. — ISSN 0033-4545; 1365-3075; 0074-3925 — doi:10.1515/PAC-2015-0305
- ↑ Meija J., Coplen T. B., Berglund M., Brand W. A., Bièvre P. D., Gröning M., Holden N. E., Irrgeher J., Loss R. D., Walczyk T. et al. Atomic weights of the elements 2005 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry — IUPAC, 2016. — Vol. 88, Iss. 3. — ISSN 0033-4545; 1365-3075; 0074-3925 — doi:10.1515/PAC-2015-0305
Литература[править | править код]
- Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии: В 2-х томах. Пер. с англ. — М.: Мир, 1982. 652 с., ил. — Т. 1. — С. 432—437.
Источник
S-Элементы
s-Элементы – это элементы, у которых происходит заполнение s-подуровня. Данные элементы находятся в главных подгруппах первой и второй групп. S-элементы первой группы включают водород и щелочные металлы, а второй группы – бериллий, магний и щелочноземельные металлы. К s-элементам также относится инертный газ гелий.
s-металлы первой группы включают: литий (Li), натрий (Na), калий (К), рубидий (Rb), цезий (Сs) и франций (Fr). Данные металлы называются щелочными, так как два главных представителя (натрий и калий) образуют сильные основания – щелочи. На внешнем энергетическом уровне атомов данных элементов находится один электрон, который атомы щелочных металлов легко отдают, превращаясь в однозарядные катионы. С увеличением порядкового номера элементов увеличиваются радиусы атомов, что приводит к усилению восстановительной активности. Щелочные металлы характеризуются незначительной твёрдостью, малой плотностью и низкими температурами плавления.
s -элементы второй группы включают: бериллий (Ве), магний (Мg) и щелочноземельные металлы – кальций (Са), стронций (Sr), барий (Ва) и радий (Rа). Бериллий и магний существенно отличаются от остальных элементов данной группы. Бериллий является амфотерным металлом. Магний образует слабое основание, а щелочноземельные металлы – сильные основания. Данные металлы имеют на внешнем уровне по два электрона и сравнительно легко их отдают, превращаясь в двухзарядные катионы. Они имеют большую, чем щелочные металлы, твёрдость и довольно высокие температуры плавления.
Данные металлы обладают высокой химической активностью. Их активность можно определить по положению в электрохимическом ряду. Следует обратить внимание на то, что литий по положению в электрохимическом ряду самый активный металл (φ0 = –3,045 В), хотя по положению в периодической таблице он, в сравнении с остальными щелочными металлами, является самым слабым восстановителем.
Это является следствием того, что положение металла в электрохимическом ряду определяется суммой трех величин:
1) энергии разрушения кристаллической решетки;
2) энергии ионизации металла;
3) энергии гидратации образовавшегося иона.
Энергии разрушения кристаллической решетки для данных металлов примерно одинаковы. Энергия ионизации атома лития в подгруппе самая высокая (Е = 5,39 эВ), но энергия гидратации иона лития, благодаря малому радиусу, аномально высокая. По сумме данных трех величин литий в водном растворе электрохимически самый активный металл.
При взаимодействии щелочных металлов с кислородом воздуха: литий образует оксид (Li2О), натрий – пероксид (Na2О2), а калий, рубидий и цезий – надпероксиды (МеО2). Бериллий, магний и щелочноземельные металлы легко окисляются на воздухе с образованием оксидов.
Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с образованием гидроксидов:
К2О + Н2О → 2КОН,
СаО + Н2О → Са(ОН)2.
Пероксиды щелочных и щелочноземельных металлов способны взаимодействовать с углекислым газом с выделением кислорода, что позволяет использовать их в системах регенерации воздуха:
2ВаО2 + 2СО2 → 2ВаСО3 + О2.
Щелочные и щелочноземельные металлы также реагируют с другими неметаллами: галогенами, серой, азотом, водородом. При этом образуются соответствующие галогениды, сульфиды, нитриды и гидриды. Например,
2Na + Н2 → 2NaН.
Гидриды полностью разлагаются водой с образованием водорода и гидроксида металла. Например,
СаН2 + 2НОН → Са(ОН)2 + 2Н2.
Данные металлы вытесняют водород из воды, так как в элекрохимическом ряду стоят левее алюминия. Например,
Са + 2НОН → Са(ОН)2 + Н2.
Бериллий и магний с водой реагируют медленно вследствие малой растворимости образующихся гидроксидов.
Ве(ОН)2 обладает амфотерными свойствами , т.е. взаимодействует с кислотами и щелочами:
Ве(ОН)2 + 2НСl ↔ ВеСl2 + 2Н2О,
Ве(ОН)2 + 2NaОН ↔ Na2[Ве(ОН)4] (в растворе),
Ве(ОН)2 + 2NaОН ↔ Na2ВеО2 + 2Н2О (в расплаве).
Наиболее распространенные соединения данных элементов следующие:
NаCl – хлорид натрия (поваренная соль) консервант пищевых продуктов;
NаОН – гидроксид натрия (каустическая сода). Применяется для получения мыла, очистки нефти и др.
Nа2СО3 – карбонат натрия (кальцинированная сода);
NаНСО3 – гидрокарбонат натрия (питьевая сода);
Калий в виде калийных солей необходим для питания растений.
Магний нужен растениям, так как входит в состав хлорофилла.
СаО – оксид кальция (негашеная известь);
Са(ОН)2 – гидроксид кальция (гашеная известь) широко применяется в строительном деле;
СаSО4·2Н2О – сульфат кальция (гипс);
СаСО3 – карбонат кальция (известняк, мел, мрамор). При его термическом разложении получают негашеную известь и углекислый газ
СаСО3 = СаО + СО2.
Следует отметить, что соединения натрия, калия, кальция и магния нужны для жизнедеятельности живых организмов.
Водород и гелий также относятся к s-элементам. Данные элементы по распространенности во Вселенной занимают: водород – первое место, а гелий – второе.
Содержание водорода на Земле составляет ~1 %, но в свободном виде Н2 почти не встречается. Он входит в состав различных соединений. Водород существует в виде трех изотопов: протий 11Н, дейтерий 21D и тритий 31Т. В природе на 6800 атомов водорода приходится 1 атом дейтерия. Вследствие большой разницы в массах физические и химические свойства изотопов водорода и образуемых ими соединений довольно значительно отличаются. Одним из наиболее распространенных в природе химических соединений водорода является вода. На примере данного соединения будет показан общий подход при анализе строения и свойств химических соединений.
Гелий на Земле встречается только в атмосфере и содержание его невелико. В химическом отношении это инертное вещество, поэтому применяется в автогенной сварке для создания инертной среды. Температура плавления гелия – 271,4 оС (при давлении 3,0 МПа), а температура кипения – 269,9 оС, что позволяет использовать его в качестве хладоносителя в физике низких температур.
Источник
s-ЭЛЕМЕНТЫ
И ИХ СОЕДИНЕНИЯ
К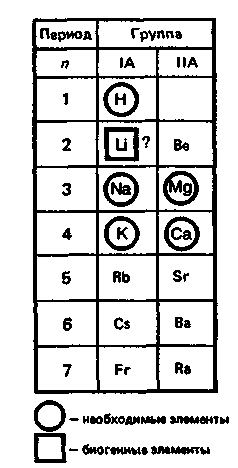 блокуs-элементов
блокуs-элементов
относятся 13 элементов, общим для которых
является застраивание в их атомах
s-подуровня
внешнего энергетического уровня.
Электронная формула внешней оболочки
элементов IА-группы
и водорода ns1![]() ,
,
а элементовIIА-группы
и гелия ns2![]() .
.
Хотя водород и гелий относят кs-элементам,
из-за специфики свойств их целесообразно
рассматривать отдельно.
Как
следует из электронных формул, элементы
IА-группы
имеют на внешнем энергетическом уровне
по одному s-электрону,
а элементы IIА-группы
— по два электрона.
Химические
свойства s-элементов
IА-
и IIА-групп
сходны. s-Элементы
легко отдают валентные s-электроны,
т. е. они представляют собой сильные
восстановители. Элементные вещества —
типичные металлы, обладающие блеском,
высокой электрической проводимостью
и теплопроводностью, химически весьма
активны.
s-Элементы
имеют малые значения энергии ионизации
при относительно больших радиусах
атомов и ионов. Как правило, они образуют
соединения с ионным типом связи,
исключение составляет водород, для
которого в соединениях даже с самыми
электроотрицательными элементами
(например, в воде) характерна преимущественно
ковалентная связь. Частично ковалентный
характер связи в соединениях в известной
мере имеет место у лития, бериллия и
магния.
Большинство
природных соединений натрия, калия,
кальция, стронция растворимы в воде и
слабых кислотах, и поэтому ионы этих
металлов могут мигрировать из водных
растворов в организм растений, животных
и человека.
Водород,
натрий, калий, магний, кальций — жизненно
необходимы для живых и растительных
организмов.
2. Водород и его соединения.
Водород
— наиболее легкий s-элемент.
Электронная формула валентной оболочки
1s1![]() Водород относится к макроэлементам и
Водород относится к макроэлементам и
играет важную роль в живых организмах.
В периодической системе водород помещают
как вместе с щелочными металлами, так
и с галогенами. Действительно, водород
сходен с элементамиIА-группы
— щелочными металлами (образование
иона Н+,
восстановительная способность,
взаимодействие с неметаллами).
Однако
гораздо большее сходство водород имеет
с галогенами: газообразное состояние
при обычных условиях, двухатомная
молекула простого вещества Н2,
неполярная связь в молекуле Н2,
полярные связи в соединениях с неметаллами,
образование гидрид-иона Н-
в соединениях с металлами NаН,
СаH2
(подобно иону Г-
в галогенидах металлов NаГ,
СаГ2).
Таким
образом, водород является элементом со
специфическими свойствами и его следует
рассматривать отдельно.
Основная
особенность атома водорода заключается
в том, что в отличие от других элементов
его валентный электрон непосредственно
находится в поле действия атомного
ядра, так как отсутствуют промежуточные
электронные оболочки, имеющиеся у других
элементов. Другое отличие водорода —
ионизированный атом — ион Н+
представляет собой элементарную частицу
— протон весьма малых размеров (10-15
м).
Водород
является одним из самых распространенных
элементов Вселенной.
Концентрирование
водорода в организме человека — около
10% (7 кг) по сравнению с его содержанием
в земной коре (1%)—свидетельствует об
исключительной роли водорода в
биологических процессах. На 100 атомов
водорода в организме человека приходится
всего 58 атомов остальных элементов. В
организме человека водород содержится
в виде различных биоорганических
соединений и воды.
Известны
три изотопа водорода: протий (H),
дейтерий (D),
тритий (Т). Протий и дейтерий — стабильные
изотопы, тритий — радиоактивен (период
полураспада 12,5 лет).
В
настоящее время дейтерий широко
используют в качестве метки, вводимой
в различные лекарственные препараты
для исследования их фармако-кинетики.
Широкое
применение находит и тритий, являющийся
излучателем β-частиц.
Этот изотоп используется в качестве
метки для изучения различных метаболических
реакций и для диагностики ряда заболеваний.
Особенно часто реагенты, меченные
тритием, используются при исследованиях
механизма действия ферментов.
Тритий
используют для определения общего
количества воды в организме. Для этого
в организм вводят определенное количество
воды, содержащей известную долю трития.
После полного усвоения введенной воды
отбирают образец сыворотки крови и
определяют в нем радиоактивность трития.
Зная радиоактивность вводимой порции
воды и радиоактивность сыворотки крови,
можно рассчитать общее количество воды
в организме.
Хотя
дейтерий не радиоактивен, при работе с
дейтерированными соединениями необходимо
учитывать токсическое
действие дейтерия на
живые организмы.
Простые
вещества.
Водород
образует двухатомные молекулы. Наличие
трех изотопов обусловливает способность
водорода образовывать молекулы протия
Н2,
дейтерия
D2,
трития
Т2,
протодейтерия
НD,
прототрития НТ,
дейтеротрития
DТ.
Наибольший
интерес в связи с большой распространенностью
в земной коре и живых организмах изотопа
протия представляют свойства простого
вещества протия Н2
— диводорода,
в
дальнейшем именуемого просто водородом.
Водород
— самый легкий из всех газов. Малорастворим
в воде, но хорошо растворим в некоторых
металлах: Рt,
Рd
и др. Вследствие неполярности и большой
прочности молекулы Н2
при
комнатной температуре водород малоактивен
и взаимодействует только с фтором. При
нагревании водород реагирует со многими
неметаллами — хлором, бромом, серой,
кислородом и др. Восстановительная
способность водорода используется для
получения некоторых простых веществ
из оксидов и галогенидов. Так, например,
при высокой температуре происходит
восстановление оксида меди (II):
СuО(т)
+ Н2(г)
= Сu(т)
+ Н2О(г)
Вследствие
высокого поляризующего действия протон
никогда не существует как таковой, он
обязательно соединяется с другими
атомами и молекулами, например, с водой
ион водорода Н+
образует
ион оксония Н3О+.
В организме человека в соединениях с
углеродом, азотом, серой водород
ковалентно связан. Небольшая часть
водорода находится в виде иона оксония
Н3О+
(например, в желудочном соке). Содержащиеся
в желудочном соке ионы оксония проявляют,
с одной стороны, противомикробное
действие — убивают многие микроорганизмы,
занесенные в желудок с пищей. С другой
стороны, ионы Н3О+
оказывают каталитическое действие —
при их участии гидролизуются белки,
полисахариды и другие биоорганические
соединения.
Спецификой
строения атома водорода обусловлено
образование водородной связи. В живых
организмах водородные связи имеются
как в самом растворителе — воде, так и
в растворенных в ней веществах — сахарах,
белках, нуклеиновых кислотах и др.
Во
всех соединениях, содержащихся в живых
организмах, водород имеет степень
окисления +1.
Наряду
со способностью отдавать электрон атом
водорода может присоединять электрон.
При этом образуется отрицательный ион
водорода — гидрид
—
Н-,
имеющий устойчивую электронную
конфигурацию благородного газа гелия.
В виде иона Н-
водород находится в соединениях с
активными металлами — гидридах. При
взаимодействии водорода с такими
металлами проявляется его окислительная
способность.
Биологическая
роль важнейших соединений водорода и
их применение в медицине.
Вода
—
одно из самых важных и распространенных
на Земле соединений водорода. Водное
пространство занимает почти 75% поверхности
земного шара. В организме взрослого
человека в среднем содержится 65—67%
воды, у эмбрионов (4-месячных) — 94, у
новорожденных — 74%.
Все
химические реакции в организме протекают
только в водной среде. Жизнь без воды
невозможна. Дистиллированная вода —
фармакопейный препарат.
Тяжелую
воду D2О
широко применяют для изучения движения
воды в растениях и скорости всасывания
воды в человеческом организме. Например,
использование D2О
позволило установить, что в тканях
некоторых растений вода двигается со
скоростью 14 м в час, а вода, выпитая
человеком, за 2 ч полностью распределяется
по органам и тканям организма, и лишь
через две недели полностью выводится
из него.
В
медицинской практике находит применение
еще одно соединение водорода — пероксид
водорода
Н2О2.
Это соединение является важным побочным
продуктом метаболизма.
П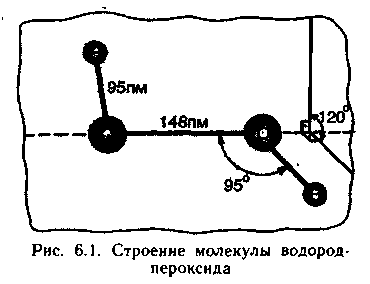 ероксид
ероксид
водорода — бесцветная, прозрачная
жидкость. При попадании на кожу и
слизистые вызывает жжение. Строение
молекулы Н2О2
показано на рис. 6.1. Молекула Н2О2
полярна, дипольный момент р =7,1 D.
Наличие неподеленных пар электронов у
атомов кислорода делает возможным
образование донорно-акцепторных связей
пероксида водорода с лигандами —
акцепторами электронов.
Степень
окисления кислорода в Н2О2
равна
-1, т.е. имеет промежуточное значение
между степенью окисления кислорода в
воде (—2) и в элементном кислороде О2
(0). Из этого следует, что пероксид водорода
может проявлять как свойства окислителя,
так и свойства восстановителя
(окислительно-восстановительная
двойственность). Однако, для пероксида
водорода более характерны окислительные
свойства. Большинство встречающихся
на практике веществ имеет более низкие
окислительно-восстановительные
потенциалы и Н2О2
может их окислять. Восстанавливать
пероксид водорода может лишь относительно
небольшую группу веществ.
В
качестве примера реакции, в которой
Н2О2
выступает окислителем, можно привести
реакцию окисления сульфида никеля (II)
в кислой среде до элементной серы:
NiS
+ H2O2
+ 2CH3COOH
= Ni(СНзСОО)2
+S + 2H2O
При
взаимодействии с очень сильными
окислителями, например с РbО2
в
кислой среде, Н2О2
выступает в качестве восстановителя:
РbО2
+ Н2O2
+ 2СН3СООН
= Рb(СН3СОО)2
+ О2
+ 2Н2О
Чистый
пероксид водорода термодинамически
нестабилен и при стоянии разлагается
со взрывом на воду и кислород с выделением
большого количества теплоты:
2Н2О2(ж)
= 2Н2О
+ О2
Такое
разложение Н2О2
является реакцией диспропорционирования
(самоокисления — самовосстановления).
Водные
растворы пероксида водорода более
устойчивы, в прохладном месте они могут
сохраняться длительное время. В продажу
пероксид водорода обычно поступает в
виде 30%-ного водного раствора — пергидроля.
Обычно
в митохондриях атомы водорода, отщепленные
от субстратов дегидрогеназами, передают
свои электроны через цепь переносчиков
кислороду О2,
который восстанавливается при этом до
воды:
О2
+ 4Н+
+ 4е~
=
2Н2О
Для
клетки очень важно, чтобы, присоединив
4 электрона, молекула кислорода
восстанавливалась до двух молекул воды.
При неполном восстановлении кислорода,
например в случае присоединения 2
электронов, образуется пероксид водорода:
О2
+ 2Н+
+ 2е-
=
Н2О2
а
при присоединении 1 электрона —
надпероксидный (супероксидный) радикал
О2-:
О2
+ е-
=
О2-
Процесс
разложения пероксида водорода значительно
ускоряется в присутствии солей тяжелых
металлов. Катализируемое ионом металла
разложение пероксида водорода может
приводить к образованию радикалов,
наиболее важными из которых являются
гидроксидный НО• и гидропероксидный
НО2•.
Например, под действием Fе2+
происходит разрыв связи НО—ОН:
Fе2+
+ Н2О2
→ •ОН + ОН-
+ Fе3+
Важные
промежуточные продукты восстановления
элементного кислорода до воды — пероксид
водорода и супероксидный радикал очень
токсичны для клетки. Токсичность связана
с тем, что Н2О2
и О2
взаимодействуют с липидным слоем
клеточных мембран и повреждают их.
Аэробные
клетки могут защитить себя от вредного
действия водородпероксида и
супероксид-радикала с помощью ферментов
каталазы и, супероксиддисмутазы. Под
действием медьсодержащего фермента
супероксиддисмутазы (СОД) супероксидный
радикал превращается в водородпероксид
и элементный кислород, а под действием
каталазы пероксид водорода превращается
в воду и элементный кислород:
2Н2О2
→
2Н2О
+ О2
Освободившийся
кислород принимает участие в дальнейших
процессах биологического окисления.
В
медицинской практике пероксид водорода
применяют в основном как наружное
бактерицидное средство. Действие Н2О2
основано на окислительной способности
пероксида водорода и безвредности
продукта его восстановления — воды.
При обработке ран выделяющийся кислород
играет двойную роль:
1)
оказывает противомикробное, дезодорирующее
и депигментирующее действие, убивая
микробные тела;
2)
образует пену, способствуя переходу
частиц тканевого распада во взвешенное
состояние и очищению ран.
В
качестве фармакопейного препарата
используется 3%-ный водный раствор
пероксида водорода, 6%-ный раствор
пероксида водорода применяют для
обесцвечивания волос. В виде 30%-ного
раствора пероксида водорода применяют
при лечении бородавчатой формы красного
плоского лишая и для удаления юношеских
бородавок.
Наряду
с окислительно-восстановительными
свойствами Н2О2
проявляет
и кислотно-основные. В молекуле пероксида
водорода связи между атомами водорода
и кислорода полярны, поэтому в водном
растворе пероксида водорода ведет себя
как очень слабая двухосновная кислота,
т.е. отщепляет протоны. Н2О2
в незначительной степени ионизирует
по первой ступени:
Н2О2
⇄
Н+
+ НО2-1
Ионизация
по второй ступени:
НО2-1
⇄
Н+
+ О22-
в
водной среде практически не протекает.
Вода — более сильная кислота и ионы
водорода, образующиеся при диссоциации
воды, подавляют ионизацию НО2-1
(смещение
влево по принципу Ле Шателье).
3.
Общая характеристика s-элементов
IА-группы.
Щелочные металлы.

В
IА-группу
входят s-элементы
— щелочные металлы, исключительно
важные для нормальной жизнедеятельности
животных и человека. Наибольшее значение
для живых организмов имеют макроэлементы
натрий, калий.
Электронная
формула валентной оболочки, атомов
щелочных металлов ns1,
т.е. атомы этих элементов имеют по одному
валентному электрону на s-подуровне
внешнего энергетического уровня.
Соответственно, устойчивая степень
окисления щелочных металлов равна +1.
Все
элементы IА-группы
очень сходны по свойствам, что объясняется
однотипным строением не только валентной
электронной оболочки, но и предвнешней
(за исключением лития).
С
ростом радиуса атома в группе
Li—Nа—К—RЬ—Сs—Fr
ослабевает связь валентного электрона
с ядром. Соответственно, в этом ряду
энергия ионизации атомов щелочных
металлов уменьшается. Имея на валентных
оболочках один электрон, расположенный
на большом расстоянии от ядра, атомы
щелочных металлов легко отдают электрон.
Это обусловливает низкую энергию
ионизации. В результате ионизации
образуются катионы Э+,
имеющие
устойчивую электронную конфигурацию
атомов благородных газов.
В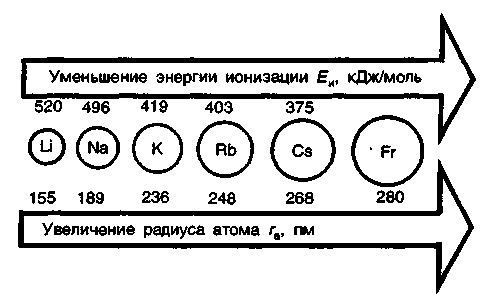 се
се
щелочные металлы имеют отрицательные
стандартные окислительно-восстановительные
потенциалы, большие по абсолютной
величине. Это характеризует их как очень
сильные восстановители. По химической
активности литий уступает многим
металлам, несмотря на то, что его
стандартный ОВ-потенциал наиболее
отрицателен. Такое значение лития
обусловлено большей энергией гидратации
ионовLi+
по сравнению с ионами других щелочных
металлов.
Вследствие
незначительного поляризующего действия
(устойчивая электронная структура,
большие размеры, малый заряд ядра)
комплексообразование для ионов щелочных
металлов, в особенности для ионов К+,
Rb+,
Сs+,
Fr+,
малохарактерно. Тем не менее, они способны
образовать комплексные соединения с
некоторыми биолигандами.
Несмотря
на общность свойств, натрий и в особенности
литий отличаются от других щелочных
металлов. Последнее, прежде всего,
обусловлено существенным различием
радиусов их атомов и строения электронных
оболочек.
Сходство
электронного строения ионов щелочных
металлов, а, следовательно, и
физико-химических свойств соединений
определяет и близость их действия на
биологические процессы. Различия в
электронной структуре обусловливают
их разную биологическую роль. На этой
основе можно прогнозировать поведение
щелочных металлов в живых организмах.
Так,
натрий и литий накапливаются во
внеклеточной жидкости, а калий, рубидий
и цезий — во внутриклеточной. Вследствие
близких значений радиусов ионов, энергий
ионизации, одинаковых координационных
чисел в живых организмах натрий и литий
ведут себя сходным образом. Эти элементы,
как правило, близки по оказываемому
биологическому действию. Например, они
очень похожи по ферментоактивирующим
свойствам.
Близость
свойств натрия и лития обусловливает
их взаимозамещаемость в организме. В
связи с этим при избыточном введении
ионов натрия или лития в организм они
способны эквивалентно замещать друг
друга. На этом основано введение натрия
хлорида при отравлении солями лития. В
соответствии с принципом Ле Шателье
равновесие между ионами натрия и лития
в организме сдвигается в направлении
выведения ионов Li+,
что приводит к снижению его концентрации
и достижению лечебного эффекта. Известные
примеры влияния взаимозамещения натрия
и лития на активность ферментативных
процессов показывают, что в четырех
случаях из пяти натрий является
синергистом лития и только в одном
случае антагонистом.
Рубидий
и цезий близки по физико-химическим
свойствам к иону калия, поэтому в живых
организмах они ведут себя сходным
образом. В изученных системах калий,
рубидий и цезий являются синергистами,
а с литием — антагонистами. На сходстве
рубидия и калия основано введение в
организм солей калия при отравлении
солями рубидия.
Натрий
и калий, как правило, являются антагонистами,
но в ряде случаев близость многих
физико-химических свойств обусловливает
их взаимозамещение в живых организмах.
Так, например, при увеличении количества
натрия в организме усиливается выведение
калия почками, т. е. наступает гипокалиемия.
Щелочные
металлы относятся к числу наиболее
активных в химическом отношении
элементов. Химическая активность
щелочных металлов закономерно
увеличивается с ростом радиуса атомов.
При
взаимодействии с кислородом литий
образует оксид Li2О,
а остальные щелочные металлы — пероксиды
Nа2О2
и надпероксиды КО2,
RbО2,
СsО2.
Например:
4Li(т)
+ O2(г)
= 2Li2O(т)
2Nа(т)
+
О2(г)
= Nа2О2(т)
К(т)
+ O2(г)
= КO2(т)
П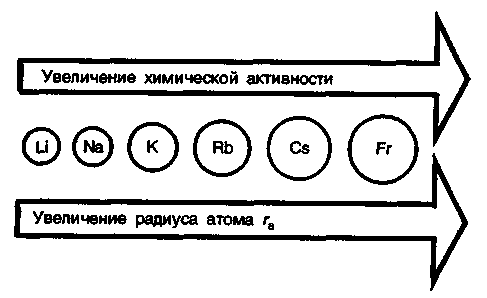 ероксиды
ероксиды
и надпероксиды щелочных металлов —
сильные окислители. Натрий пероксид и
калий надпероксид применяют в замкнутых
объектах (подводных лодках, космических
кораблях) для поглощения углерода
диоксида и регенерации кислорода:
2Nа2О2(т)
+ 2СО2(г)
= 2Nа2СО3(т)
+ О2(г)
4КО2(т)
+ 2СО2(г)
= 2К2СО3(т)
+ 3О2(г)
Активно
взаимодействуют щелочные металлы с
галогенами, образуя галогениды ЭГ; с
серой — с образованием сульфидов Э2S.
Непосредственно с азотом щелочные
металлы, за исключением лития, не
реагируют.
Все
щелочные металлы непосредственно
взаимодействуют с водой, образуя
гидроксиды ЭОН (щелочи):
2Э(т)
+ 2Н2О(ж)
= 2ЭОН(р) + Н2(г)
Интенсивность
взаимодействия с водой значительно
увеличивается в ряду Li
— Сs.
Гидроксиды образуются
