Какие свойства характерны для этилена

Формула – С2Н4 (СН2 = СН2). Молекулярная масса (масса одного моль) – 28 г/моль.
Углеводородный радикал, образованный от этилена называется винил (-CH = CH2). Атомы углерода в молекуле этилена находятся в sp2-гибридизации.
Химические свойства этилена
Для этилена характерны реакции, протекающщие по механизму электрофильного, присоединения, реакции радикального замещения, окисления, восстановления, полимеризации.
Галогенирование
(электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды:
CH2 = CH2 + Br2 = Br-CH2-CH2Br.
Галогенирование этилена возможно также при нагревании (300![]() С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
CH2 = CH2 + Cl2 → CH2 = CH-Cl + HCl.
Гидрогалогенирование
— взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов:
CH2 = CH2 + HCl → CH3-CH2-Cl.
Гидратация
— взаимодействие этилена с водой в присутствии минеральных кислот (серной, фосфорной) с образованием предельного одноатомного спирта – этанола:
CH2 = CH2 + H2О → CH3-CH2-ОН.
Среди реакций электрофильного присоединения выделяют присоединение хлорноватистой кислоты (1), реакции гидрокси- и алкоксимеркурирования (2, 3) (получение ртутьорганических соединений) и гидроборирование (4):
CH2 = CH2 + HClO → CH2(OH)-CH2-Cl (1);
CH2 = CH2 + (CH3COO)2Hg + H2O → CH2(OH)-CH2-Hg-OCOCH3 + CH3COOH (2);
CH2 = CH2 + (CH3COO)2Hg + R-OH → R-CH2(OCH3)-CH2-Hg-OCOCH3 + CH3COOH (3);
CH2 = CH2 + BH3 → CH3-CH2-BH2 (4).
Реакции нуклеофильного присоединения характерны для производных этилена, содержащих электроноакцепторные заместители. Среди реакций нуклеофильного присоединения особое место занимают реакции присоединения циановодородной кислоты, аммиака, этанола. Например,
2ON-CH = CH2 + HCN →2ON-CH2-CH2-CN.
В ходе реакций окисления этилена возможно образование различных продуктов, причем состав определяется условиями проведения окисления. Так, при окислении этилена в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомного спирта — этиленгликоля:
3CH2 = CH2 + 2KMnO4 +4H2O = 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH.
При жестком окислении этилена кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием муравьиной кислоты и углекислого газа:
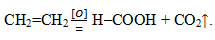
Окисление
этилена кислородом при 200![]() С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
CH2 = CH2 +1/2O2 = CH3-CH = O.
При восстановлении этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2 = CH2 + H2 = CH3-CH3.
Этилен вступает в реакцию полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация этилена происходит под действием кислот
(катионный механизм) или радикалов (радикальный механизм):
n CH2 = CH2 = -(-CH2-CH2-)n-.
Физические свойства этилена
Этилен – бесцветный газ со слабым запахом, малорастворимый в воде, растворим в спирте, хорошо растворим в диэтиловом эфире. При смешении с воздухом образует взрывоопасную смесь
Получение этилена
Основные способы получения этилена:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
CH3-CH2-Br + KOH → CH2 = CH2 + KBr + H2O;
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
Сl-CH2-CH2-Cl + Zn → ZnCl2 + CH2 = CH2;
— дегидратация этилена при его нагревании с серной кислотой (t >150![]() C) или пропускании его паров над катализатором
C) или пропускании его паров над катализатором
CH3-CH2-OH → CH2 = CH2 + H2O;
— дегидрирование этана при нагревании (500![]() С) в присутствии катализатора (Ni, Pt, Pd)
С) в присутствии катализатора (Ni, Pt, Pd)
CH3-CH3 → CH2 = CH2 + H2↑.
Применение этилена
Этилен является одним из важнейших соединений, производимых в огромных промышленных масштабах. Его используют в качестве сырья для производства целого спектра различных органических соединений (этанол, этиленгликоль, уксусная кислота и т.д.). Этилен служит исходным сырьем для производства полимеров
(полиэтилен и др.). Его применяют в качестве вещества, ускоряющего рост и созревание овощей и фруктов.
Примеры решения задач
Источник
История открытия этилена
Этилен впервые был получен немецким химиком Иоганном Бехером в 1680 году при действии купоросного масла (H2SO4) на винный (этиловый) спирт (C2H5OH).
CH3-CH2-OH+H2SO4→CH2=CH2+H2O
Вначале его отождествляли с «горючим воздухом», т. е. с водородом. Позднее, в 1795 году этилен подобным же образом получили голландские химики Дейман, Потс-ван-Трусвик, Бонд и Лауеренбург и описали под названием «маслородного газа», так как обнаружили способность этилена присоединять хлор с образованием маслянистой жидкости – хлористого этилена («масло голландских химиков»), (Прохоров,1978).
Изучение свойств этилена, его производных и гомологов началось с середины XIX века. Начало практического использования этих соединений положили классические исследования А.М. Бутлерова и его учеников в области непредельных соединений и особенно создания Бутлеровым теории химического строения. В 1860 году он получил этилен действием меди на йодистый метилен, установив структуру этилена.
В 1901 году Дмитрий Николаевич Нелюбов выращивал горох в лаборатории, В Санкт-Петербурге, но семена давали искривленные, укороченные проростки, у которых верхушка была согнута крючком и не сгибалась. В теплице и на свежем воздухе проростки были ровные, рослые, и верхушка на свету быстро распрямляла крючок. Нелюбов предложил, что фактор, вызывающий физиологический эффект, находится в воздухе лаборатории.
В то время помещения освещали газом. В уличных фонарях горел тот же газ, и давно было замечено, что при аварии в газопроводе стоящие рядом с местом утечки газа деревья преждевременно желтеют и сбрасывают листья.
Осветительный газ содержал разнообразные органические вещества. Чтобы удалить примесь газа, Нелюбов пропускал его через разогретую трубку с оксидом меди. В «очищенном» воздухе проростки гороха развивались нормально. Для того чтобы выяснить, какое именно вещество вызывает ответ проростков, Нелюбов добавлял различные компоненты светильного газа по очереди, и обнаружил, что добавка этилена вызывает:
1) замедление роста в длину и утолщение проростка,
2) «не разгибающуюся» апикальную петельку,
3) Изменение ориентации проростка в пространстве.
Эта физиологическая реакция проростков была названа тройным ответом на этилен. Горох оказался настолько чувствительным к этилену, что его стали использовать в биотестах для определения низких концентрациях этого газа. Вскоре было обнаружено, что этилен вызывает и другие эффекты: листопад, созревание плодов и т.д. Оказалось, что этилен способны синтезировать сами растения, т.е. этилен является фитогормоном (Петушкова,1986).
Физические свойства этилена
Этиле́н — органическое химическое соединение, описываемое формулой С2H4. Является простейшим алкеном (олефином).
Этилен – бесцветный газ со слабым сладким запахом плотностью 1,178 кг/м³ (легче воздуха), его вдыхание оказывает наркотическое действие на человека. Этилен растворяется в эфире и ацетоне, значительно меньше — в воде и спирте. При смешении с воздухом образует взрывоопасную смесь
Затвердевает при –169,5°C, плавится при таких же температурных условиях. Кипит этен при –103,8°C. Воспламеняется при нагревании до 540°C. Газ хорошо горит, пламя светящееся, со слабой копотью. Округленная молярная масса вещества — 28 г/моль. Третий и четвертый представители гомологического ряда этена — тоже газообразные вещества. Физические свойства пятого и следующих алкенов отличаются, они являются жидкостями и твердыми телами.
Получение этилена
Основные способы получения этилена:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
CH3-CH2-Br + KOH → CH2 = CH2 + KBr + H2O;
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
Сl-CH2-CH2-Cl + Zn → ZnCl2 + CH2 = CH2;
— дегидратация этилена при его нагревании с серной кислотой (t >150˚ C) или пропускании его паров над катализатором
CH3-CH2-OH → CH2 = CH2 + H2O;
— дегидрирование этана при нагревании (500С) в присутствии катализатора (Ni, Pt, Pd)
CH3-CH3 → CH2 = CH2 + H2↑.
Химические свойства этилена
Для этилена характерны реакции, протекающщие по механизму электрофильного, присоединения, реакции радикального замещения, окисления, восстановления, полимеризации.
1. Галогенирование(электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды:
CH2 = CH2 + Br2 = Br-CH2-CH2Br.
Галогенирование этилена возможно также при нагревании (300С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
CH2 = CH2 + Cl2 → CH2 = CH-Cl + HCl.
2. Гидрогалогенирование — взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов:
CH2 = CH2 + HCl → CH3-CH2-Cl.
3. Гидратация — взаимодействие этилена с водой в присутствии минеральных кислот (серной, фосфорной) с образованием предельного одноатомного спирта – этанола:
CH2 = CH2 + H2О → CH3-CH2-ОН.
Среди реакций электрофильного присоединения выделяют присоединение хлорноватистой кислоты(1), реакции гидрокси- и алкоксимеркурирования (2, 3) (получение ртутьорганических соединений) и гидроборирование (4):
CH2 = CH2 + HClO → CH2(OH)-CH2-Cl (1);
CH2 = CH2 + (CH3COO)2Hg + H2O → CH2(OH)-CH2-Hg-OCOCH3 + CH3COOH (2);
CH2 = CH2 + (CH3COO)2Hg + R-OH → R-CH2(OCH3)-CH2-Hg-OCOCH3 + CH3COOH (3);
CH2 = CH2 + BH3 → CH3-CH2-BH2 (4).
Реакции нуклеофильного присоединения характерны для производных этилена, содержащих электроноакцепторные заместители. Среди реакций нуклеофильного присоединения особое место занимают реакции присоединения циановодородной кислоты, аммиака, этанола. Например,
2ON-CH = CH2 + HCN →2ON-CH2-CH2-CN.
4. окисление. Этилен легко окисляется. Если этилен пропускать через раствор перманганата калия, то он обесцветится. Эта реакция используется для отличия предельных и непредельных соединений. В результате образуется этиленгликоль
3CH2 = CH2 + 2KMnO4 +4H2O = 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH.
При жестком окислении этилена кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием муравьиной кислоты и углекислого газа:
Окисление этилена кислородом при 200С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
CH2 = CH2 +1/2O2 = CH3-CH = O.
5. гидрирование. При восстановлении этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2 = CH2 + H2 = CH3-CH3.
6. Этилен вступает в реакцию полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация этилена происходит под действием кислот (катионный механизм) или радикалов (радикальный механизм):
n CH2 = CH2 = -(-CH2-CH2-)n-.
7. Горение:
C2H4 + 3O2 → 2CO2 + 2H2O
8. Димеризация. Димеризация — процесс образования нового вещества путём соединения двух структурных элементов (молекул, в том числе белков, или частиц) в комплекс (димер), стабилизируемый слабыми и/или ковалентными связями.
2CH2=CH2→CH2=CH-CH2-CH3
Применение
Этилен используют в двух основных категориях: в качестве мономера, из которого построены большие углеродные цепи, и в качестве исходного материала для других двух-углеродных соединений. Полимеризации – это повторяющиеся объединения множества мелких молекул этилена в более крупные. Этот процесс происходит при высоких давлениях и температурах. Области применения этилена многочисленны. Полиэтилен – это полимер, который используется особенно массово в производстве упаковочных пленок, проволочных покрытий и пластиковых бутылок. Еще одно применение этилена в качестве мономера касается формирования линейных α-олефинов. Этилен является исходным материалом для приготовления ряда двух-углеродных соединений, таких как этанол (технический спирт), окись этилена (антифриз, полиэфирные волокна и пленки), ацетальдегида и винил хлорида. Кроме этих соединений, этилен с бензолом образует этилбензол, который используется в производстве пластмасс и синтетического каучука. Рассматриваемое вещество является одним из простейших углеводородов. Однако свойства этилена делают его биологически и хозяйственно значимым.
Свойства этилена дают хорошую коммерческую основу для большого количества органических (содержащих углерод и водород) материалов. Одиночные молекулы этилена могут быть соединены вместе для получения полиэтилена (что означает много молекул этилена). Полиэтилен используется для изготовления пластмасс. Кроме того, он может быть использован для изготовления моющих средств и синтетических смазочных материалов, которые представляют собой химические вещества, используемые для уменьшения трения. Применение этилена для получения стиролов актуально в процессе создания резины и защитной упаковки. Кроме того, он используется в обувной промышленности, особенно это касается спортивной обуви, а также при производстве автомобильных покрышек. Применение этилена является коммерчески важным, а сам газ является одним из наиболее часто производимых углеводородов в глобальном масштабе.
Этилен используется в производстве стекла специального назначения для автомобильной промышленности .
Дата добавления: 2017-04-14; просмотров: 11085 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org – Контакты – Последнее добавление
Источник
Продолжение. Начало см. в № 9/2009.
Л е к ц и я 3.
Непредельные углеводороды ряда этилена, общая
формула состава. Электронное и пространственное
строение, химические свойства этилена
Непредельные углеводороды ряда этилена, или
алкены, – это углеводороды с общей формулой CnH2n,
молекулы которых содержат одну двойную связь.
Атомы C, связанные двойной связью, находятся в
состоянии sp2-гибридизации, двойная
связь является сочетанием – и -связей. По своей природе -связь резко отличается от -связи; -связь менее прочная
вследствие перекрывания электронных облаков вне
плоскости молекулы.
Простейшим алкеном является этилен.
Структурная и электронная формулы этилена имеют
вид:

В молекуле этилена подвергаются гибридизации
одна s– и две p-орбитали атомов C (sp2-гибридизация).
Таким образом, каждый атом C имеет по три
гибридных орбитали и по одной негибридной p-орбитали.
Две из гибридных орбиталей атомов C взаимно
перекрываются и образуют между атомами C -связь. Остальные
четыре гибридных орбитали атомов C перекрываются
в той же плоскости с четырьмя s-орбиталями
атомов H и также образуют четыре -связи. Две негибридные p-орбитали
атомов C взаимно перекрываются в плоскости,
которая расположена перпендикулярно плоскости -связей, т.е.
образуется одна -связь.
Под действием реагентов -связь легко разрывается.
Молекула этилена симметрична; ядра всех атомов
расположены в одной плоскости и валентные углы
близки к 120°; расстояние между центрами атомов C
равно 0,134 нм.
Если атомы соединены двойной связью, то их
вращение невозможно без того, чтобы электронные
облака -связи не
разомкнулись.
Этилен – первый член гомологического ряда
алкенов.


Но молекула бутена-2 может находиться в виде
двух пространственных форм – цис- и транс-:

Цис- и трансизомеры, имея различное
расположение атомов в пространстве, отличаются
многими физическими и химическими свойствами.
Таким образом, для алкенов возможны два вида структурной
изомерии: изомерия углеродной цепи и изомерия
положения двойной связи. Возможна также геометрическая
изомерия.
Этилен (этен) – бесцветный газ с очень слабым
сладковатым запахом, немного легче воздуха,
малорастворим в воде.
По химическим свойствам этилен резко
отличается от этана, что обусловлено электронным
строением его молекулы. Имея в молекуле двойную
связь, состоящую из – и -связей,
этилен способен присоединять два одновалентных
атома или радикала за счет разрыва -связи.
• Способность к реакциям присоединения
характерна для всех алкенов.
1. Присоединение водорода (реакция
гидрирования):
![]()
2. Присоединение галогенов (реакция
галогенирования):
![]()
При добавлении к алкену брома (в виде бромной
воды) бурая окраска брома быстро исчезает. Эта
реакция является качественной на двойную связь.
3. Присоединение галогеноводородов
(реакция гидрогалогенирования):

Если исходный алкен несимметричен, то реакция
протекает по правилу Марковникова.
Присоединение галогеноводородов к
непредельным соединениям идет по ионному механизму.
4. Присоединение воды (реакция
гидратации):
![]()
Этой реакцией пользуются для получения
этилового спирта в промышленности.
• Для алканов характерны реакции окисления:
1. Этилен легко окисляется уже при обычной
температуре, например при действии перманганата
калия. Если этилен пропускать через водный
раствор перманганата калия KMnO4, то
характерная фиолетовая окраска последнего
исчезает, происходит окисление этилена (реакция
гидроксилирования) перманганатом калия
(качественная реакция на двойную связь):

2. Этилен горит светящимся пламенем с
образованием оксида углерода(IV) и воды:
C2H4 + 3O2 —> 2CO2 + 2H2O.
3. Большое промышленное значение имеет
частичное окисление этилена кислородом воздуха:

• Для этилена, как и для всех непредельных
углеводородов, характерны реакции полимеризации.
Они протекают при повышенной температуре,
давлении и в присутствии катализаторов:

Полимеризация – это последовательное
соединение одинаковых молекул в более крупные.
Таким образом, для этилена и его гомологов
характерны реакции присоединения, окисления и
полимеризации.
Л е к ц и я 4.
Ацетилен – представитель углеводородов с
тройной связью в молекуле.
Химические свойства, получение и применение
ацетилена в органическом синтезе
Алкины – это углеводороды с общей
формулой CnH2n–2, молекулы
которых содержат одну тройную связь.
Ацетилен – первый член гомологического
ряда ацетиленовых углеводородов, или алкинов.
Молекулярная формула ацетилена C2H2.
Структурная формула ацетилена H–C=C–H.
Электронная формула:
H : С : : : С : Н.
Углеродные атомы ацетилена, связанные тройной
связью, находятся в состоянии sp-гибридизации.
При образовании молекулы ацетилена у каждого
атома С гибридизуются по одной s– и p-орбитали.
В результате этого каждый атом С приобретает по
две гибридных орбитали, а две p-орбитали
остаются негибридными. Две гибридных орбитали
взаимно перекрываются, и между атомами С
образуется -связь.
Остальные две гибридных орбитали перекрываются
с s-орбиталями атомов H, и между ними и атомами
С тоже образуются -связи. Четыре негибридных p-орбитали
размещены взаимно перпендикулярно и
перпендикулярно направлениям -связей. В этих плоскостях p-орбитали
взаимно перекрываются, и образуются две -связи, которые
относительно непрочные и в химических реакциях
легко разрываются.
Таким образом, в молекуле ацетилена имеются три
-связи (одна
связь C–C и две связи C–H) и две -связи между двумя С атомами.
Тройная связь в алкинах – не утроенная
простая, а комбинированная, состоящая из трех
связей: одной –
и двух -связей.
Молекула ацетилена имеет линейное строение.
Появление третьей связи вызывает дальнейшее
сближение атомов С: расстояние между их центрами
составляет 0,120 нм.
Физические свойства. Ацетилен –
бесцветный газ, легче воздуха, мало растворим в
воде, в чистом виде почти без запаха.
Химические свойства. По химическим
свойствам ацетилен во многом аналогичен этилену.
Для него характерны реакции присоединения,
окисления и полимеризации.
• Реакции присоединения. Алкины
присоединяют не одну, а две молекулы реагента.
Тройная связь вначале переходит в двойную, а
затем – в простую связь (-связь).
1. Присоединение водорода (реакция
гидрирования) происходит при нагревании в
присутствии катализатора. Реакция протекает в
две стадии, сначала образуется этилен, а
затем – этан:
![]()
2. Присоединение галогенов (реакция
галогенирования) протекает очень легко (также в
две стадии):

Бромная вода при этом обесцвечивается.
Обесцвечивание бромной воды служит качественной
реакцией на ацетилен, как и на все непредельные
углеводороды.
3. Присоединение галогеноводородов (реакция
гидрогалогенирования). Важное значение имеет
реакция присоединения хлороводорода:

Из винилхлорида получают полимер –
поливинилхлорид.
4. Присоединение воды (реакция
гидратации) протекает в присутствии солей
ртути(II) – HgSO4, Hg(NO3)2 – с
образованием уксусного альдегида:

Эта реакция носит имя русского ученого Михаила
Григорьевича Кучерова (1881).
• Реакции окисления. Ацетилен очень
чувствителен к окислителям.
1. При пропускании через раствор
перманганата калия ацетилен легко окисляется, а
раствор KMnO4 обесцвечивается:
![]()
Обесцвечивание перманганата калия может быть
использовано как качественная реакция на
тройную связь.
При окислении обычно происходит расщепление
тройной связи и образуются карбоновые кислоты:
R–C=C–R’ + 3[O] + H2O —> R–COOH
+ R’–COOH.
Ацетилен при полном сгорании образует оксид
углерода(IV) и воду:
2C2H2 + 5O2 —> 4CO2 +
2H2O.
На воздухе ацетилен горит сильно коптящим
пламенем.
• Реакции полимеризации. В
определенных условиях ацетилен способен
полимеризоваться в бензол и винилацетилен.
1. При пропускании ацетилена над
активированным углем при 450–500 °С происходит
тримеризация ацетилена с образованием бензола
(Н.Д.Зелинский, 1927 г.):

2. Под действием водного раствора CuCl и NH4Cl
ацетилен димеризуется, образуя винилацетилен:
![]()
Винилацетилен обладает большой реакционной
способностью; присоединяя хлороводород, он
образует хлоропрен, используемый для получения
искусственного каучука:

Получение ацетилена. В лаборатории и в
промышленности ацетилен получают
взаимодействием карбида кальция с водой
(карбидный способ):

Карбид кальция получают в электропечах при
нагревании кокса с негашеной известью:
![]()
На получение CaC2 затрачивается много
электроэнергии, поэтому карбидный метод не может
удовлетворить потребности в ацетилене.
В промышленности ацетилен получают в
результате высокотемпературного крекинга
метана:
![]()
Применение ацетилена в органическом синтезе.
Ацетилен широко применяют в органическом
синтезе. Он является одним из исходных веществ
при производстве синтетических каучуков,
поливинилхлорида и других полимеров. Из
ацетилена получают уксусную кислоту,
растворители (1,1,2,2-тетрахлорэтан и
1,1,2-трихлорэтен). При сжигании ацетилена в
кислороде температура пламени достигает
3150 °С, поэтому его используют при сварке и
резке металлов.
Примеры промышленного использования
ацетилена:


Л е к ц и я 5.
Диеновые углеводороды, их строение, свойства,
получение и практическое значение
Диеновые углеводороды, или алкадиены, – это
углеводороды, содержащие в углеродной цепи две
двойные связи. Их состав может быть выражен общей
формулой CnH2n–2. Они изомерны
ацетиленовым углеводородам.
Большое применение имеют алкадиены, в
молекулах которых двойные связи разделены
простой связью (сопряженные двойные связи) –
это

которые являются исходными веществами для
получения каучуков.
Для образования двух двойных связей в одной
молекуле необходимо по крайней мере три атома С.
Простейшим представителем алкадиенов является
пропадиен CH2=C=CH2.
Диеновые углеводороды могут различаться
положением двойной связи в углеродной цепи:

Также возможна изомерия углеродной цепи.
Бутадиен-1,3 является простейшим сопряженным
алкадиеном. В бутадиене-1,3 все четыре атома С
находятся в состоянии sp2-гибридизации.
Они лежат в одной плоскости и образуют скелет
молекулы. Негибридные p-орбитали каждого
атома С перпендикулярны плоскости скелета и
параллельны друг другу, что создает условия для
их взаимного перекрывания. Перекрывание
происходит не только между атомами С1–С2,
С3–С4, но и частично между атомами С2–С3.
При перекрывании четырех p-орбиталей
происходит образование единого -электронного облака, т.е.
сопряжение двух двойных связей (, -сопряжение).
Физические свойства. Бутадиен-1,3 при
нормальных условиях – газ, который сжижается
при t = 4,5 °С; 2-метилбутадиен-1,3 – летучая
жидкость, кипящая при t = 34,1 °С.
Химические свойства. Диеновые углеводороды
с сопряженными двойными связями обладают
высокой химической активностью.
• Они легко вступают в реакции присоединения,
реагируя с водородом, галогенами,
галогеноводородами и т.д.
Обычно присоединение происходит по концам
молекул диенов. Так, при взаимодействии с бромом
двойные связи разрываются, к крайним атомам С
присоединяются атомы брома, а свободные
валентности образуют двойную связь, т.е. в
результате присоединения происходит
перемещение двойной связи:

При избытке брома может быть присоединена еще
одна его молекула по месту оставшейся двойной
связи.
У алкадиенов реакции присоединения могут
протекать по двум направлениям:
1) по месту разрыва одной двойной связи
(1,2-присоединение):

2) с присоединением к концам молекулы и разрывом
двух двойных связей (1,4-присоединение):

Преимущественное протекание реакции по тому
или иному пути зависит от конкретных условий.
• Вследствие наличия двойных связей диеновые
углеводороды довольно легко полимеризуются.
Продуктом полимеризации 2-метилбутадиена-1,3
(изопрена) является полиизопрен – аналог
натурального каучука:

Получение. Каталитический способ получения
бутадиена-1,3 из этанола был открыт в 1932 г. Сергеем
Васильевичем Лебедевым. По способу Лебедева
бутадиен-1,3 получается в результате
одновременного дегидрирования и дегидратации
этанола в присутствии катализаторов на основе ZnO
и Al2O3:

Но более перспективным методом получения
бутадиена является дегидрирование бутана,
содержащегося в нефтяных газах. При t = 600 °С
происходит ступенчатое дегидрирование бутана
при наличии катализатора:

Каталитическим дегидрированием изопентана
получается изопрен:

Практическое значение. Диеновые
углеводороды в основном применяются для синтеза
каучуков:

Реакция полимеризации бутадиена-1,3:
![]()
Печатается с
продолжением
Л.И.ПОПОВА,
учитель химии
(г. Новоуральск, Свердловская обл.)
Источник
