Какие свойства характерны для альдегидов
Общая формула предельных альдегидов и кетонов CnH2nO. В названии альдегидов присутствует суффикс –аль.
Простейшие представители альдегидов – формальдегид (муравьиный альдегид) –СН2 = О, ацетальдегид (уксусный альдегид) – СН3-СН = О. Существуют циклические альдегиды, например, циклогексан-карбальдегид; ароматические альдегиды имеют тривиальные названия – бензальдегид, ванилин.
Атом углерода в карбонильной группе находится в состоянии sp2-гибридизации и образует 3σ-связи (две связи С-Н и одну связь С-О). π-связь образована р-электронами атомов углерода и кислорода. Двойная связь С = О является сочетанием σ- и π-связей. Электронная плотность смещена в сторону атома кислорода.
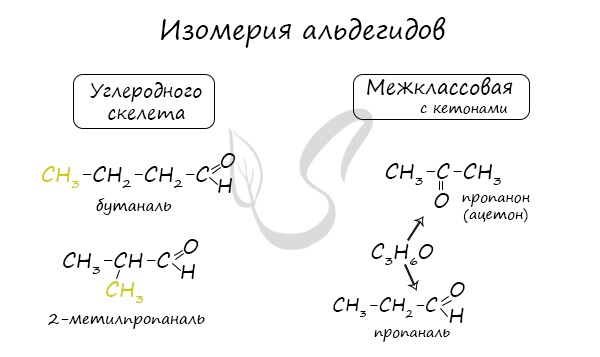
Для альдегидов характерна изомерия углеродного скелета, а также межклассовая изомерия с кетонами:
СН3-СН2-СН2-СН = О (бутаналь);
СН3-СН(СН3)-СН = О (2-метилпентаналь);
СН3-С(СН2-СН3) = О (метилэтилкетон).
Химические свойства альдегидов
В молекулах альдегидов имеется несколько реакционных центров: электрофильный центр (карбонильный атом углерода), участвующий в реакциях нуклеофильного присоединения; основный центр – атом кислорода с неподеленными электронными парами; α-СН кислотный центр, отвечающий за реакции конденсации; связь С-Н, разрывающаяся в реакциях окисления.
1. Реакции присоединения:
— воды с образованием гем-диолов
R-CH = O + H2O ↔ R-CH(OH)-OH;
— спиртов с образованием полуацеталей
CH3-CH = O + C2H5OH ↔CH3-CH(OH)-O-C2H5;
— тиолов с образованием дитиоацеталей (в кислой среде)
CH3-CH = O + C2H5SH ↔ CH3-CH(SC2H5)-SC2H5 + H2O;
— гидросульфита натрия с образованием α-гидроксисульфонатов натрия
C2H5-CH = O + NaHSO3 ↔ C2H5-CH(OH)-SO3Na;
— аминов с образованием N-замещенных иминов (основания Шиффа)
C6H5CH = O + H2NC6H5 ↔ C6H5CH = NC6H5 + H2O;
— гидразинов с образованием гидразонов
CH3-CH = O +2HN-NH2 ↔ CH3-CH = N-NH2 + H2O;
— циановодородной кислоты с образованием нитрилов
CH3-CH = O + HCN ↔ CH3-CH(N)-OH;
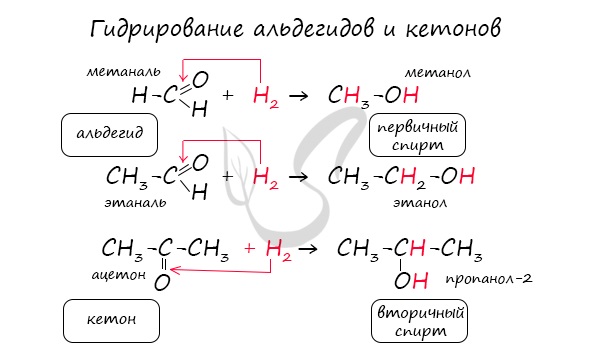
— восстановление. При взаимодействии альдегидов с водородом получаются первичные спирты:
R-CH = O + H2 → R—CH2-OH;
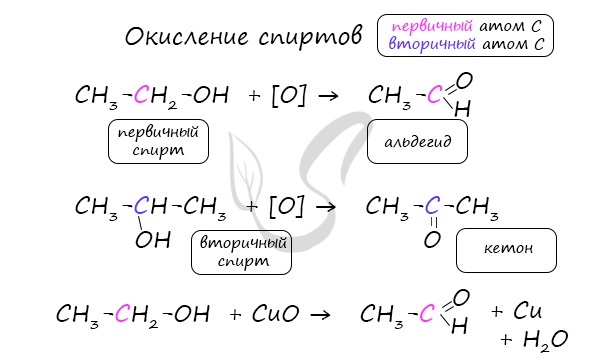
2. Окисление
— реакция «серебряного зеркала» — окисление альдегидов аммиачным раствором оксида серебра
R-CH = O + Ag2O → R-CO-OH + 2Ag↓;
— окисление альдегидов гидроксидом меди (II), в результате которого выпадает осадок оксида меди (I) красного цвета
CH3-CH = O + 2Cu(OH)2 → CH3-COOH + Cu2O↓ + 2H2O;
Эти реакции являются качественными реакциями на альдегиды.
Физические свойства альдегидов
Первый представитель гомологического ряда альдегидов – формальдегид (муравьиный альдегид) – газообразное вещество (н.у.), альдегиды неразветвленного строения и состава С2-С12 – жидкости, С13 и длиннее – твердые вещества. Чем больше атомов углерода входит в состав неразветвленного альдегида, тем выше его температура кипения. С увеличением молекулярной массы альдегидов увеличиваются значения величин их вязкости, плотности и показателя преломления. Формальдегид и ацетальдегид способны смешиваться с водой в неограниченных количествах, однако, с ростом углеводородной цепи эта способность альдегидов снижается. Низшие альдегиды обладают резким запахом.
Получение альдегидов
Основные способы получения альдегидов:
— гидроформилирование алкенов. Эта реакция заключается в присоединении СО и водорода к алкену в присутствии карбонилов некоторых металлов VIII группы, например, октакарбонилдикобальта (Cо2(СО)8) Реакция проводится при нагревании до 130![]() С и давлении 300 атм
С и давлении 300 атм
СН3-СН = СН2 + СО +Н2 →СН3-СН2-СН2-СН = О + (СН3)2СНСН = О;
— гидратация алкинов. Взаимодействие алкинов с водой происходит в присутствии солей ртути (II) и в кислой среде:
НС≡СН + Н2О → СН3-СН = О;
— окисление первичных спиртов (реакция протекает при нагревании)
СН3-СН2-ОН + CuO → CH3-CH = O + Cu + H2O.
Применение альдегидов
Альдегиды нашли широкое применение в качестве сырья для синтеза различных продуктов. Так, из формальдегида (крупнотоннажное производство) получают различные смолы (фенол-формальдегидные и т.д.), лекарственные препараты (уротропин); ацетальдегид — сырье для синтеза уксусной кислоты, этанола, различных производных пиридина и т.д. Многие альдегиды (масляный, коричный и др.) используют в качестве ингредиентов в парфюмерии.
Примеры решения задач
Источник
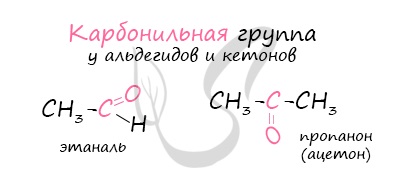
Альдегиды – летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа
в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных.
Общая формула альдегидов CnH2nO.
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.

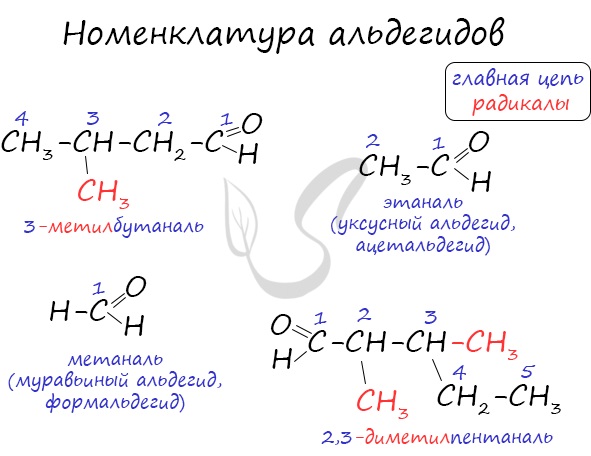
Номенклатура и изомерия альдегидов
Названия альдегидов формируются путем добавления суффикса “аль” к названию алкана с соответствующим числом атомов углерода: метаналь,
этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот – HO. Например: метаналь – HCHO, этаналь –
CH3CHO, пропаналь – C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь – формальдегид, этаналь – ацетальдегид. Замечу, что формалином
называется 40% раствор формальдегида.
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
Получение альдегидов и кетонов
- Окисление спиртов
- Пиролиз солей карбоновых кислот
- Каталитическое дегидрирование спиртов
- Реакция Кучерова
- Гидролиз дигалогеналканов
- Окисление метана
- Кумольный способ получения ацетона (и фенола)
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов – кетоны.
Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или
бариевых солей карбоновых кислот возможно получение кетонов.

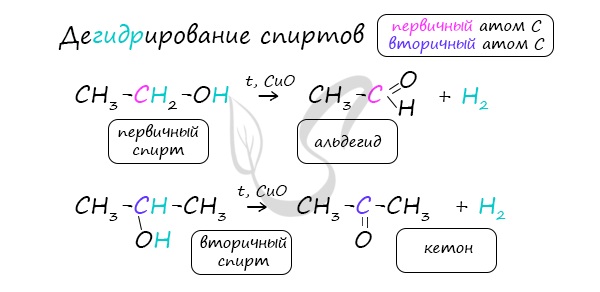
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по
атому водорода. В результате образуется карбонильная группа.
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в
соответствующие кетоны.

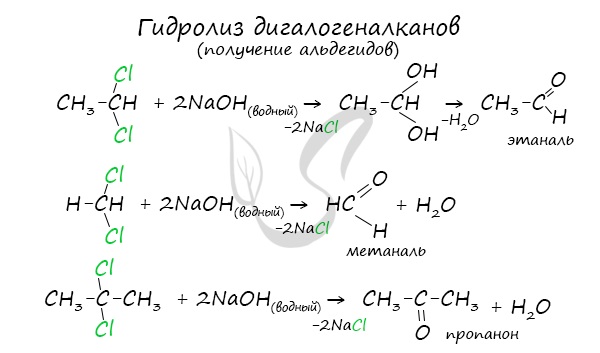
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов – у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы
и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.

В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.

Химические свойства альдегидов и кетонов
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
- Реакции присоединения
- Окисление альдегидов
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный
элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме
углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить
при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе.
Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов – вторичных спиртов.
В результате полного окисления, горения, образуется углекислый газ и вода.
2CH3CHO + 5O2 → 4CO2 + 4H2O
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции
серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли

Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая
распадается на углекислый газ и воду. Это связано с интересным фактом – наличием альдегидной группы у муравьиной кислоты.

Окисление также возможно другим реагентом – гидроксидом меди II. Эта реакция также относится к качественным для
альдегидов, в результате образуется кирпично-красный осадок оксида меди I.

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
1. Р. Окисления.
Альдегиды легко окисляются до карбоновых кислот. Окислителями могут служить гидроксид меди (II), оксид серебра, кислород воздуха:
Ароматические альдегиды окисляются труднее алифатических. Кетоны, как было сказано выше, окисляются труднее альдегидов. Окисление кетонов проводится в жестких условиях, в присутствии сильных окислителей. Образуются в результате смеси карбоновых кислот. Как отличить альдегиды от кетонов? Различие в способности к окислению служит основой качественных реакций, позволяющих отличить альдегиды от кетонов. Многие мягкие окислители легко реагируют с альдегидами, но инертны по отношению к кетонам. а) Реактив Толленса (аммиачный раствор оксида серебра), содержащий комплексные ионы [Ag(NH3)2]+, дает с альдегидами реакцию «серебряного зеркала». При этом образуется металлическое серебро. Раствор оксида серебра готовят непосредственно перед опытом:
Реактив Толленса окисляет альдегиды до соответствующих карбоновых кислот, которые в присутствии аммиака образуют аммонийные соли. Сам окислитель при этой реакции восстанавливается до металлического серебра. За тонкий серебряный налет на стенках пробирки, который образуется при этой реакции, реакция альдегидов с аммиачным раствором оксида серебра получила название реакции «серебряного зеркала». СН3-СН=O)+2[Ag(NH3)2]OH->CH3COONH4+2Ag+3NH3+H2O. Альдегиды также восстанавливают свежеприготовленный аммиачный раствор гидроксида меди (II), обладающий светло-голубой окраской (реактив Фелинга), до желтого гидроксида меди (I), который при нагревании разлагается с выделением ярко-красного осадка оксида меди (I). СН3-СН=О + 2Cu(ОН)2 — СН3СООН+2CuОН+Н2О 2CuOH->Cu2O+H2O
2. Р. Присоединения
Гидрирование – присоединение водорода.
Карбонильные соединения восстанавливаются до спиртов водородом, алюмогидридом лития, боргидридом натрия. Водород присоединяется по связи C=O. Реакция идет труднее, чем гидрирование алкенов: требуется нагревание, высокое давление и металлический катализатор (Pt, Ni):
3. Взаимодействие с водой.
4. Взаимодействие, со спиртами.
При взаимодействии альдегидов со спиртами могут образовываться полуацетали и ацетали. Полуацетали представляют собой соединения, в которых при одном атоме углерода содержится гидроксильная и алкоксильная группа. К ацеталям относят вещества, в молекулах которых содержится атом углерода с двумя алкоксильными заместителями.
Ацетали, в отличие от альдегидов, более устойчивы к окислению. Благодаря обратимости взаимодействия со спиртами их часто используют в органическом синтезе для « защиты» альдегидной группы.
4.Присоединение гидросульфитов.
Гидросульфит NaHSO3 тоже присоединяется по связи C=O с образованием кристаллического производного, из которого карбонильное соединение может быть регенерировано. Бисульфитные производные используются для очистки альдегидов и кетонов.
В результате поликонденсации фенола с формальдегидом в присутствии катализаторов образуются фенолформальдегидные смолы, из которых получают пластмассы — фенопласты (бакелиты). Фенопласты — важнейшие заменители цветных и черных металлов во многих отраслях промышленности. Из них изготавливается большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали. Фрагмент фенолформальдегидной смолы показан ниже:
Исходными соединениями для получения альдегидов и кетонов могут быть углеводороды, галогенопроизводные, спирты и кислоты.
Применение карбонильных соединений
Формальдегид используется для получения пластмасс, например бакелита, дубления кож, дезинфекции, протравливания семян. Совсем недавно в нашей стране разработан метод получения полиформальдегида (—СН2—О—)n, который обладает высокой химической и термической устойчивостью.
Это ценнейший конструкционный пластик, способный во многих случаях заменить металлы. Ацетальдегид используют для получения уксусной кислоты и некоторых пластмасс. Ацетон применяется как исходное вещество для синтеза многих соединений (например, метилметакрилата, полимеризацией которого получают оргстекло); он используется также в качестве растворителя.
Источник
Химические свойства альдегидов и кетонов определяются тем, что в состав их молекул входит карбонильная группа с полярной двойной связью >C=O.
1. Высокая полярность связи С=О вызывает на карбонильном атоме углерода значительный дефицит электронной плотности (Cδ+), и по этому атому углерода возможна нуклеофильная атака. При этом, взаимодействие с нуклеофилами приводит к разрыву π-связи и образованию более прочной σ-связи.
2. Высокая полярность связи С=О вызывает на атоме углерода, соседнем с карбонильной группой (α-углеродном атоме), повышенную полярность связи С-Н α-углеродного атома. Это характеризует данные соединения как СН-кислоты.
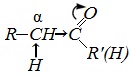
Для альдегидов и кетонов наиболее характерны реакции, протекающие по механизму нуклеофильного присоединения (AN).
Реакционная способность в таких реакциях уменьшается от альдегидов к кетонам:
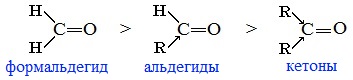
Самый активный из альдегидов – формальдегид Н2СО.
Сравнение реакционной способности альдегидов и кетонов
При сравнении реакционной способности альдегидов и кетонов необходимо учесть 2 фактора: электронный и пространственный.
Альдегиды более реакционноспособны, чем кетоны. Кетоны реагируют обычно в более жестких условиях, чем альдегиды, а в некоторые реакции даже и не вступают.
Электронный фактор связан с величиной положительного заряда на карбонильном атоме углерода и влиянием на него электронодонорных эффектов заместителей R и R’.
В молекулах кетонов на карбонильный атом углерода действуют индуктивные эффекты двух углеводородных радикалов R и R’, а в молекулах альдегидов одного радикала R, поэтому в случае кетонов величина положительного заряда на этом атоме меньше.
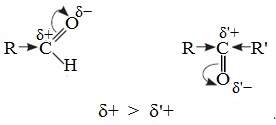
Следовательно, взаимодействие кетонов с нуклеофилами протекает труднее.
Пространственный фактор связан с доступностью реакционного центра (Cδ+) для нуклеофильной атаки, а это зависит от размеров заместителей R и R’.
В молекулах альдегидов (содержат один радикал R) карбонильный атом углерода оказывается более доступен по сравнению с кетонами, поэтому нуклеофильные реакции для альдегидов протекают легче, чем для кетонов.
Реакционная способность карбонильных соединений определяется величиной частичного положительного заряда δ+ на атоме углерода в карбонильной группе. Чем этот заряд больше, тем выше химическая активность карбонильного соединения.
- Углеводородные радикалы у группы С=О увеличивают пространственные препятствия присоединению к карбонильному атому углерода новых атомов или атомных групп.
- Углеводородные радикалы за счет +I-эффекта уменьшают положительный заряд на атоме углерода карбонильной группы, что затрудняет присоединение нуклеофильного реагента.
Для карбонильных соединений характерны реакции:
- присоединение по карбонильной группе;
- реакции замещения у α-углеродного атома;
- полимеризация;
- поликонденсация;
- окисление.
Химические свойства альдегидов (таблица)
Химические свойства альдегидов и кетонов (таблица)
Химические свойства альдегидов на примере ацетальдегида
Реакции присоединения
Присоединение большинства реагентов по двойной связи С=О происходит как ионная реакция по механизму нуклеофильного присоединения AN.
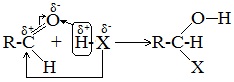
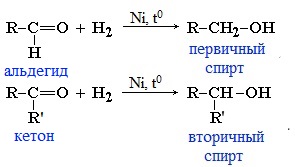
1. Гидрирование (восстановление)
Реакцию восстановления альдегидов и кетонов широко используют для получения спиртов. Присоединение водорода по кратной связи С=О происходит при нагревании в присутствии катализаторов (Ni, Pt, Pd).
В результате образуются спирты соответствующего строения. Гидрирование альдегидов приводит к образованию первичных спиртов, гидрирование кетонов – ко вторичным.
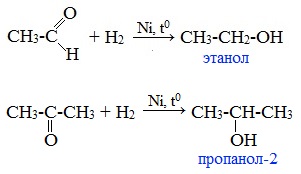
Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, а при гидрировании ацетона – пропанол-2:
В лабораторных условиях для восстановления альдегидов и кетонов используется алюмогидрид лития (тетрагидроалюминат лития) LiAlH4:
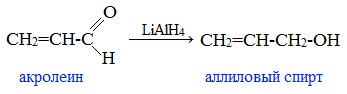
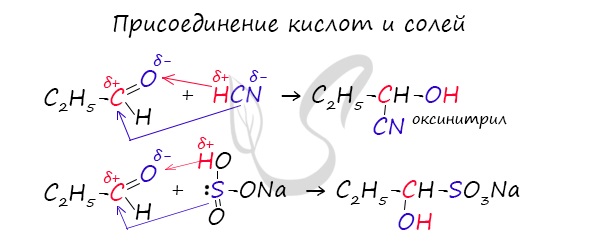
2. Присоединение циановодородной (синильной) кислоты НСN
Альдегиды и кетоны, взаимодействуя с синильной кислотой, образуют циангидрины – органические соединения, молекулы которых содержат две функциональные группы: циано-группу ![]() и гидроксильную –ОН.
и гидроксильную –ОН.
Присоединение идет в соответствии с распределением электронной плотности в молекулах:
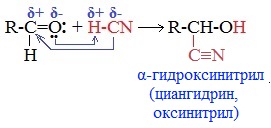
Образовавшееся соединение содержит на один атом углерода больше, чем исходный альдегид или кетон, поэтому подобные реакции используют для удлинения углеродной цепи. А также для получения α-гидроксикислот R-CH (COOH) OH:
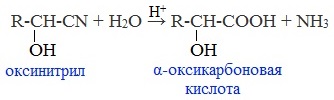
Циангидрин CH3— CH(CN) — OH — яд! Он содержится в ядрах косточек вишен, слив, персика.
Циангидрины используют как промежуточные соединения в синтезах окси- и аминокислот. Некоторые циангидрины встречаются в растениях. Употребление таких растений в пищу может привести к тяжелым отравлениям вследствие высвобождения синильной кислоты в организме.
3. Взаимодействие со спиртами (в присутствии кислоты или основания как катализатора)
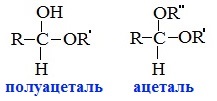
Альдегиды могут взаимодействовать с одной или двумя молекулами спирта, образуя соответственно полуацетали или ацетали.
Полуацетали — соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную (ОR) группы.
Ацетали – это соединения, содержащие при одном атоме углерода две алкоксильные группы.
Присоединение спиртов с образованием полуацеталей:
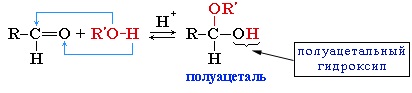
Например:
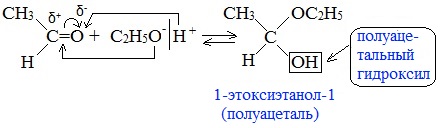
Гидроксильная группа полуацеталей (полуацетальный гидроксил) очень реакционноспособна. Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
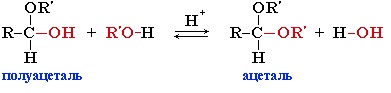
Например:
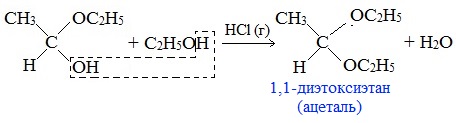
Ацетали обладают приятным цветочным ароматом. Именно образованием ацеталей обусловлен букет выдержанных вин.
Ацеталь, полученный из масляного альдегида и поливинилового спирта, используется в качестве клея при изготовлении безосколочных стекол.
Кетоны в этих условиях кетали не образуют.
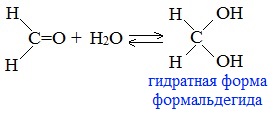
4. Гидратация (присоединение воды)
Альдегиды в водных растворах существуют в виде гидратных форм, образующихся в результате присоединения воды к карбонильной группе:

Эта реакция возможна только для формальдегида и уксусного альдегида.
Кетоны не реагируют с водой.
5. Присоединение реактива Гриньяра — образование спиртов
При добавлении раствора галогеналкана в диэтиловом эфире к магниевой стружке легко происходит экзотермическая реакция, магний переходит в раствор и образуется реактив Гриньяра.
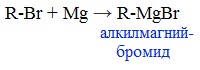
а) Взаимодействием реактива Гриньяра с формальдегидом можно получить первичный спирт (кроме метанола). Для этого продукт присоединения реактива Гриньяра гидролизуют с водой:
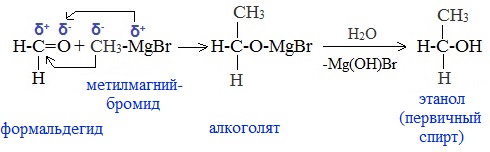
б) При использовании любых других алифатических альдегидов могут быть получены вторичные спирты:
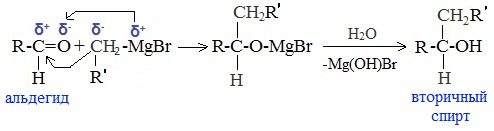
в) Взаимодействием реактивов Гриньяра с кетонами получают третичные спирты:
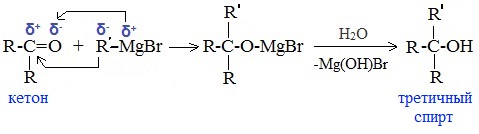
6. Присоединение гидросульфита натрия NaHSO3с образованием гидросульфитных производных альдегидов
Качественная реакция на альдегидную группу!
Альдегиды при встряхивании с концентрированным раствором гидросульфита натрия образуют кристаллические соединения:
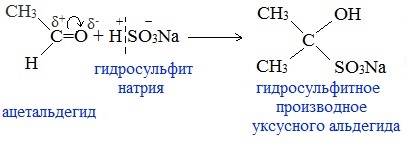
С помощью этой реакции выделяют альдегиды из смесей с другими веществами и для получения их в чистом виде.
7. Взаимодействие с аммиаком
При взаимодействии с аммиаком образуются имины: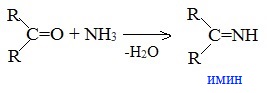
Реакции окисления
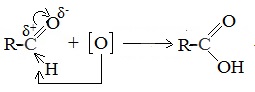
В молекулах альдегидов атом углерода карбонильной группы, имеющий избыточный положительный заряд, притягивает к себе электроны связи С-Н. Вследствие этого атом водорода приобретает большую реакционную активность, что проявляется в способности альдегидов к окислению.
Альдегиды легко окисляются в соответствующие карбоновые кислоты под действием таких мягких окислителей, как оксид серебра и гидроксид меди (II). Окисление происходит по связи С-Н в альдегидной группе –СН=О, которая превращается при этом в карбоксильную группу –С(ОН)=О.
1. Реакция «серебряного зеркала» – окисление аммиачным раствором оксида серебра (реактив Толленса)
Качественная реакция на альдегидную группу!
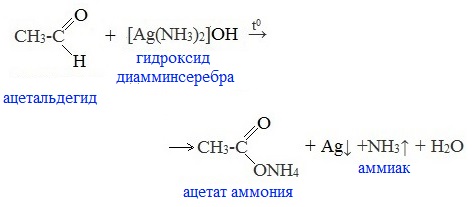
Металлическое серебро осаждается на стенках пробирки в виде тонкого слоя, образуя зеркальную поверхность.

Видеоопыт «Реакция «серебряного зеркала»
Реакцию «серебряного зеркала» широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
Кетоны не вступают в эту реакцию.
2. Окисление гидроксидом меди (II)
Качественная реакция на альдегидную группу!
Для реакции используют свежеприготовленный Cu (ОН)2, образующийся при взаимодействии растворимой соли меди (II) со щелочью.
Голубая суспензия гидроксида меди (II) при нагревании с альдегидом приобретает окраску оранжево-красного осадка оксида меди (I):![]()
Например:
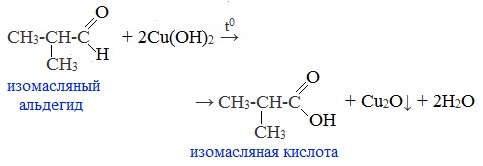
Альдегид окисляется до соответствующей ему карбоновой кислоты.

Видеоопыт «Качественная реакция на альдегиды с гидроксидом меди (II)»
Кетоны в эту реакцию не вступают.
3. Реакция на альдегиды с фуксиносернистой кислотой
Качественная реакция на альдегидную группу!
Краситель красного цвета — фуксин, при насыщении его раствора газообразным сернистым ангидридом (SO2) образует бесцветный раствор фуксиносернистой кислоты. Этот реактив при взаимодействии с альдегидами дает красно-фиолетовое окрашивание, что является качественной реакцией на альдегидную группу.

Видеоопыт «Качественная реакция на альдегиды с фуксинсернистой кислотой»
Кетоны не вступают в эту реакцию.
Кетоны окисляются с трудом лишь при действии более сильных окислителей и повышенной температуре. При этом происходит разрыв С–С-связей (соседних с карбонилом) и образование смеси карбоновых кислот с более короткой углеродной цепью: 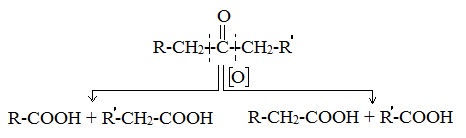
Например:
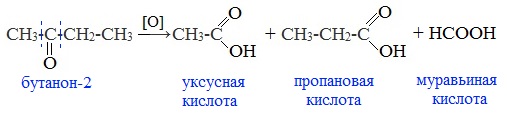
4. Окисление перманганатом калия
Альдегиды можно окислить подкисленным раствором перманганат калия КMnO4 при нагревании: 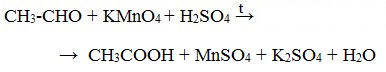
Происходит обесцвечивание раствора. Альдегидная группа окисляется до карбоксильной, т.е. альдегид окисляется до соответствующей ему карбоновой кислоты.
Муравьиный альдегид (формальдегид) окисляется до углекислого газа, потому что соответствующая ему муравьиная кислота неустойчива к действию сильных окислителей:![]()
Для кетонов эта реакция не имеет практического значения, так как происходит разрушение молекулы и в результате получается смесь продуктов.
5. Горение (полное окисление)
Альдегиды и кетоны сгорают до углекислого газа и воды:
![]()
Реакции замещения
1. α -Галогенирование
Альдегиды и кетоны легко вступают в реакцию с галогенами (Cl2, Br2, I2) с образованием ɑ-галогенпроизводных.
Такой эффект наблюдается только для ɑ-атома углерода, т.е атома, следующего за альдегидной группой, независимо от длины углеродного радикала.
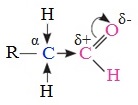
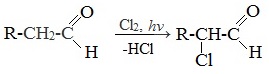
Галогенопроизводные альдегидов и кетонов проявляют слезоточивое действие и называются лакриматорами.
При избытке галогена замещению подвергаются все атомы водорода при ɑ-углеродном атоме:
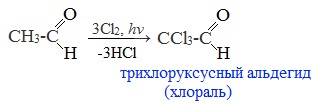
Хлораль обладает снотворным действием. На основе хлораля получают средства борьбы с насекомыми (инсектициды), в том числе хлорофос, а также различные гербициды.
При растворении хлораля в воде образуется хлоралгидрат ССl3CH (OH)2.
2. Галоформная реакция (иодоформная реакция, или проба Люголя)
Качественная реакция на метилкетоны и ацетальдегид!
Иодоформная реакция – обработка карбонильного соединения избытком иода в п?
