Какие свойства глицина проявляются в каждой из этих реакций

Опыт 1
Образование солей взаимодействием органических и неорганических оснований с кислотами и опыты с ними
В одной пробирке получите эмульсию анилина. (Смешайте 1—2 капли анилина с 1—2 мл воды.)
В другой пробирке получите гидроксид меди(П).
В обе пробирки добавляйте по каплям концентрированную соляную кислоту. Что наблюдаете?
К образовавшимся растворам солей добавляйте по каплям концентрированный раствор щелочи. Что наблюдаете?
Запишите уравнения проделанных реакций и сделайте выводы.
«Образование солей взаимодействием органических и неорганических оснований и кислотами и опыты с ними»
Выполнение работы:
Вывод: органические и неорганические основания и соли проявляют схожие свойства.
Опыт 2
Получение сложных эфиров взаимодействием органических и неорганических кислот со спиртами а) В пробирку налейте 2 мл изоамилового спирта, 2 мл концентрированной уксусной кислоты и 0,5—1 мл концентрированной серной кислоты (выдает учитель).
Смесь хорошо перемешайте и нагревайте (осторожно!) несколько минут на водяной бане (в стакане с горячей водой) до пожелтения жидкости (но не до кипения!).
Дайте смеси остыть, затем вылейте в пробирку с холодной водой или с насыщенным раствором поваренной соли: эфир соберется на поверхности. Отделите эфир с помощью делительной воронки. Какой ощущается запах?
Примечание. Оставьте полученный эфир для решения задачи IV в практической работе № 4. б) В фарфоровую чашечку поместите несколько кристалликов борной кислоты, добавьте 1 мл этилового спирта. Хорошо перемешайте смесь стеклянной палочкой. Поднесите к ней зажженную лучинку. Образовавшийся сложный эфир — триэтилборат сгорает красивым зеленым пламенем.
Запишите уравнения реакций, проделанных в опытах 2а и 26, сделайте выводы.
«Получение сложных эфиров взаимодействием органических и неорганических кислот со спиртами»
а) В пробирку налили немного изоамилового спирта и концентрированной уксусной кислоты и добавили чуть-чуть концентрированной серной кислоты. Смесь перемешали и нагрели на водяной бане. Наблюдаем пожелтение жидкости. Смесь остудили, эфир собрался на поверхности, ощущаем запах грушевой эссенции.

б) В фарфоровую чашку поместили несколько кристаллов борной кислоты и прибавили немного этилового спирта. Смесь перемешали и поднесли к ней зажженную лучинку. Образовавшееся вещество сгорело зеленым пламенем.
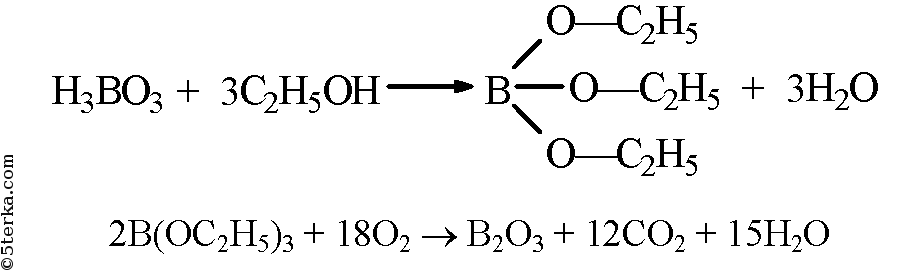
Вывод: органические и неорганические кислоты проявляют аналогичные химические свойства.
Опыт 3
Амфотерность гидроксида цинка и аминоуксусной кислоты а) В две пробирки налейте по 1 —2 мл раствора нитрата цинка и добавьте к нему 2—3 капли щелочи до образования осадка. В одну из пробирок прилейте соляной кислоты до растворения осадка, в другую — избыток раствора щелочи и наблюдайте растворение осадка. б) Налейте в пробирку 2—3 мл раствора карбоната натрия и всыпьте в него щепотку глицина. Что наблюдаете? Какие свойства глицина проявляются в этой реакции? Поместите в пробирку немного кристалликов глицина, смочите их каплями концентрированной соляной кислоты, нагрейте. Что наблюдаете? Вылейте несколько капель образовавшегося раствора на стекло. Наблюдайте образование при охлаждении кристаллов соли глицина. Сравните форму этих кристаллов с формой кристаллов глицина. Запишите уравнения реакций и выводы.
«Амфотерность гидроксида цинка и аминоуксусной кислоты»


Опыт 4
Сравнение свойств солей а) В две пробирки налейте по 2 мл растворов нитрата и ацетата свинца. Затем прилейте в обе пробирки по 1 мл раствора иодида калия. Что наблюдаете? б) В две пробирки налейте по 2 мл растворов сульфата ме-ди(II) и соли анилина. Затем добавьте в обе пробирки несколько капель концентрированного раствора щелочи. Что наблюдаете? Запишите уравнения проделанных реакций и сделайте выводы.
«Сравнение свойств солей» Выполнение работы:
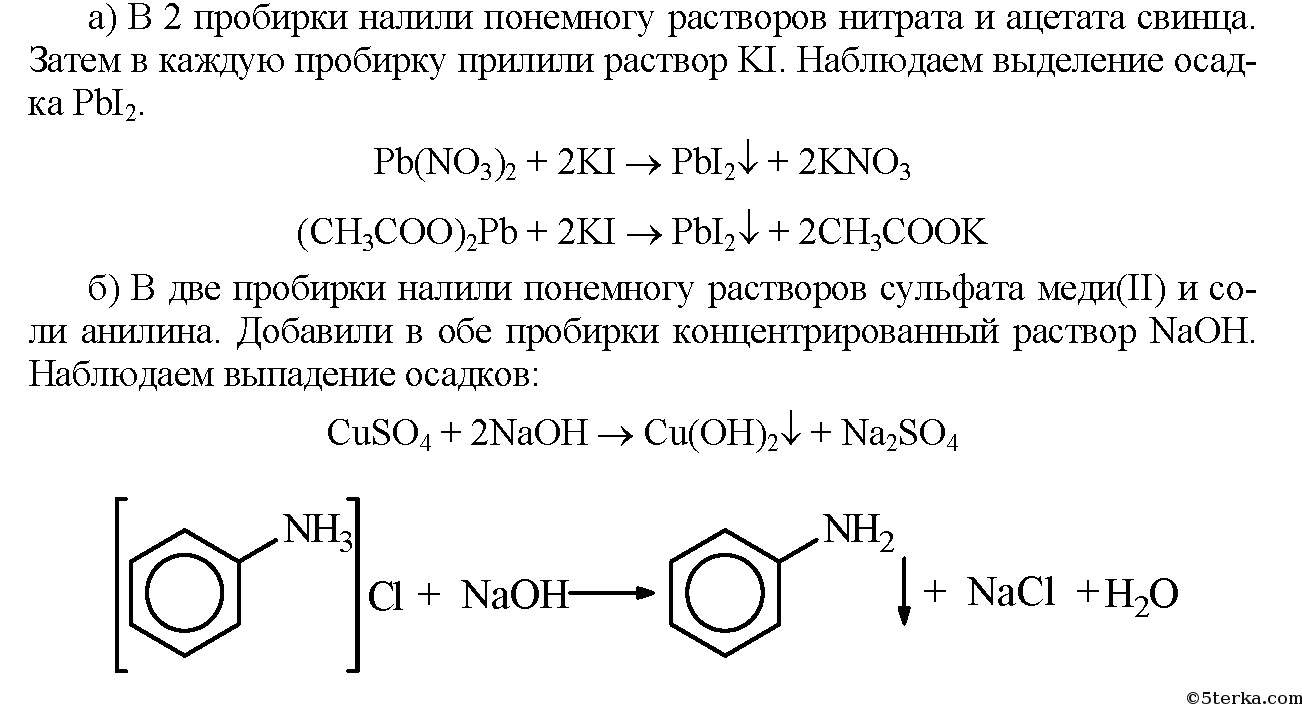
Вывод: соли органические и неорганические также проявляют схожие свойства.
Источник
Наш робот распознал:
Практическая работа ЛЬ 3. Сравнение свойств органических и неорганических соединений
Опыт I.
Образование солей взаимодействием органических н неорганических основания и кислотами и опыты с ними
Выполнение роботы.
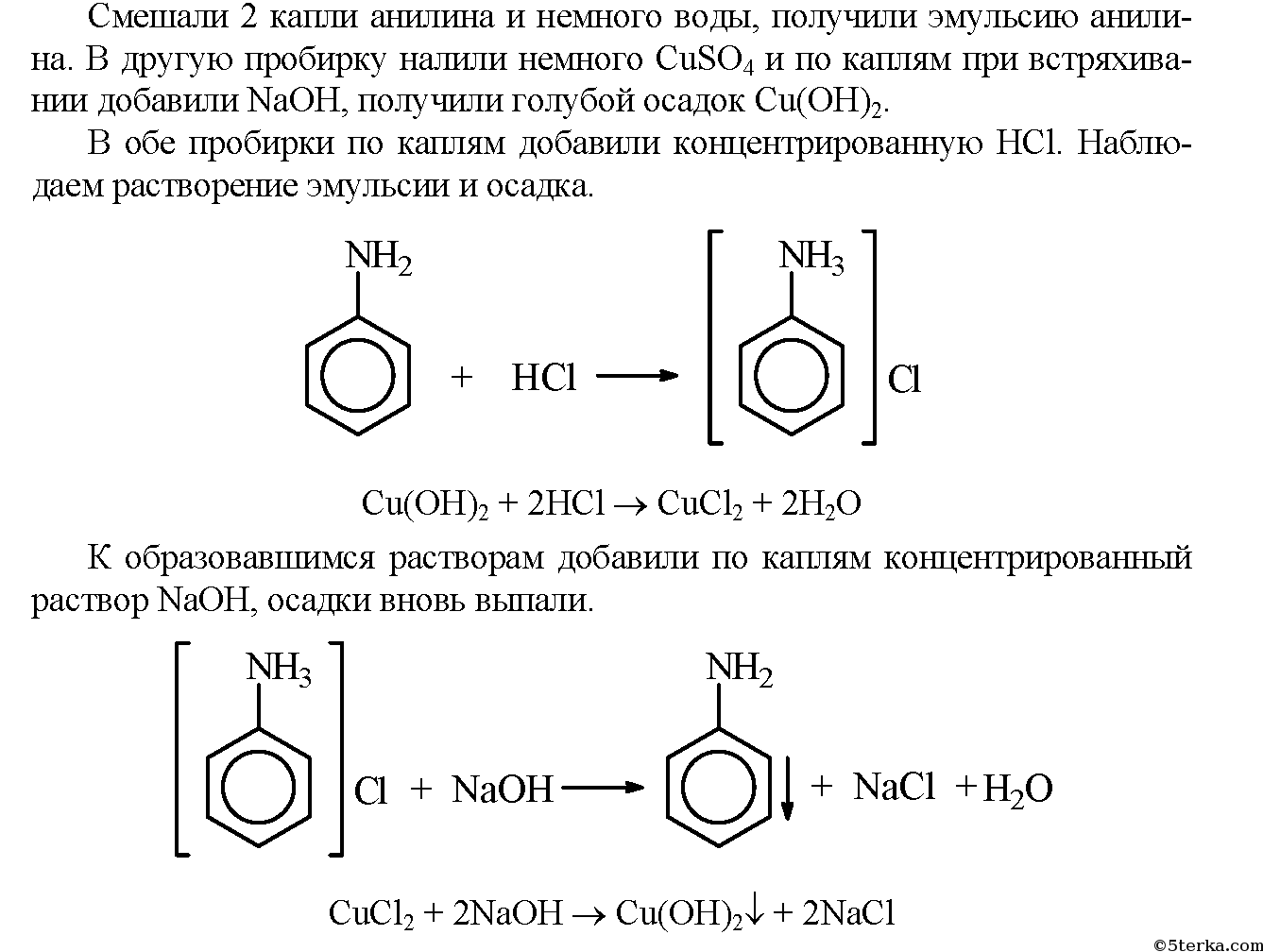
Смешали 2 капли анилина и немного воды, получили эмульсию анилина. В другую пробирку налили немного Си504 и по каплям при встряхивании добавили КаОН, получили голубой осадок СиОН:.
В обе пробирки по каплям добавили концентрированную ПС1. Наблюдаем растворение эмульсии и осадка.
+ на
СиОН2 – 2НС1 -> СиС1: 2Н;0
К образовавшимся растворам добавили по каплям концентрированный растпор КаОН осадки вновь выпали.
О + ЬаОИ—–> I + N31 +ИгО
ОиО, ЗНаОН -> Си
Опыт 2.
Получение сложных эфиров взаимодействием органических и неорганических кислот со спиртами
а В пробирку налили немного изоамилоаого спирта и концентрированной уксусной кислоты и добавили чуть-чуть концентрированной серной кислоты. Смесь перемешали и нагрели на водяной бане. Наблюдаем пожелтение жидкости. Смесь остудили, эфир собрался на поверхности, ощущаем залах грушевой эссенции.
Уу
сн3
ПН
ОН
СН
.О
> сн3-
ОСН,СН,СНСН,
I
СН3
б В фарфоровую чашку поместили несколько кристаллов борной кислоты и прибавили немного этилового спирта. Смесь перемешали и поднесли к ней зажженную лучнику. Образовавшееся вещество сгорело зеленым пламенем.
/о-н5 н3вОз+ эсуьон-во-сд + зн2о
ОСгН5
ЗДОСаОД + 18г В20, + 12С02 + 15П:0 Вывод: органические и неорганические кислоты проявляют анашгич-ные химические свойства
Опыт 3.
Амфотсрность гидроксида цинка и аминоуксусной кислоты
а В две пробирки налили немного раствора нитрата цинка и добавили к нему по каплям раствор ЫаОН. до выпадения осадка Затем в одну пробирку налили раствор НС1, а в другую раствор ОН. осадки растворились в обеих пробирках.
2пЖ32 + 2ЫаОН – 2пОН2-1 + 2г>03 2пОН2 + 2НС1 – 2пС12 + 2Н20
2пОН2 + 2NаОН -Ка:2пОН,
б В пробирку натилн немного раствора карбоната натрия и присыла в пробирку немного глицина. Наблюдаем выделение пузырьков газа СО;. Глицин проявляет свои кислотные свойства Поместили в пробирку несколько кристаллов глицина и смочили их концентрированной соляной кислотой. Пробирку нагрели. Наблюдаем растворение глицина. Поместили каплю полученного раствора на предметное стекло. При охлаждении наблюдаем образование кристаллов, отличных по форме от кристаллов глицина
2ОД-СН2-
—— 2ЫН2СН2С + Н20 + СО
0 /О
ш2-сн2-с + на – ноос-сн2ш,а он
Вывод: амфотерные соединения существуют и в органической и в неорганической химии и прояатяют схожие свойства
Опыт 4.
Сравнение свойств солей
Выполнение роботы:
и В 2 пробирки налили понемногу растворов нитрата и ацетата свинца. Зитсм в каждую пробирку прилили раствор К1. Наблюдаем выделение осадка РМ2.
РЪШ,2 + 2К1 -> РЫг1 + 2КШ,
ОДСООРЪ + 2К1 -> РЫ21 + 2СН,СООК
б В две пробирки катили понемногу растворов сульфата мсдиН к соли анилина Добавили в обе пробирки концентрированный раствор КаОН. Наблюдаем выпадение осатков:
Си04 + 2ЫаОН -ОиЮНЬХ N8,50,
N11
ЫН2
а + каон ОТ I+ С Ч0
Вывод: соли органические и неорганнчесхне также проявляют схожие свойства
Источник
Глицин — является одной из заменимых аминокислот, входящих в состав белков и других биологически активных веществ в организме человека.
Глицин был назван так за сладкий вкус (от греческого glykos — сладкий).
Глицин (гликокол, аминоуксусная кислота, аминоэтановая кислота).
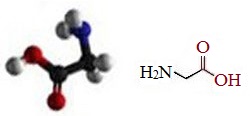
Глицин (Гли, Gly, G) имеет строение NH2-CH2-COOH.
Глицин оптически неактивен, так как в структуре отсутствует асимметрический атом углерода.
Глицин впервые выделен Braconnot в 1820 г. из кислотного гидролизата желатина.
Суточная потребность в глицине составляет 3 грамма.
Физические свойства
Глицин – бесцветные кристаллы сладкого вкуса с температурой плавления 232-236°С (с разл.), хорошо растворяется в воде, нерастворим в спирте и эфире, ацетоне.
Химические свойства
Глицин обладает общими и специфическими свойствами, присущими аминокислотам, обусловленными наличием в их структуре амино- и карбоксильной функциональных групп: образование внутренних солей в водных растворах, образование солей с активными металлами, оксидами, гидроксидами металлов, хлороводородной кислотой, ацилирование, алкилирование, дезаминирование по аминогруппе, образование галагенангидридов, сложных эфиров, декарбоксилирование по карбоксильной группе.
Основным источником глицина в организме служит заменимая аминокислота серин. Реакция превращения серина в глицин легко обратима.
Биологическая роль
Глицин необходим не только для биосинтеза белка и глюкозы (при ее недостатке в клетках), но и гема, нуклеотидов, креатина, глутатиона, сложных липидов и других важных соединений.
Важна роль производного глицина – трипептида глутатиона.
Он является антиоксидантом, препятствует пероксидному
окислению липидов клеточных мембран и предотвращает их повреждение.
Глицин участвует в синтезе компонентов клеточных мембран.
Глицин относится к тормозным нейромедиаторам. Этот эффект глицина сильнее выражен на уровне спинного мозга.
Успокаивающий эффект глицина основан на усилении процессов активного внутреннего торможения, а не на подавлении физиологической активности.
Глицин защищает клетку от стресса. Успокаивающий эффект при этом проявляется в уменьшении раздражительности, агрессивности, конфликтности.
Глицин увеличивает электрическую активность одновременно в лобных и затылочных отделах головного мозга, повышает внимание, увеличивает скорость счетновычислительных и психофизиологических реакций.
Применение глицина по схеме в течение 1,5 – 2 месяцев приводит к снижению и стабилизации артериального давления, исчезновению головной боли, улучшению памяти, нормализации сна.
Применение глицина позволяет предупредить вызванную гентамицином почечную недостаточность, оказывает положительное влияние на структурные изменения в почках, предупреждает развитие окислительного стресса и снижает активность антиоксидантных ферментов.
Глицин уменьшает токсическое действие алкоголя. Это связано и с тем, что образующийся в печени ацетальдегид (токсичный продукт окисления этанола) соединяется с глицином, превращаясь в ацетилглицин – полезное соединение, используемое организмом для синтеза белков, гормонов, ферментов.
Нормализуя работу нервной системы, глицин снижает патологическое влечение в выпивке. Им профессионально лечат хронических алкоголиков, назначают для прерывания запоя и профилактики «белой горячки».
Глицин уменьшает случаи возникновения токсикозов при беременности, угрозу выкидышей, несвоевременное отхождение вод, асфиксию плода.
У женщин на фоне приема глицина реже рождались дети с врожденной гипотрофией, не было новорожденных с родовыми травмами и поражениями тканевых структур головного мозга, множественными врожденными пороками развития, отсутствовала смертность новорожденных.
Природные источники
Говядина, желатин, рыба, печень трески, яйцо куриное, творог, арахис.
Области применения
Очень часто глицин применяют для лечения детских заболеваний. Применение глицина дает положительный эффект при лечении вегето-сосудистой дистонии, у детей с психосоматическими и невротическими нарушениями, при острой ишемии головного мозга, при эпилепсии.
Применение глицина у детей повышает концентрацию внимания, снижает уровень личностной тревожности.
Применяется глицин также для профилактики ранней алкоголизации и накотизации подростков.
Лекарственный препарат «Глицин»
Глицин применяется при астенических состояниях, для повышения умственной работоспособности (улучшает умственные процессы, способность воспринимать и запоминать информацию), при психоэмоциональном напряжении, повышенной раздражительности, при депрессивных состояниях, для нормализации сна.
Как средство, уменьшающее тягу к алкоголю, при разных функциональных и органических заболеваниях нервной системы (нарушения мозгового кровообращения, инфекционные заболевания нервной системы, последствия перенесенных черепно-мозговых травм).
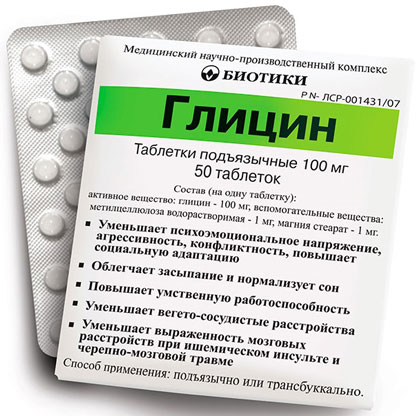
Применяется препарат под язык, т.к. в области ядра подъязычного нерва плотность глициновых рецепторов наибольшая, а следовательно, чувствительность в этой области к воздействию глицина максимальна.
Физиологической активностью обладает также производное глицина – Бетаин (триметилглицин).
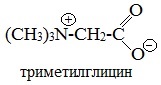
Бетаины распространены в животном и растительном мире. Они содержатся в свекле, представителях семейства губоцветных.
Бетаин гликокола и его соли широко применяется в медицине и сельском хозяйстве.
Триметилглицин участвует в процессах обмена живых организмов и наряду с холином используется для профилактики заболеваний печени, почек.
Аминокислоты
Классификация аминокислот
Источник
Условие задачи полностью выглядит так:
Практическая работа № 3. Сравнение свойств органических и неорганических соединений
опыт 1
образование солей взаимодействием органических и неорганических оснований с кислотами и опыты с ними
в одной пробирке получите эмульсию анилина. (смешайте 1—2 капли анилина с 1—2 мл воды.)
в другой пробирке получите гидроксид меди(п).
в обе пробирки добавляйте по каплям концентрированную соляную кислоту. что наблюдаете?
к образовавшимся растворам солей добавляйте по каплям концентрированный раствор щелочи. что наблюдаете?
запишите уравнения проделанных реакций и сделайте выводы.
«образование солей взаимодействием органических и неорганических оснований и кислотами и опыты с ними»
выполнение работы:

вывод: органические и неорганические основания и соли проявляют схожие свойства.
опыт 2
получение сложных эфиров взаимодействием органических и неорганических кислот со спиртами а) в пробирку налейте 2 мл изоамилового спирта, 2 мл концентрированной уксусной кислоты и 0,5—1 мл концентрированной серной кислоты (выдает учитель).
смесь хорошо перемешайте и нагревайте (осторожно!) несколько минут на водяной бане (в стакане с горячей водой) до пожелтения жидкости (но не до кипения!).
дайте смеси остыть, затем вылейте в пробирку с холодной водой или с насыщенным раствором поваренной соли: эфир соберется на поверхности. отделите эфир с помощью делительной воронки. какой ощущается запах?
примечание. оставьте полученный эфир для решения задачи iv в практической работе № 4. б) в фарфоровую чашечку поместите несколько кристалликов борной кислоты, добавьте 1 мл этилового спирта. хорошо перемешайте смесь стеклянной палочкой. поднесите к ней зажженную лучинку. образовавшийся сложный эфир — триэтилборат сгорает красивым зеленым пламенем.
запишите уравнения реакций, проделанных в опытах 2а и 26, сделайте выводы.
«получение сложных эфиров взаимодействием органических и неорганических кислот со спиртами»
а) в пробирку налили немного изоамилового спирта и концентрированной уксусной кислоты и добавили чуть-чуть концентрированной серной кислоты. смесь перемешали и нагрели на водяной бане. наблюдаем пожелтение жидкости. смесь остудили, эфир собрался на поверхности, ощущаем запах грушевой эссенции.

б) в фарфоровую чашку поместили несколько кристаллов борной кислоты и прибавили немного этилового спирта. смесь перемешали и поднесли к ней зажженную лучинку. образовавшееся вещество сгорело зеленым пламенем.

вывод: органические и неорганические кислоты проявляют аналогичные химические свойства.
опыт 3
амфотерность гидроксида цинка и аминоуксусной кислоты а) в две пробирки налейте по 1 —2 мл раствора нитрата цинка и добавьте к нему 2—3 капли щелочи до образования осадка. в одну из пробирок прилейте соляной кислоты до растворения осадка, в другую — избыток раствора щелочи и наблюдайте растворение осадка. б) налейте в пробирку 2—3 мл раствора карбоната натрия и всыпьте в него щепотку глицина. что наблюдаете? какие свойства глицина проявляются в этой реакции? поместите в пробирку немного кристалликов глицина, смочите их каплями концентрированной соляной кислоты, нагрейте. что наблюдаете? вылейте несколько капель образовавшегося раствора на стекло. наблюдайте образование при охлаждении кристаллов соли глицина. сравните форму этих кристаллов с формой кристаллов глицина. запишите уравнения реакций и выводы.
«амфотерность гидроксида цинка и аминоуксусной кислоты»


опыт 4
сравнение свойств солей а) в две пробирки налейте по 2 мл растворов нитрата и ацетата свинца. затем прилейте в обе пробирки по 1 мл раствора иодида калия. что наблюдаете? б) в две пробирки налейте по 2 мл растворов сульфата ме-ди(ii) и соли анилина. затем добавьте в обе пробирки несколько капель концентрированного раствора щелочи. что наблюдаете? запишите уравнения проделанных реакций и сделайте выводы.
«сравнение свойств солей» выполнение работы:

вывод: соли органические и неорганические также проявляют схожие свойства.
Задача из главы Практические и лабораторные работы по предмету Химия из задачника Химия 11, Габриелян (11 класс)
Если к данной задачи нет решения – не переживайте. Наши администраторы стараются дополнять сайт решениями для тех задач
и упражнения где это требуется и которые не даны в решебниках и сборниках с ГДЗ. Попробуйте зайти позже. Вероятно, вы найдете то, что искали 🙂
Рады приветствовать учеников всех учебных заведений всех возрастов на нашем сайте!
Здесь вы найдете решебники и решения задач бесплатно, без регистрации.
davay5.com
Источник
Кислотно-основные свойства аминокислот могут быть выражены обычными уравнениями диссоциации вещества как кислоты и как основания, с отвечающими им константами. Например, для глицина [c.207]
Важный класс амфолитов составляют простейшие аминокислоты. Их кислотно-основные свойства обусловлены одновременным присутствием в молекуле функциональных групп, обладающих кислотным и основным характером. В водном растворе типичной аминокислоты, например глицина, устанавливаются три важных равновесия [c.258]
Амфотерные электролиты (амфолиты). Это слабые электролиты, способные проявлять свойства как слабых кислот, так и слабых оснований в зависимости от природы вещества, с которым они вступают в кислотно-основную реакцию. Один и тот же амфолит, взаимодействуя с сильной кислотой, реагирует как слабое основание, а в реакции с сильным основанием ведет себя как слабая кислота. Амфотерными электролитами являются гидроксиды некоторых металлов, например Ве(0Н)2, гп(0Н)2, РЬ(0Н>2, А1(0Н)з, Ге(ОН)з, Сг(ОН)з, 8п(ОН)2, и а-аминокислоты, например глицин СН2(МН2)СООН и аланин СНзСН(КН2)СООН. Вода, которая способна как присоединять протоны, так и отщеплять их, также относится к амфолитам. [c.87]
Три важных фактора — индуктивный эффект, эффект поля и резонансный эффект — могут сильно влиять на поведение органических кислот и оснований, включая и биологически важные а-аминокислоты. В водном растворе, обычной среде нротекания биологических реакций, эти эффекты обусловливают большое разнообразие свойств, так что процессы диссоциации могут происходить во всем диапазоне pH. Это валпринимать участие в кислотно-основных превращениях. Действительно, в упрощенном виде диссоциацию аминокислот можно рассматривать как миниатюрную модель диссоциации белка. В биохимических реакциях важные функции выполняют белки, и аналогия с аминокислотами может слу кить основой для понимания процессов передачи протонов. Однако такая модель слишком упрощена. Она не учитывает кооперативные взаимодействия. Например, как поведет себя лизин при диссоциации под действием линейно-расположенных положительно заряженных аминокислотных остатков, входящих в состав белка Далее, каким образом близко расположенная гидрофобная область белковой молекулы (т. е. область с более Ш13-кой диэлектрической проницаемостью) влияет на ее диссоциацию в данном химическом процессе То, что в этом случае можно ожидать значительных изменений, видно из поведения глицина при диссоциации в среде с низкой диэлектрической проницаемостью например, в 95%-ном этаноле (рКа карбоксильной группы глицина равен 3,8, а аминогруппы 10,0). Можно было бы подумать, что в этом случае но кислотности глицин близок к уксусной кислоте, но это не так, поскольку для последней р/( равен 7,1. [c.42]
Какие свойства проявляют эфиры аминокислот нейтральные, кислотные или основные Напишите уравнения реакций, характеризующие эти свойства этилового эфира глицина. [c.100]
Белки — полимеры аминокислот — являются полиэлектролитами. У макромолекулы белка много диссоциирующих кислотных и основных групп с различными значениями р/(. Так, например у р-лактоглобулина найдено ПО титрующихся групп на моль белка, т. е. приблизительно 7з аминокислотных остатков этого белка имеют ионную форму. В отличие от кривой титрования глицина, на которой имеются два перегиба в области pH = p/(i и рН = рК2, кривые титрования белков должны иметь множество перегибов. Большое количество перегибов на кривой титрования свидетельствует о том, что буферные свойства белков проявляются в широком диапазоне pH. [c.34]
Простейшей аминокислотой является аминоуксусная (NH2 H2 OOH), т. н. глицин. Он представляет собой бесцветное кристаллическое вещество, легко растворимое в воде. Кислотные свойства глицина выражены очень слабо (/основных свойств выявляется при взаимодействии с водой ОН2 + NH H2 00H ОН + НЫНгСН СООН. Выражены эти свойства еще слабее кислотных (К = 3-10 ). Присоединение ряда молекул глицина друг к другу с отщеплением воды по схеме [c.319]
Все ферменты являются белками. Белки представляют собой линейные полимеры, точнее, сополимеры, построенные из связанных между собой остатков аминокислот. В состав большинства белков входят 20 важнейших аминокислот — глицин, аланин, валин, лейцин, изолейцин, аспарагиновая кислота, глутаминовая кислота, серин, треонин, лизин, аргинин, гистидин, фенилаланин, тирозин, триптофан, цистеин, цистин, метионин, пролин и оксипролин их химические формулы и обозначения приведены в таблице на стр. 5. Молекула каждой аминокислоты (1) достаточно проста и обязательно содержит две реакционноспособные группировки — одну, обладающую основными свойствами (аминогруппа HgN—) и другую, имеющую кислотные, свойства (карбоксильная группа — СООН), f. f. [c.39]
Наряду с кислотно-основными свойствами аминокислот важное значение для биохимии имеют гидрофобные свойства боковых радикалов аминокислот, поскольку гидрофобные взаимодействия оказывают сильное влияние на формирование и стабилизацию белковых макромолекул. Гидрофобность, как правило, характеризуют изменением свободной энергии переноса растворенного вещества из воды в неполярный органический растворитель (например, диоксан). Следовательно, если определить гидрофобность каждой аминокислоты, а затем вычесть из нее гидро-фобность глицина — простейшей аминокислоты, образующей единицу звеньев с пептидными связями, — то можно получить характеристику гидрофобности каждого из боковых радикалов аминокислот. Гидрофобность боковых радикалов для разных аминокислот в среднем составляет около -100 кДж/моль. [c.48]
Если кислотные и основные свойства участвующих в реакции со щелочью функциональных групп амфолитов характеризуются рКа, + рК у) = 12—16, реакции вытеснения и нейтрализации протекают параллельно, и дифференцированное титрование функциональных групп невозможно. Примером может служить кривая титрования смеси цистеина и глицина (рис. 1, 18). Эта кривая не имеет излома при переходе от реакции вытеснения к реакции нейтрализации, так как сумма р/Св глицина, взаимодействием с которым заканчиваются реакции вытеснения, и р/Са (НЗ) равна 14,52. [c.142]
В динамических условиях ход процесса аналогичен изложенному выше для соли с глицин-анионом на катионите. Следует заметить, что кислотные свойства нейтральных аминокислот выражены несколько сильнее, чем основные (для глицина рКд = Ю), что выражается в величинах р1 менее 7. [c.149]
Несомненно, что основные и кислотные свойства окисей зависят не от одного количества атомов кислорода в окиси, а также и от свойств элемента, чему ясное подтверждение мы видели выше, излагая сущность закона периодичности. Элемент с атомным весом около 235, следующий за торием (двенадцатый ряд) , даже в своей окиси К 0 должен быть основным. Потому многие формулы окислов, особенно редких, мало исследованных элементов лишены ныне оснований. Сюда относятся особенно [иг] 1п, 11г, Се, Ьа, В1, УЬ, Ег. Подлинных случаев изоморфизма для них не наблюдалось, а если и есть некоторые отрывочные факты, то на них, как на изоморфизм, окисей циркония и бериллия [глицины] с глиноземом, нельзя основывать прочных суждений. Должно заметить вообще, что изоморфизм есть слабая опора для суждения об атомном составе, как видно из явлений гетероморфизма (Лоран, Дана) и из явлений, наблюденных [он скорее подтвер.] Мариньяком. Пе отвлекаясь теперь в эту обширную и весьма еще запутанную область, замечу, что и теплоемкость не только сложных, но и простых тел дает не всегда резкие результаты, а потому для суждения об атомном весе остается только два прочных критерия оиределение плотности паров многих соединений данного элемента и потом чисто химические критерии, основанные на сличении состава разных форм окисления, на открытии аналогий с хорошо известными элементами и т. п. [прочие указания [c.400]
Амфотерные свойства аминокислот. Аминокислоты функционируют и как слабые кислоты, и как слабые основания, так как они содержат по меньшей мере одну карбоксильную и одну аминную группы. Вещества, которые в водных растворах функционируют как кислоты и как щелочи, называются амфотерными. Примером таких соединений может служить глицин, у которого в водном растворе и кислотная и основная группы образуют биполярные ионы, или цвиттер-ионы [c.316]
Простейшей аминокислотой является аминоуксусная (иначе глицин, или гликокол) — ЫНгСНгСООН. Она представляет собой бесцветное кристаллическое вещество, легкорастворимое в воде. Кислотные свойства глицина выражены лишь очень слабо (/С = 2-10″ ). Наличие у него основных свойств выявляется при взаимодействии с водой ОНг 4- ЫНзСНгСООН ОН НЫИгСНгСООН. Выражены эти свойства еще слабее кислотных К = 3 -10 ). Изоэлектрическая точка глицина лежит при pH = 6,2. [c.566]
Частицу аминокислоты, несущую одновременно и положительный, и отрицательный заряды [уравнение (10-19)], называют цвит-тер-ионом. Из величин констант равновесия (10-20) и (10-21) следует, что кислотные свойства цвиттер-иона глицина выражены сильнее, чем основные свойства, и поэтому раствор глицина имеет слабо кислую реакцию. [c.258]
Аминоуксусная кислота (глицин) H2N H2 OOH имеет биполярное строение НзМ” H2 OO . Кислотные свойства кислоты выражены значительно сильнее, чем основные (рК = 2,35 рК = 9,88). [c.213]
Основы органической химии 2 Издание 2 (1978) — [
c.105
,
c.106
]
Основы органической химии Ч 2 (1968) — [
c.63
,
c.64
]
Источник
