Какие свойства глицерин проявляет в реакции с гидроксидом меди
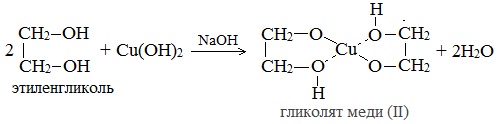
Многоатомные спирты по химическим свойствам сходны с одноатомными спиртами. Однако в химических свойствах многоатомных спиртов есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп.
Если в многоатомных спиртах ОН-группы находятся при соседних атомах углерода, то вследствие взаимного влияния этих групп (–I-эффект одной ОН-группы по отношению к другой), разрыв связи О-Н происходит легче, чем в одноатомных спиртах.
Кислотные свойства
1. С щелочными металлами
Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов (-I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты. Они образуют соли не только в реакциях с активными металлами, но и под действием их гидроксидов.
Видеоопыт «Взаимодействие глицерина с металлическим натрием»
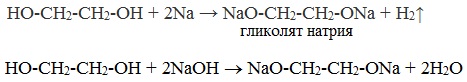
2. С гидроксидом меди(II) — качественная реакция!
Наличие нескольких ОН-групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов (например, с гидроксидом меди (II) Cu (OH)2).
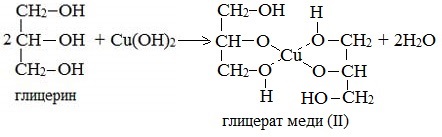
Продуктами этих реакций являются комплексные («хелатные») соединения, в молекулах которых атом тяжелого металла образует как обычные ковалентные связи Ме–О за счет замещения атомов водорода ОН-групп, так и донорно-акцепторные связи Ме←О за счет неподеленных пар атомов кислорода других ОН-групп.
При взаимодействии многоатомного спирта с гидроксидом меди (II) в щелочной среде образуется темно-синий раствор (гликолят меди и глицерат меди). Эта реакция является качественной реакцией на многоатомные спирты.
Видеоопыт «Взаимодействие многоатомных спиртов с гидроксидом меди (II)»
Гликолят меди
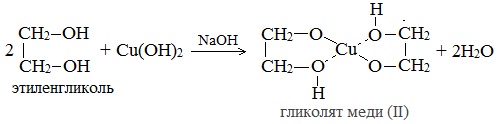
Глицерат меди
Упрощенная схема
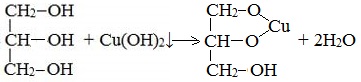
По аналогии с алкоголятами соли двухатомных спиртов называются гликолятами, а трехатомных — глицератами.
Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам (не проявляется взаимное влияние групп ОН).
Основные свойства
1. С галогенводородными кислотами
При взаимодействии этиленгликоля с галогеноводородами (НСl, HBr) одна гидроксильная группа замещается на галоген:
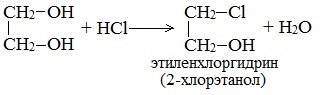
Вторая гидроксогруппа замещается труднее, под действием РСl5.
2. Реакция этерификации (с органическими и неорганическими кислотами)
Многоатомные спирты взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров.
С карбоновыми кислотами глицерин образует сложные эфиры – жиры и масла.
При взаимодействии глицерина с азотной кислотой в присутствии концентрированной серной кислоты образуется нитроглицерин (тринитрат глицерина):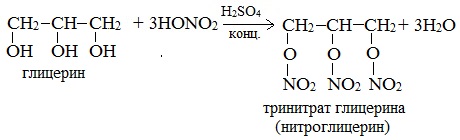
Тринитрат глицерина (тривиальное название – нитроглицерин) – тяжелая маслянистая жидкость, известное взрывчатое вещество (взрывается от легкого сотрясения и нагревания). И одновременно лекарственный препарат (спиртовые растворы его не взрываются): 1% спиртовой раствор нитроглицерина применяется в медицине в качестве средства расширяющего сосуды сердца.
3. Окисление
Видеоопыт «Взаимодействие глицерина с кристаллическим перманганатом калия»
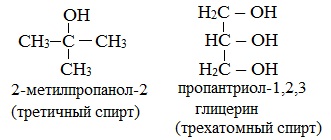
Какая разница между третичным и трехатомным спиртом?
Третичным называется спирт, в котором функциональная группа -ОН связана с третичным атомом углерода. Трехатомным называют спирт, в котором имеется три функциональных группы – ОН.
Многоатомные спирты
Источник
Многоатомные спирты– органические соединения, в молекулах которых содержится несколько
гидроксильных групп (-ОН), соединённых с углеводородным радикалом
Гликоли (диолы)
Этиленгликоль | ||
Формула | Модели | |
шаростержневая | полусферическая | |
HO-CH2CH2-OH | ||
- Сиропообразная, вязкая бесцветная жидкость,
имеет спиртовой запах, хорошо смешивается с водой, сильно понижает температуру
замерзания воды (60%-ый раствор
замерзает при -49 ˚С) –это используется в системах охлаждения двигателей –
антифризы. - Этиленгликоль токсичен – сильный Яд!
Угнетает ЦНС и поражает почки.
Триолы
Глицерин (пропантриол-1,2,3) | ||
Формула | Модели | |
шаростержневая | полусферическая | |
HOCH2-СH(OH)-CH2OH | ||
- Бесцветная,
вязкая сиропообразная жидкость, сладкая на вкус. Не ядовит. Без запаха. Хорошо
смешивается с водой. - Распространён в
живой природе. Играет важную роль в обменных процессах, так как входит в состав
жиров (липидов) животных и растительных тканей.
Номенклатура
В названиях
многоатомных спиртов (полиолов) положение и число гидроксильных групп
указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол
(три ОН-группы) и т.д. Например:
Получение многоатомных спиртов
I.
Получение двухатомных спиртов
В промышленности
1. Каталитическая гидратация оксида этилена
(получение этиленгликоля):
2. Взаимодействие дигалогенпроизводных алканов
с водными растворами щелочей:
3. Из синтез-газа:
2CO + 3H2 250°,200МПа,kat → CH2(OH)-CH2(OH)
В
лаборатории
1. Окисление алкенов:
II. Получение трёхатомных спиртов
(глицерина)
В промышленности
Омыление жиров
(триглицеридов):
Химические свойства многоатомных спиртов
Кислотные свойства
1. С активными металлами:
HO-CH2-CH2-OH
+ 2Na → H2↑+ NaO-CH2-CH2-ONa (гликолят натрия)
2. С гидроксидом меди(II) – качественная реакция!

Упрощённая
схема
Основные свойства
1. С галогенводородными кислотами
HO-CH2-CH2-OH
+ 2HCl H+↔ Cl-CH2-CH2-Cl + 2H2O
2. Сазотнойкислотой

Тринитроглицерин – основа
динамита
Применение
- Этиленгликоль производства
лавсана, пластмасс, и для приготовления антифризов
— водных растворов, замерзающих значительно ниже 0°С (использование их для
охлаждения двигателей позволяет автомобилям работать в зимнее время); сырьё в
органическом синтезе. - Глицерин широко
используется в кожевенной, текстильной промышленности при отделке кож и тканей
и в других областях народного хозяйства. Сорбит (шестиатомный
спирт) используется как заменитель сахара для больных диабетом. Глицерин находит широкое применение в
косметике, пищевой промышленности, фармакологии,
производстве взрывчатых веществ. Чистый нитроглицерин взрывается
даже при слабом ударе; он служит сырьем для получения бездымных порохов и
динамита ― взрывчатого вещества, которое в отличие от
нитроглицерина можно безопасно бросать. Динамит был изобретен Нобелем, который
основал известную всему миру Нобелевскую премию за выдающиеся научные
достижения в области физики, химии, медицины и экономики. Нитроглицерин
токсичен, но в малых количествах служит лекарством, так как расширяет
сердечные сосуды и тем самым улучшает кровоснабжение сердечной мышцы.
Видео-опыты:
Изучение физических свойст глицерина
Взаимодействие глицерина с металлическим натрием
Взаимодействие многоатомных спиртов с гидроксидом меди (II)
Взаимодействие глицерина с перманганатом калия
Дополнительно
Источник
Кислотные свойства, то есть способность отщеплять протон H+H+, у глицерина выражены сильнее, чем у одно- и двух атомных спиртов. Поэтому глицерин достаточно легко вступает в химическое взаимодействие с щелочными металлами и щелочами, образуя соли – глицераты (подобно этиленгликолю и этиловому спирту):
С активными металлами
2. С щелочами и основаниями
3. C гидроксидом меди (II)глицерин дает прозрачный ярко-синий раствор за счет образования хелатного комплексного соединения.
Эта реакция является качественной реакцией на многоатомные спирты, поскольку для образования хелатного комплекса нужно как минимум две гидроксильные группы. Аналогичный комплекс образует и глюкоза, которая содержит в своем составе шесть гидроксильных групп.
4. С неорганическими сильными кислотами проявляет основные свойства. Так, при взаимодействии со смесью концентрированных серной и азотной кислот образуется тринитроглицерин
Тринитрат глицерина токсическое, взрывоопасное вещество. В малых концентрациях используется как лекарственное средство для расширения сосудов.
А при взаимодействии с соляной кислотой происходит замещение гидроксильных групп на атомы хлора с образованием трихлоргидрина:
5.C органическими кислотами образует сложные эфиры:
Могут получаться моно-, ди- и триглицериды, причем радикалы кислот могут быть разными.
Применение спиртов в промышленности
Этанол — основа алкогольных напитков. Его получают из сахарной свеклы, картофеля, винограда, злаковых культур — ржи, пшеницы, ячменя, другого сырья, содержащего сахар или крахмал. В процессе производства применяются современные технологии очистки от сивушных масел.
Содержание этилового спирта — основа классификации алкогольных напитков.
Этанол является сырьем для натурального уксуса. Продукт получается при окислении уксуснокислыми бактериями. Аэрирование (принудительное насыщение воздухом) — необходимое условие процесса.
Этанол в пищевой промышленности не единственный спирт. Глицерин — пищевая добавка Е422 — обеспечивает соединение несмешиваемых жидкостей. Его используют при изготовлении кондитерских, макаронных, хлебобулочных изделий. Глицерин входит в состав ликеров, придает напиткам вязкость, сладкий вкус.
Распространено использование спиртов как сахарозаменителей. Для этого по свойствам подходят маннит, ксилит, сорбит.
Парфюмерия и косметика
Вода, спирт, парфюмерная композиция (концентрат) — основные компоненты парфюмерных продуктов. Они используются в разных пропорциях. Таблица представляет виды парфюмерных изделий, пропорции главных составных частей.
В производстве парфюмерной продукции этанол высшей очистки выступает растворителем душистых веществ. При реакции с водой образуются соли, которые выпадают в осадок. Раствор несколько дней отстаивается и фильтруется.
2-фенилэтанол в парфюмерной и косметической промышленности заменяет натуральное розовое масло. Жидкость обладает легким цветочным запахом. Входит в состав фантазийных и цветочных композиций, косметического молочка, кремов, эликсиров, лосьонов.
Основной базой многих средств по уходу является глицерин. Он способен притягивать влагу, активно увлажнять кожу, делать ее эластичной. Сухой, обезвоженной коже полезны крема, маски, мыла с глицерином: он создает на поверхности влагосберегающую пленку, сохраняет мягкость кожного покрова.
Существует миф: что использование спирта в косметике вредно. Однако эти органические соединения — необходимые для производства продукции стабилизаторы, носители активных веществ, эмульгаторы.
Спирты (особенно жирные) делают средства по уходу кремообразными, смягчают кожу и волосы. Этанол в шампунях и кондиционерах увлажняет, быстро испаряется после мытья головы, облегчает расчесывание, укладку.
Медицина
Этанол в медицинской практике используют как антисептик. Он уничтожает микробы, предупреждает разложение в открытых ранах, задерживает болезненные изменения крови.
Его подсушивающее, обеззараживающее, дубящее свойства — причина использования для обработки рук медицинского персонала до работы с пациентом. Во время искусственной вентиляции легких этанол незаменим как пеногаситель. При нехватке медикаментозных средств становится компонентом общей анестезии.
При отравлении этиленгликолем, метанолом этанол становится противоядием. После его приема уменьшается концентрация токсичных веществ. Применяют этанол в согревающих компрессах, при растирании для охлаждения. Вещество восстанавливает организм при лихорадочном жаре и простудном ознобе.
Спирты в лекарственных средствах и их воздействие на человека исследует наука фармакология. Этанол как растворитель используют при изготовлении экстрактов, настоек целебного растительного сырья (боярышника, перца, женьшеня, пустырника).
Топливо
Коммерческая доступность метанола, бутанола-1, этанола — причина использования их в качестве топлива. Смешивают с дизельным топливом, бензином, применяют как горючее в чистом виде. Смеси позволяют уменьшить токсичность выхлопных газов.
Однако газовые и нефтяные ресурсы исчерпаемы. Поэтому применение спиртов в мировой практике стало альтернативой использования привычного топлива. Налаживается их массовое производство из отходов промышленности (целлюлозно-бумажной, пищевой, деревообрабатывающей) — одновременно решается проблема утилизации.
Промышленная переработка растительного сырья позволяет получить экологически чистое биотопливо — биоэтанол. Сырьем для него является кукуруза (США), сахарный тростник (Бразилия).
Положительный энергетический баланс, возобновляемость топливного ресурса делают производство биоэтанола популярным направлением мировой экономики.
Дата добавления: 2016-11-18; просмотров: 9454 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org – Контакты – Последнее добавление
Источник
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов

Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
- слабые кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- отрыв воды (элиминирование) – дегидратация
- окисление
- образование сложных эфиров — этерификация
1. Кислотные свойства
Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды.
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
![]()
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому спирты не взаимодействуют с растворами щелочей.
Многоатомные спирты также не реагируют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
![]()
Например, этанол взаимодействует с калием с образованием этилата калия и водорода.
![]()
Видеоопыт взаимодействия спиртов (метанола, этанола и бутанола) с натрием можно посмотреть здесь.
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
Например, этилат калия разлагается водой:
CH3OH > первичные спирты > вторичные спирты > третичные спирты
Многоатомные спирты также реагируют с активными металлами:

Видеоопыт взаимодействия глицерина с натрием можно посмотреть здесь.
1.3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).
Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди:
Видеоопыт взаимодействия этиленгликоля с гидроксидом меди (II) можно посмотреть здесь.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
Например, этанол реагирует с бромоводородом.

Видеоопыт взаимодействия этилового спирта с бромоводородом можно посмотреть здесь.
третичные > вторичные > первичные > CH3OH.
Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами.
Например, этиленгликоль реагирует с бромоводородом:

2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
Например, при взаимодействии этанола с аммиаком образуется этиламин.
![]()
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.

Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):

Многоатомные спирты вступают в реакции этерификации с органическими и неорганическими кислотами.
Например, этиленгликоль реагирует с уксусной кислотой с образованием ацетата этиленгликоля:

2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат:
Например, глицерин под действием азотной кислоты образует тринитрат глицерина (тринитроглицерин):
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140оС) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен:
В качестве катализатора этой реакции также используют оксид алюминия.
Отщепление воды от несимметричных спиртов проходит в соответствии с правилом Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
Например, в присутствии концентрированной серной кислоты при нагревании выше 140оС из бутанола-2 в основном образуется бутен-2:
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
Например, при дегидратации этанола при температуре до 140оС образуется диэтиловый эфир:
![]()
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Первичный спирт → альдегид → карбоновая кислота
Метанол → формальдегид → углекислый газ
Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол < первичные спирты < вторичные спирты < третичные спирты
Продукты окисления многоатомных спиртов зависят от их строения. При окислении оксидом меди многоатомные спирты образуют карбонильные соединения.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, этанол окисляется оксидом меди до уксусного альдегида

Видеоопыт окисления этанола оксидом меди (II) можно посмотреть здесь.
Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона

Третичные спирты окисляются только в жестких условиях.
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, при окислении пропанола-1 образуется пропаналь

Видеоопыт каталитического окисления этанола кислородом можно посмотреть здесь.
Например, пропанол-2 окисляется кислородом при нагревании в присутствии меди до ацетона
Третичные спирты окисляются только в жестких условиях.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот, вторичные спирты окисляются до кетонов, метанол окисляется до углекислого газа.
При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси.
Третичные спирты окисляются только в жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов. При этом происходит разрыв углеродной цепи и могут образоваться углекислый газ, карбоновая кислота или кетон, в зависимости от строения спирта.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Первичный спирт R-СН2-ОН | R-COOH/ R-CHO | R-COOK/ R-CHO |
| Вторичный спирт R1-СНОН-R2 | R1-СО-R2 | R1-СО-R2 |
Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ
![]()
Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота

Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон




