Какие свойства газов вы знаете
Физические законы и параметры газов являются основополагающими для создания вакуумных систем. Даже при крайне низких значениях давлений, используемых в вакуумной технике, физические процессы, протекающие в газах, подчиняются общим газовым законам. Необходимость создания вакуума обычно связана с потребностью уменьшения концентрации молекул газа или частоты их столкновений с поверхностью сосуда. Газовые процессы в вакуумных системах можно, как правило, рассматривать с точки зрения законов идеального газа, а некоторые общие физические процессы вакуумных систем могут быть описаны с помощью статических и динамических свойств газов. Физические процессы, протекающие в газах при низком давлении, а также различные параметры и свойства газового потока рассмотрены ниже.
Параметры состояния газа
Если взять образец газа, то для описания его состояния достаточно знать три из четырех параметров. Этими параметрами являются давление, объем, температура и количество газа.
Давление – это сила, с которой газ воздействует на единицу площади поверхности сосуда. В СИ единицей измерения давления является паскаль, или ньютон на квадратный метр (Н/м2). В вакуумной технике также используется единица измерения миллиметр ртутного столба, или Торр: 1 мм рт. ст. = 133 Па (1 Па = 7,5 мм рт. ст.).
Объем – мера пространства, которое занимает газ; обычно он задается размерами сосуда. Единицей объема в СИ является кубический метр (м3), однако для обозначения быстроты откачки и потока газа, а также других величин широко используются литры.
Температура газа при давлении ниже 1 Торр главным образом определяется температурой поверхностей, с которыми он соприкасается. Как правило, газ находится при комнатной температуре. При выводе уравнений, описывающих состояние газов, для измерения температуры используют Кельвины (К).
Количество газа в данном объеме измеряется в молях.
Моль – число граммов газа (или любого вещества), равное его молекулярной массе. Моль содержит 6,02 х 1023 молекул. Один моль любого газа при 0 °С и давлении 760 Торр занимает объем, равный 22,4 л. Масса 1 моля газа равна его молекулярной массе в граммах.
Молярный объем является универсальной постоянной. Экспериментально установлено, что он составляет 22,414 л при 760 Торр и 0 °С. Поскольку 1 моль любого газа при температуре 0 °С и давлении 760 Торр занимает объем 22,4 л, из этого соотношения можно рассчитать молекулярную концентрацию любого объема газа, если известны его температура и давление. Например, 1 см3 воздуха при 760 Торр и 0 °С содержит 2,7 x 1019 молекул; в то время как при давлении 1 Торр и температуре 0 °С 1 см3 воздуха содержит 3,54 x 1016 молекул.
Газовые законы
Газовые законы устанавливают соотношения между физическими параметрами состояния газа (давление, объем, температура и количество газа) при постоянном значении одного из параметров. Эти законы справедливы для идеального газа в котором объем всех молекул является незначительным по сравнению с объемом газа, и энергия притяжения между молекулами является незначительной по сравнению с их средней тепловой энергией. Это означает, что данное вещество (в данном случае газ) находится в газообразном состоянии при температуре, которая достаточно высока для его конденсации. К газам, по своим свойствам близким к идеальным при комнатной температуре, относятся 02, Ne, Аг, СО, Н2 и NO.
Ниже приведены общие формулировки газовых законов.
Закон Бойля – произведение давления на объем рУ, где р – давление газа, V – его объем, является постоянной величиной для данной массы газа при постоянной температуре.
Закон Гей-Люссака – величина V/T, где Т- абсолютная температура газа, является постоянной для данной массы газа при постоянном давлении.
Закон Авогадро – равные объемы различных газов при одинаковых температуре и давлении содержат одно и то же количество молекул. Из этого закона можно получить важное соотношение между числом молей газа и давлением, которое создает газ.
Основное уравнение состояния идеального газа (уравнение Клапейрона) устанавливает зависимость между давлением, объемом и температурой для данной массы газа, т. е. теми параметрами, которые необходимы для описания состояния газа:
$$pV=MRT, (1.1)$$
где R – универсальная газовая постоянная данного газа, R = 8,31 ДжДмоль К) (62,4 Торр-л/(моль x К)); М – это число молей в объеме V
Данный закон будет справедлив и для большинства газов, которые при низких давлениях ведут себя как идеальные газы.
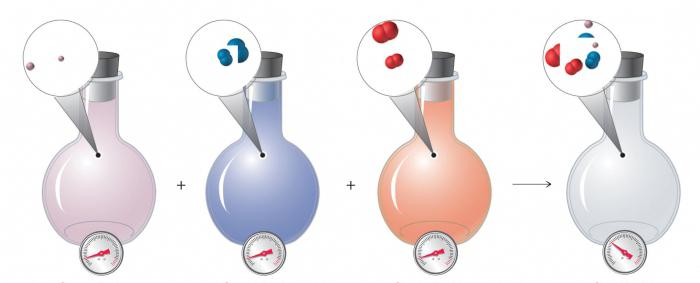
Закон парциальных давлений Дальтона – общее давление, создаваемое смесью газов, равняется сумме парциальных давлений, создаваемых отдельными компонентами смеси.
Парциальное давление, создаваемое одним компонентом смеси газов, – это давление, создаваемое этим компонентом, если бы он занимал весь объем.
Закон Авогадро – равные объемы идеального газа при постоянных температуре и давлении содержат одно и то же количество молекул.
Число Авогадро – число молекул в 1 моле газа или любого вещества, является универсальной постоянной и составляет 6,023 • 1023.
Число Лошмидта – число молекул в кубическом сантиметре газа при атмосферном давлении и температуре 0 °С. Это универсальная постоянная, равная 2,637 x 1019.
Для 1 моля газа при атмосферном давлении и температуре 0 °С (273,2 К), занимающего объем V = 22,414 л, R= 8.31 Дж/(моль x К) или в тепловых единицах R/J= 1,99 кал/К (У – механический эквивалент теплоты, J = 4,182 Дж кал). Следовательно, количество теплоты 1,99 кал будет повышать температуру 1 моля любого идеального газа на 1 К, или после повышения температуры 1 моля любого идеального газа на 1 К увеличение энергии газа составит 8,31 Дж.
Неидеальные газы
Примерами некоторых распространенных неидеальных газов являются аммиак, этан, бензол, диоксид углерода (углекислый газ), пары ртути, SO и S02. Газовые законы должны описывать физические процессы, протекающие в любом газе при температуре выше критической. При критической температуре, Тс, газ начинает конденсироваться. Ниже этой критической температуры имеет место давление паров над жидким конденсатом, которое называется давлением пара. Если газ конденсируется (его объем уменьшается), давление изменяться не будет, но большее количество газа будет переходить в жидкую фазу. По мере снижения температуры над жидкостью будет присутствовать меньшее количество молекул, при этом давление паров также будет снижаться.
Источник
На сегодняшний день известно о существовании более чем 3 миллионов различных веществ. И цифра эта с каждым годом растет, так как химиками-синтетиками и другими учеными постоянно производятся опыты по получению новых соединений, обладающих какими-либо полезными свойствами.
Часть веществ – это природные обитатели, формирующиеся естественным путем. Другая половина – искусственные и синтетические. Однако и в первом и во втором случае значительную часть составляют газообразные вещества, примеры и характеристики которых мы и рассмотрим в данной статье.

Агрегатные состояния веществ
С XVII века принято было считать, что все известные соединения способны существовать в трех агрегатных состояниях: твердые, жидкие, газообразные вещества. Однако тщательные исследования последних десятилетий в области астрономии, физики, химии, космической биологии и прочих наук доказали, что есть еще одна форма. Это плазма.
Что она собой представляет? Это частично или полностью ионизированные газы. И оказывается, таких веществ во Вселенной подавляющее большинство. Так, именно в состоянии плазмы находятся:
- межзвездное вещество;
- космическая материя;
- высшие слои атмосферы;
- туманности;
- состав многих планет;
- звезды.
Поэтому сегодня говорят, что существуют твердые, жидкие, газообразные вещества и плазма. Кстати, каждый газ можно искусственно перевести в такое состояние, если подвергнуть его ионизации, то есть заставить превратиться в ионы.
Газообразные вещества: примеры
Примеров рассматриваемых веществ можно привести массу. Ведь газы известны еще с XVII века, когда ван Гельмонт, естествоиспытатель, впервые получил углекислый газ и стал исследовать его свойства. Кстати, название этой группе соединений также дал он, так как, по его мнению, газы – это нечто неупорядоченное, хаотичное, связанное с духами и чем-то невидимым, но ощутимым. Такое имя прижилось и в России.
Можно классифицировать все газообразные вещества, примеры тогда привести будет легче. Ведь охватить все многообразие сложно.
По составу различают:
- простые,
- сложные молекулы.
К первой группе относятся те, что состоят из одинаковых атомов в любом их количестве. Пример: кислород – О2, озон – О3, водород – Н2, хлор – CL2, фтор – F2, азот – N2 и прочие.
Ко второй категории следует относить такие соединения, в состав которых входит несколько атомов. Это и будут газообразные сложные вещества. Примерами служат:
- сероводород – H2S;
- хлороводород – HCL;
- метан – CH4;
- сернистый газ – SO2;
- бурый газ – NO2;
- фреон – CF2CL2;
- аммиак – NH3 и прочие.
Классификация по природе веществ
Также можно классифицировать виды газообразных веществ по принадлежности к органическому и неорганическому миру. То есть по природе входящих в состав атомов. Органическими газами являются:
- первые пять представителей предельных углеводородов (метан, этан, пропан, бутан, пентан). Общая формула CnH2n+2;
- этилен – С2Н4;
- ацетилен или этин – С2Н2;
- метиламин – CH3NH2 и другие.
К категории газов неорганической природы относятся хлор, фтор, аммиак, угарный газ, силан, веселящий газ, инертные или благородные газы и прочие.
Еще одной классификацией, которой можно подвергнуть рассматриваемые соединения, является деление на основе входящих в состав частиц. Именно из атомов состоят не все газообразные вещества. Примеры структур, в которых присутствуют ионы, молекулы, фотоны, электроны, броуновские частицы, плазма, также относятся к соединениям в таком агрегатном состоянии.
Свойства газов
Характеристики веществ в рассматриваемом состоянии отличаются от таковых для твердых или жидких соединений. Все дело в том, что свойства газообразных веществ особенные. Частицы их легко и быстро подвижны, вещество в целом изотропное, то есть свойства не определяются направлением движения входящих в состав структур.
Можно обозначить самые главные физические свойства газообразных веществ, которые и будут отличать их от всех остальных форм существования материи.
- Это такие соединения, которые нельзя увидеть и проконтролировать, ощутить обычными человеческими способами. Чтобы понять свойства и идентифицировать тот или иной газ, опираются на четыре описывающих их все параметра: давление, температура, количество вещества (моль), объем.
- В отличие от жидкостей газы способны занимать все пространство без остатка, ограничиваясь лишь величиной сосуда или помещения.
- Все газы между собой легко смешиваются, при этом у этих соединений нет поверхности раздела.
- Существуют более легкие и тяжелые представители, поэтому под действием силы тяжести и времени, возможно увидеть их разделение.
- Диффузия – одно из важнейших свойств этих соединений. Способность проникать в другие вещества и насыщать их изнутри, совершая при этом совершенно неупорядоченные движения внутри своей структуры.
- Реальные газы электрический ток проводить не могут, однако если говорить о разреженных и ионизированный субстанциях, то проводимость резко возрастает.
- Теплоемкость и теплопроводность газов невысока и колеблется у разных видов.
- Вязкость возрастает с увеличением давления и температуры.
- Существует два варианта межфазового перехода: испарение – жидкость превращается в пар, сублимация – твердое вещество, минуя жидкое, становится газообразным.
Отличительная особенность паров от истинных газов в том, что первые при определенных условиях способны перейти в жидкость или твердую фазу, а вторые нет. Также следует заметить способность рассматриваемых соединений сопротивляться деформациям и быть текучими.

Подобные свойства газообразных веществ позволяют широко применять их в самых различных областях науки и техники, промышленности и народном хозяйстве. К тому же конкретные характеристики являются для каждого представителя строго индивидуальными. Мы же рассмотрели лишь общие для всех реальных структур особенности.
Сжимаемость
При разных температурах, а также под влиянием давления газы способны сжиматься, увеличивая свою концентрацию и снижая занимаемый объем. При повышенных температурах они расширяются, при низких – сжимаются.
Под действием давления также происходят изменения. Плотность газообразных веществ увеличивается и, при достижении критической точки, которая для каждого представителя своя, может наступить переход в другое агрегатное состояние.
Основные ученые, внесшие вклад в развитие учения о газах
Таких людей можно назвать множество, ведь изучение газов – процесс трудоемкий и исторически долгий. Остановимся на самых известных личностях, сумевших сделать наиболее значимые открытия.
- Амедео Авогадро в 1811 году сделал открытие. Неважно, какие газы, главное, что при одинаковых условиях их в одном объеме их содержится равное количество по числу молекул. Существует рассчитанная величина, имеющая название по фамилии ученого. Она равна 6,03*1023 молекул для 1 моль любого газа.
- Ферми – создал учение об идеальном квантовом газе.
- Гей-Люссак, Бойль-Мариотт – фамилии ученых, создавших основные кинетические уравнения для расчетов.
- Роберт Бойль.
- Джон Дальтон.
- Жак Шарль и многие другие ученые.
Строение газообразных веществ
Самая главная особенность в построении кристаллической решетки рассматриваемых веществ, это то, что в узлах ее либо атомы, либо молекулы, которые соединяются друг с другом слабыми ковалентными связями. Также присутствуют силы ван-дер-ваальсового взаимодействия, когда речь идет о ионах, электронах и других квантовых системах.
Поэтому основные типы строения решеток для газов, это:
- атомная;
- молекулярная.
Связи внутри легко рвутся, поэтому эти соединения не имеют постоянной формы, а заполняют весь пространственный объем. Это же объясняет отсутствие электропроводности и плохую теплопроводность. А вот теплоизоляция у газов хорошая, ведь, благодаря диффузии, они способны проникать в твердые тела и занимать свободные кластерные пространства внутри них. Воздух при этом не пропускается, тепло удерживается. На этом основано применение газов и твердых тел в совокупности в строительных целях.

Простые вещества среди газов
Какие по строению и структуре газы относятся к данной категории, мы уже оговаривали выше. Это те, что состоят из одинаковых атомов. Примеров можно привести много, ведь значительная часть неметаллов из всей периодической системы при обычных условиях существует именно в таком агрегатном состоянии. Например:
- фосфор белый – одна из аллотропных модификаций данного элемента;
- азот;
- кислород;
- фтор;
- хлор;
- гелий;
- неон;
- аргон;
- криптон;
- ксенон.
Молекулы этих газов могут быть как одноатомными (благородные газы), так и многоатомными (озон – О3). Тип связи – ковалентная неполярная, в большинстве случаев достаточно слабая, но не у всех. Кристаллическая решетка молекулярного типа, что позволяет этим веществам легко переходить из одного агрегатного состояния в другое. Так, например, йод при обычных условиях – темно-фиолетовые кристаллы с металлическим блеском. Однако при нагревании сублимируются в клубы ярко-фиолетового газа – I2.

К слову сказать, любое вещество, в том числе металлы, при определенных условиях могут существовать в газообразном состоянии.
Сложные соединения газообразной природы
Таких газов, конечно, большинство. Различные сочетания атомов в молекулах, объединенные ковалентными связями и ван-дер-ваальсовыми взаимодействиями, позволяют сформироваться сотням различных представителей рассматриваемого агрегатного состояния.
Примерами именно сложных веществ среди газов могут быть все соединения, состоящие из двух и более разных элементов. Сюда можно отнести:
- пропан;
- бутан;
- ацетилен;
- аммиак;
- силан;
- фосфин;
- метан;
- сероуглерод;
- сернистый газ;
- бурый газ;
- фреон;
- этилен и прочие.
Кристаллическая решетка молекулярного типа. Многие из представителей легко растворяются в воде, образуя соответствующие кислоты. Большая часть подобных соединений – важная часть химических синтезов, осуществляемых в промышленности.
Метан и его гомологи
Иногда общим понятием “газ” обозначают природное полезное ископаемое, которое представляет собой целую смесь газообразных продуктов преимущественно органической природы. Именно он содержит такие вещества, как:
- метан;
- этан;
- пропан;
- бутан;
- этилен;
- ацетилен;
- пентан и некоторые другие.
В промышленности они являются очень важными, ведь именно пропан-бутановая смесь – это бытовой газ, на котором люди готовят пищу, который используется в качестве источника энергии и тепла.

Многие из них используются для синтеза спиртов, альдегидов, кислот и прочих органических веществ. Ежегодное потребление природного газа исчисляется триллионами кубометров, и это вполне оправданно.
Кислород и углекислый газ
Какие вещества газообразные можно назвать самыми широко распространенными и известными даже первоклассникам? Ответ очевиден – кислород и углекислый газ. Ведь это они являются непосредственными участниками газообмена, происходящего у всех живых существ на планете.
Известно, что именно благодаря кислороду возможна жизнь, так как без него способны существовать только некоторые виды анаэробных бактерий. А углекислый газ – необходимый продукт “питания” для всех растений, которые поглощают его с целью осуществления процесса фотосинтеза.
С химической точки зрения и кислород, и углекислый газ – важные вещества для проведения синтезов соединений. Первый является сильным окислителем, второй чаще восстановитель.
Галогены
Это такая группа соединений, в которых атомы – это частицы газообразного вещества, соединенные попарно между собой за счет ковалентной неполярной связи. Однако не все галогены – газы. Бром – это жидкость при обычных условиях, а йод – легко возгоняющееся твердое вещество. Фтор и хлор – ядовитые опасные для здоровья живых существ вещества, которые являются сильнейшими окислителями и используются в синтезах очень широко.
Источник
Опираясь на материал предыдущего раздела, сначала решают задачи, углубляющие и уточняющие понятие о свойствах идеальных газов, для которых не учитывают собственный объем молекул и их взаимное притяжение. Затем главное внимание уделяют задачам на основное уравнение кинетической теории газов, которое может быть записано в следующих видах:
где и V соответственно давление и объем газа, число, масса и у — средняя скорость молекул, число молекул в единице объема.
Затем изучают закон Шарля
Для абсолютной шкалы температур
При решении задач используют также формулу, устанавливающую зависимость средней кинетической энергии молекулы одноатомного газа от температуры Постоянная
Болыдоана Поскольку это соотношение применимо к молекулам любого одноатомного газа, то следовательно, молекулы любых газов при одной и той же температуре в среднем имеют одинаковую кинетическую энергию.
Подставив значение в основное уравнение молекулярно-кинетической теории, получим уравнение Клапейрона
Для одного киломоля идеального газа уравнение имеет вид Универсальная газовая постоянная
Для любой массы идеального газа уравнение примет вид где число киломолей (уравнение Клапейрона-Менделеева).
При решении многих задач это уравнение для одной и той же массы газа, но для двух различных состояний удобно записывать в виде -(объединенный газовый закон).
При постоянной температуре (закон Бойля-Мариотта).
При постоянном объеме (закон Шарля).
При постоянном давлении (закон Гей-Люссака).
Закон Гей-Люссака учащиеся должны также знать и уметь применять в виде При этом, решая задачи на закон Шарля и Гей-Люссака по формулам
нужно подчеркнуть, что это соответственно давление и объем при Учащиеся же нередко ошибочно считают, что или это конечное и начальное значение “объема или давления, температура, на которую нагрелся газ. Поэтому применяют формулы
что ведет к ошибочным результатам (№ 545).
529. Принимая молекулы газа в замкнутом сосуде за упругие шарики, докажите, что они не могут иметь одинаковую скорость.
Решение. Допустим, что в какой-то момент молекулы имеют одинаковую скорость. Картина тотчас нарушится в результате столкновений. Например, скорость молекулы возрастет в раз, если она получит удар под углом в 90° к ее скорости (рис. 141).
530. Вычислите среднюю скорость молекул водорода при 0° С и давлении,
Решение. Запишем основное уравнение кинетической теории газов где число молекул в единице объема.
Так как при 0° С есть плотность то
Рис. 141.
531. При 0°С давление газа в баллоне равно 10 атм. Каким станет давление газа, если его температура поднимется до
Решение. Первую задачу такого типа полезно решить арифметически для того, чтобы учащиеся лучше «почувствовали» существо закона Шарля.
С повышением температуры газа на 1°С при постоянном объеме давление возрастает на часть, т. е. в данном случае на атм. А при увеличении температуры на 27,3° давление увеличится на апгм атм и станет, следовательно, равным 11 атм.
532. Начертите график изохорного процесса в координатных осях В чем отличие этих графиков?
Решение. Для изохорного процесса идеального газа справедлив закон Шарля. В абсолютной шкале температур или По шкале Цельсия Зависимость давления от температуры для обоих шкал линейная. Но при а при Поэтому графики должны иметь вид, показанный на рисунке 142, а, б.
533. На рисунке 143 представлены графики изохорных процессов. Почему они изображены разными линиями? Почему прямые продолжены до точки А пунктиром? 16, № 1831.
Рис. 142.
Рис. 143.
Ответ. Прямые на графике изображают изохорный процесв для различных масс газа. Для реальных газов при низких температурах прямо пропорциональная зависимость между давлением и температурой (закон Шарля) соблюдается лишь с известным приближением, что отмечено пунктирной линией, по которой, однако, можно установить абсолютную шкалу температур.
534. Найдите среднюю скорость молекул водорода при 0° С и 1000° С, если известно, что масса молекулы водорода
Решение.
Аналогично найдем, что средняя скорость молекул водорода при 1000° С
535. Вычислите молекулярный вес бензола, которого при температуре 87° С и давлении имеют массу
536. Найдите давление неона, если масса его а температура 0°С [21, № 674].
537. Определите массу аммиака, находящегося под давлением при температуре 17° С [21, № 672].
Решение 1. В данной задаче (так же как и в задачах 535 и 536) описывается одно состояние газа, поэтому ее целесообразнее решать по формуле Клапейрона-Менделеева , из которой сразу можно найти искомую величину. При этом следует приучать учащихся производить вычисления в системе СИ.
Формула аммиака Атомный вес азота водорода да 1. Следовательно
В тех случаях, когда формула газа неизвестна, значениер можно
наити по формуле где объем киломоля газа, а его плотность при нормальном давлении.
В данном случае При вычислении массы газа учтем, что
кмоль град
Решение 2. Напишем уравнение состояния газа для указанных в задаче условий: следовательно,
То
Сравнивая решения, следует заметить, что применение уравнения газового состояния позволяет выражать значения входящих в него величин во внесистемных единицах, так как эти величины пропорциональны друг другу в обоих частях равенства. Например, во втором решении плотность была выражена в единицах системы СИ, а давление во внесистемных единицах — мм рт. ст.
Решение задач по формуле Клапейрона-Менделеева требует строгого соблюдения систем единиц. В приведенном примере, взяв значение в системе СИ, мы в этой системе выражали и все другие величины. Но зато решение данного типа задач по формуле Клапейрона-Менделеева позволяет сразу найти искомую величину а решение по уравнению газового состояния требует более сложных рассуждений и применения дополнительных формул, особенно если нужно вычислить значение молекулярного веса или массу газа, которые в явном виде не входят в уравнение газового состояния.
538. В баллоне содержится газ при температуре 27° С и давлении Каково будет его давление, когда температура понизится до
Решение. В условии говорится о двух различных состояниях газа, поэтому используем формулу
Объем газа остается неизменным тогда
Рис. 144.
539. Напишите формулу изотермического процесса (закон Бойля-Мариотта) и начертите графики этого процесса в координатных осях
Ответ. График изотермического процесса в координатных осях гипербола (рис. 144).
Температура при изотермическом процессе не изменяется.
р и V могут быть выражены любыми положительными числами. Графики изотермического процесса в координатных осях и есть прямые, параллельные соответственно осям (рис. 145, а и б).
540. Изотермический процесс изображен двумя различными графиками (рис. 146). Нет ли здесь ошибки? [6, № 175].
Ответ. Ошибки нет. График на осях показывает прямо пропорциональную зависимость плотности газа от давления
С помощью стеклянной трубки, линейки и мензурки с водой определите атмосферное давление.
Решение 1. Закроем верхний конец трубки и опустим ее в воду (рис. 147, а). Для двух состояний газа, до погружения и после погружения трубки в воду, справедливо уравнение 1 а так как то поэтому откуда
Решение 2. Сначала трубку погружают в воду (рис. 147, б), а затем, закрыв верхний конец, поднимают вверх (рис. 147, в). Для
Рис. 145.
Рис. 146.
двух состояний газа справедливо уравнение откуда
542. Начертите графики изобарного процесса в координатных осях и В чем отличие этих графиков? Задачу решают подобно задаче 532.
543. На рисунке 148 представлены графики изобарных процессов.
1. Почему они изображены разными линиями? 2. Почему прямые продолжены до точки А пунктиром?
Ответ. 1. Каждая из прямых на графике изображает изобарный процесс для определенной массы газа. 2. Зависимость между объемом и температурой (закон Гей-Люссака), выраженная на рисунке 148 графически, справедлива для идеальных газов. Для реальных же газов она справедлива лишь с приближением, и тем большим, чем ниже давление.
При весьма низких температурах эта зависимость для газов несправедлива, что и отмечено на рисунке 148 пунктирными линиями [6, стр. 283— 284].
544. На сколько увеличится объем газа при нагревании его от до 100° С при постоянном давлении?
Расчеты в первой задаче такого типа полезно выполнить арифметически, подобно тому как это было сделано в задаче 531.
545. Газ занимает объем при 273° С. Каков будет его объем при 546° С и прежнем давлении?
Рис. 147.
Рис. 148.
Решение 1. Процесс изобарный, поэтому откуда
Решение объем при 0° С найдем из уравнения
Заметим, что если бы учащиеся ошибочно применяли формулу то получили бы неверный ответ:
Источник
