Какие свойства анилина объясняются влиянием аминогруппы на бензольное кольцо
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
I. Основные свойства
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора!!!
Видеоопыт «Изучение среды раствора анилина»
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Особые свойства анилина
Реакции с участием аминогруппы
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях: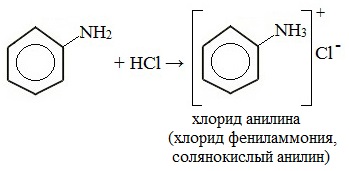
Видеоопыт «Взаимодействие анилина с соляной кислотой»
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
![]()
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
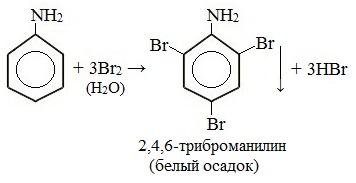
Качественная реакция на анилин!
Видеоопыт «Бромирование анилина»
2. Сульфирование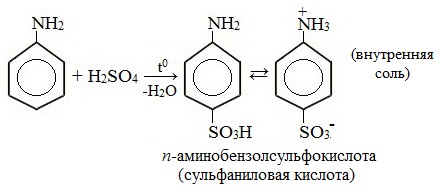
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
III. Окисление анилина
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция»
При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»).
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
Видеоопыт «Окисление анилина раствором дихроматом калия – получение красителей»
IV. Диазотирование анилина
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.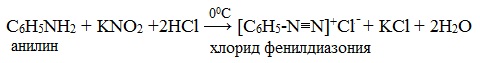
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
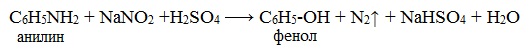
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Анилин
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 2 декабря 2019; проверки требуют 9 правок.
| Анилин | |
|---|---|
| Традиционные названия | Аминобензол Анилин Бензоламин Фениламин |
| Хим. формула | C6H5NH2 |
| Рац. формула | C6H7N |
| Состояние | бесцветная или желтоватая жидкость |
| Молярная масса | 93,1265 ± 0,0055 г/моль |
| Плотность | 1,0217 г/см³ |
| Поверхностное натяжение | 43,3 Н/м |
| Динамическая вязкость | 3,71 Па·с |
| Энергия ионизации | 7,7 ± 0,1 эВ[1] |
| Скорость звука в веществе | 1659 м/с |
| Температура | |
| • плавления | −6,3 °C |
| • кипения | 184,13 °C |
| • вспышки | 158 ± 1 °F[1] и 76 °C |
| • самовоспламенения | 562 °C |
| Пределы взрываемости | 1,3 ± 0,1 об.%[1] |
| Критическая точка | |
| • температура | 425,65 °C |
| • давление | 5,134 МПа |
| Критическая плотность | 0,314 см³/моль |
| Давление пара | 0,6 ± 0,1 мм рт.ст.[1] |
| Растворимость | |
| • в воде | 3,6 г/100 мл |
| • в циклогексане | 66,7 (30,8°C) |
| Диэлектрическая проницаемость | 6,89 |
| Показатель преломления | 1,5863 |
| Дипольный момент | 1,53 Д |
| Рег. номер CAS | 62-53-3 |
| PubChem | 6115 |
| Рег. номер EINECS | 200-539-3 |
| SMILES | NC1=CC=CC=C1 |
| InChI | InChI=1S/C6H7N/c7-6-4-2-1-3-5-6/h1-5H,7H2 PAYRUJLWNCNPSJ-UHFFFAOYSA-N |
| RTECS | BW6650000 |
| ChEBI | 17296 |
| Номер ООН | 1547 |
| ChemSpider | 5889 |
| Предельная концентрация | 0,3 мг/м3 |
| ЛД50 | 9-12 мг/кг (кошки, внутрижелудочно), 132 мг/кг (мыши, внутрижелудочно) |
| Токсичность | Чрезвычайно токсичен для мелких млекопитающих, высокотоксичен для человека, является гематотоксином (вызывает гемолиз). |
| Пиктограммы ECB | |
| NFPA 704 | 2 4 1 POI |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Анили́н (аминобензол, фениламин) — органическое соединение с формулой C6H5NH2, родоначальник класса ароматических аминов. Представляет собой бесцветную маслянистую жидкость с характерным запахом, немного плотнее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Весьма токсичен. Название «анилин» происходит от названия одного из растений, содержащих индиго — Indigofera anil (современное международное название растения — Indigofera suffruticosa).
История[править | править код]
Впервые анилин был получен в 1826 году при перегонке индиго с известью немецким химиком Отто Унфердорбеном (нем. Otto Unverdorben), который дал ему название «кристаллин».
В 1834 году Фридлиб Фердинанд Рунгe обнаружил анилин в каменноугольной смоле и назвал «кианолом».
В 1840 году Юлий Фрицше получил анилин нагреванием индиго с раствором KOH и назвал его «анилином».
В 1842 году Николай Зинин получил анилин восстановлением нитробензола действием (NH4)2S и назвал его «бензидамом».
В 1843 году Август Вильгельм Гофман установил идентичность всех перечисленных соединений.
Промышленное производство фиолетового красителя мовеина на основе анилина началось в 1856 году.
Получение[править | править код]
В промышленности анилин получают в две стадии. На первой стадии бензол нитруется смесью концентрированной азотной и серной кислот при температуре 50—60 °C, в результате образуется нитробензол. На втором этапе нитробензол гидрируют при температуре 200—300 °C в присутствии катализаторов:
Впервые восстановление нитробензола было произведено с помощью железа:
Другим способом получение анилина является восстановление нитросоединений — реакция Зинина:
Также, в анилин — идёт восстановление нитробензола цинком в присутствии избытка соляной кислоты.
;
;
И этот избыток связывает образующийся анилин в соль под названием хлорид фениламмония (анилин солянокислый):
;
Эта соль легко растворима в образующейся при этом воде и может быть выкристаллизована из неё,
к тому же после обработки щелочью хлорид фениламмония — даёт анилин:
Химические свойства[править | править код]
Для анилина характерны реакции как по аминогруппе, так и по ароматическому кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов. С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению с алифатическими аминами и даже с аммиаком. С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол. Хорошо галогенируется, нитруется и сульфируется. Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок). С HNO2 дает диазосоединения.
Окисление[править | править код]
В отличие от аминов алифатического ряда, ароматические амины легко окисляются. Примером может служить реакция хромовой смеси с анилином, в результате образуется краситель «чёрный анилин».
Классическая реакция окисления анилина дихроматом калия в кислой среде часто используется как качественная реакция на анилин:
Аналитическим эффектом в данном случае служит появление окраски раствора от тёмно-синей до чёрной. Как и в большинстве реакций окисления анилина, продуктами являются различные Хиноны.
Другой качественной реакцией на анилин, очень чувствительной, является окисление анилина хлорной известью, при котором появляется фиолетовое окрашивание[2].
Реакции электрофильного замещения[править | править код]
Аминогруппа, являясь заместителем первого рода, оказывает сильное активирующее влияние на бензольное кольцо, из-за чего при нитровании может произойти окисление молекулы анилина. Для предотвращения окисления аминогруппу перед нитрованием «защищают» ацилированием.
Реакции на азот[править | править код]
С азотистой кислотой образует катион диазония, например:
Эта реакция может быть использована для получения фенола, если вместо соляной кислоты использовать разбавленную серную:
Где сначала образуется та же диазониевая соль, которая при нагревании в разбавленном водном растворе гидролизуется и разлагается до фенола, при этом выделяется молекулярный азот.
В связи с нестойкостью азотистой кислоты её часто заменяют нитритом щёлочного металла в кислой среде. Диазониевые соли используют для реакции Зандмейера.
Другие реакции[править | править код]
Гидрирование анилина в присутствии никелевого катализатора даёт циклогексиламин.
Анилин взаимодействует с соляной кислотой с образованием хлорида фениламмония[3]:
Анилин взаимодействует с бромом и даже бромной водой с образованием 2,4,6-триброманилина[4]:
Производство и применение[править | править код]
Изначально анилин получали восстановлением нитробензола молекулярным водородом; практический выход анилина не превышал 15 %. При взаимодействии концентрированной соляной кислоты с железом выделялся атомарный водород, более химически активный по сравнению с молекулярным. Реакция Зинина является более эффективным методом получения анилина. В реакционную массу вливали нитробензол, который восстанавливается до анилина.
По состоянию на 2002 год, в мире основная часть производимого анилина используется для производства метилдиизоцианатов, используемых затем для производства полиуретанов. Анилин также используется при производстве искусственных каучуков, гербицидов и красителей (фиолетового красителя мовеина)[5].
В России он в основном применяется в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты), но в связи с ожидаемым ростом производства полиуретанов возможно значительное изменение картины в среднесрочной перспективе.
Биологические свойства[править | править код]
Анилин – высокотоксичное вещество. В больших концентрациях фениламин оказывает негативное воздействие на центральную нервную систему. Кровеносный яд, вызывает кислородное голодание организма за счёт образования в крови метгемоглобина, гемолиза и дегенеративных изменений эритроцитов.
В организм анилин проникает при дыхании, в виде паров, а также через кожу и слизистые оболочки. Всасывание через кожу усиливается при нагреве воздуха или приёме алкоголя.
При лёгком отравлении анилином наблюдаются слабость, головокружение, головная боль, синюшность губ, ушных раковин и ногтей. При отравлениях средней тяжести также наблюдаются тошнота, рвота, иногда, шатающаяся походка, учащение пульса. Тяжёлые случаи отравления аминобензолом крайне редки.
При хроническом отравлении анилином (анилизм) возникают токсический гепатит, а также нервно-психические нарушения, расстройство сна, снижение памяти и т. д.
При отравлении анилином необходимо прежде всего удаление пострадавшего из очага отравления, обмывание тёплой (но не горячей!) водой. Также применяют введение антидотов (метиленовая синь), сердечно-сосудистые средства или вдыхание карбогена. Пострадавшему надо обеспечить покой.
Предельно допустимая концентрация анилина в воздухе рабочей зоны 0,3мг/м3[6] по ГОСТ 12.1.005-76. В водоёмах (при их промышленном загрязнении) — ПДК 0,1 мг/л (100 мг/м3)[7].
В соответствии с ГОСТ 12.1.007-76 аминобензол относится ко II классу опасности[8].
Охрана труда[править | править код]
Порог восприятия запаха анилина человеком может быть, например, 0,37-2,82 мг/м3[9]; 3,8 мг/м3[10]. ПДК аминобензола в воздухе рабочей зоны[11] 0,3 мг/м3 (максимальная разовая) и 0,1 мг/м3 (средняя сменная за 8 часов). Применение широко распространённых фильтрующих СИЗОД в сочетании с “заменой фильтров по появлении запаха под маской” (как рекомендуется в РФ[12]) приведёт к запоздалой замене противогазных фильтров и чрезмерному воздействию анилина на, по крайней мере, часть работников. Для их защиты необходимо использовать значительно более эффективные изменение технологии и средства коллективной защиты.
Примечания[править | править код]
- ↑ 1 2 3 4 https://www.cdc.gov/niosh/npg/npgd0033.html
- ↑ Окисление анилина раствором хлорной извести. Единая коллекция цифровых образовательных ресурсов. Дата обращения 14 августа 2017.
- ↑ Цветков Л.А. § 36. Амины // Органическая химия. Учебник для 10 класса. — 20-е изд. — М.: Просвещение, 1981. — С. 171—175.
- ↑ Габриелян О.С. § 16. Амины. Анилин // Химия. 10 класс. Базовый уровень : учеб. для общеобразоват. учреждений. — 4-е изд. — М.: Дрофа, 2008. — С. 116—121.
- ↑ Aniline (англ.) (недоступная ссылка). www.the-innovation-group.com (19 February 2002). — Aniline producers price capacity market demand consumption production growth uses outlook n.d., The Chemical Market Reporter, Schnell Publishing Company. Дата обращения 14 августа 2017. Архивировано 19 февраля 2002 года.
- ↑ name=https://docs.cntd.ru_ГОСТ 313-77 Анилин технический. Технические условия (с Изменениями N 1, 2, 3)
- ↑ Анилин // Ангола — Барзас. — М. : Советская энциклопедия, 1970. — С. 32—33. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 2).
- ↑ name=https://docs.cntd.ru_ГОСТ 5819-78 Реактивы. Анилин. Технические условия (с Изменениями N 1)
- ↑ Ткачев П.Г. Материалы к гигиенической характеристике анилина как загрязнителя атмосферного воздуха / Рязанов В.А., Гольдберг М.С. (ред). — Предельно допустимые концентрации атмосферных загрязнений. — Москва: Издательство “Медицина”, 1964. — С. 41-58. — 204 с. — (Выпуск 8). — 2800 экз.
- ↑ Gregory Leonardos, David Kendall & Nancy Barnard. Odor Threshold Determinations of 53 Odorant Chemicals (англ.) // Air & Waste Management Association Journal of the Air & Waste Management Association. — Taylor & Francis, 1969. — February (vol. 19 (iss. 2). — P. 91-95. — ISSN 1096-2247. — doi:10.1080/00022470.1969.10466465.
- ↑ (Роспотребнадзор). № 54 // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» (рус.) / утверждены А.Ю. Поповой. — Москва, 2018. — С. 7. — 170 с. — (Санитарные правила).
- ↑ под ред. Сорокина Ю.Г., Преображенского В.Б. и др. 5. Сроки службы и признаки неисправности СИЗОД // Методические рекомендации по выбору и применению средств индивидуальной защиты органов дыхания (рус.). — Москва: Издательство “КОЛОС”, 2006. — С. 22—35. — 56 с. — 2000 экз. — ISBN 5-10-003932-9.
Литература[править | править код]
- Артеменко А. И. Органическая химия. — М.: «Высшая школа», 1987. — 430 с.
Ссылки[править | править код]
- Анилин // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Источник
Амины– азотсодержащие органические вещества,
производные аммиака (NH3), в молекулах
которых один или несколько атомов водорода замещены на углеводородный радикал
(- R или – CnH2n+1)
2. Функциональная
группа:
– NH2 аминогруппа
3. Классификация
аминов:
4. Нахождение
аминов в природе
Амины широко распространены в природе,
так как образуются при гниении живых организмов. Например, с триметиламином вы
встречались неоднократно. Запах селедочного рассола обусловлен именно этим
веществом. Обиходное словосочетание “трупный яд”, встречающиеся в
художественной литературе, связано с аминами.
5. Номенклатура аминов
1. В большинстве случаев названия аминов
образуют из названий углеводородных радикалов и суффикса амин.
CH3-NH2 Метиламин
CH3-CH2-NH2 Этиламин
Различные радикалы перечисляются в
алфавитном порядке.
CH3-CH2-NH-CH3 Метилэтиламин
При наличии одинаковых радикалов
используют приставки ди и три.
(CH3)2NH Диметиламин
2. Первичные амины часто называют как
производные углеводородов, в молекулах которых один или несколько атомов
водорода замещены на аминогруппы -NH2. В этом случае аминогруппа
указывается в названии суффиксами амин (одна группа -NH2),
диамин (две группы -NH2) и т.д. с добавлением цифр,
отражающих положение этих групп в главной углеродной цепи.
Например:
CH3-CH2-CH2-NH2 пропанамин-1
H2N-CH2-CH2-CH(NH2)-CH3 бутандиамин-1,3
6. Изомерия аминов
Структурная
изомерия
– углеродного скелета, начиная с С4H9NH2:
– положения аминогруппы, начиная с С3H7NH2:
– изомерия аминогруппы, связанная с
изменением степени замещенности атомов водорода при азоте, т.е. между типами
аминов:
Пространственная
изомерия
Возможна оптическая изомерия, начиная с
С4H9NH2:
7. Получение аминов
Из-за запаха низшие амины долгое время
принимали за аммиак, пока в 1849 году французский химик Шарль Вюрц не выяснил, что в отличие от аммиака, они горят на
воздухе с образованием углекислого газа. Он же синтезировал метиламин и
этиламин.
1842 г Н. Н. Зинин
получил анилин восстановлением нитробензола – в промышленности
Восстановление нитросоединений:
R-NO2 + 6[H] t,kat-Ni → R-NH2 + 2H2O
или
R-NO2+3(NH4)2S t, Feв кислой среде →R-NH2 +3S↓
+6NH3↑ + 2H2O (р. Зинина)
Другие способы:
1).
Промышленный
CH3Br + 2NH3 t, ↑p →
CH3-NH2 + NH4Br
2).
Лабораторный – Действие
щелочей на соли алкиламмония
(получение первичных, вторичных,
третичных аминов):
[R-NH3]Г + NaOH
t → R-NH2 + NaГ
+ H2O
3). Действием
галогеналканов на первичные алифатические и ароматические амины получают
вторичные и третичные амины, в том числе, смешанные.
8. Физические свойства аминов
Метиламин, диметиламин и триметиламин — газы, средние
члены алифатического ряда – жидкости, высшие — твердые вещества. Низшие амины
имеют характерный «рыбный» запах, высшие не имеют запаха.
Связь N–H является полярной, поэтому
первичные и вторичные амины образуют межмолекулярные водородные связи
(несколько более слабые, чем Н-связи с участием группы О–Н).
Это объясняет относительно высокую
температуру кипения аминов по сравнению с неполярными соединениями со сходной
молекулярной массой. Например:
Третичные амины не образуют
ассоциирующих водородных связей (отсутствует группа N–H). Поэтому их
температуры кипения ниже, чем у изомерных первичных и вторичных аминов
(триэтиламин кипит при 89 °С, а н-гексиламин – при 133 °С).
По сравнению со спиртами алифатические
амины имеют более низкие температуры кипения (т. кип. метиламина
-6 °С, т. кип. метанола +64,5 °С). Это свидетельствует о
том, что амины ассоциированы в меньшей степени, чем спирты, поскольку прочность
водородных связей с атомом азота меньше, чем с участием более
электроотрицательного кислорода.
При обычной температуре только низшие
алифатические амины CH3NH2, (CH3)2NH
и (CH3)3N – газы (с запахом аммиака), средние гомологи –
жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных
связей с водой:
Поэтому низшие амины хорошо растворимы в
воде. С увеличением числа и размеров углеводородных радикалов растворимость
аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия
образованию водородных связей. Ароматические амины в воде практически не
растворяются.
Анилин (фениламин) С6H5NH2 – важнейший из
ароматических аминов:
Анилин представляет собой бесцветную
маслянистую жидкость с характерным запахом (т. кип. 184 °С,
т. пл. – 6 °С). На воздухе быстро окисляется и приобретает
красно-бурую окраску. Ядовит.
ВИДЕО:
Изучениефизических свойств анилина
9. Свойства аминов
I. Основные свойства
Для аминов характерны основные свойства,
которые обусловлены наличием не поделённой электронной пары на атоме азота
Алифатические
амины
– более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают
электронную плотность на атоме азота за счет +I-эффекта. По этой причине
электронная пара атома азота удерживается менее прочно и легче взаимодействует
с протоном.
Ароматические
амины
являются более слабыми основаниями, чем аммиак, поскольку неподеленная
электронная пара атома азота смещается в сторону бензольного кольца, вступая в
сопряжение с его π-электронами.
Ряд увеличения основных свойств аминов:
C6H5-NH2 < NH3 < R3N < R-NH2 < R2NH
————————————————-→
возрастание основных свойств
В растворах оснoвные свойства третичных
аминов проявляются слабее, чем у вторичных и даже первичных аминов, так как три
радикала создают пространственные препятствия для сольватации образующихся
аммониевых ионов. По этой же причине основность первичных и вторичных аминов
снижается с увеличением размеров и разветвленности радикалов.
Водные растворы аминов
имеют щелочную реакцию (амины
реагируют с водой по донорно-акцепторному механизму):
R-NH2 + H2O → [R-NH3]+
+ OH-
ион алкиламмония
ВИДЕО:
Получениегидроксида диметиламмония и изучение его свойств
Анилин с водой не
реагирует и не изменяет окраску индикатора!!!
ВИДЕО:
Изучение среды раствора анилина
Взаимодействие с кислотами
(донорно-акцепторный
механизм):
CH3-NH2 + H2SO4 → [CH3-NH3]HSO4
(соль – гидросульфатметиламмония)
2CH3-NH2 + H2SO4 → [CH3-NH3]2SO4
(соль
– сульфат метиламмония)
Соли неустойчивы, разлагаются щелочами:
[CH3-NH3]2SO4 + 2NaOH
→ 2CH3-NH2
↑ + Na2SO4 + H2O
Способность
к образованию растворимых солей с последующим их разложением под действием
оснований часто используют для выделения и очистки аминов, не растворимых в
воде. Например, анилин, который практически не растворяется в воде, можно
растворить в соляной кислоте и отделить нерастворимые примеси, а затем, добавив
раствор щелочи (нейтрализация водного раствора), выделить анилин в свободном
состоянии.
II. Реакции окисления
Реакция горения (полного окисления) аминов на примере метиламина:
4СH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
Ароматические
амины легко окисляются даже кислородом воздуха. Являясь в чистом виде
бесцветными веществами, на воздухе они темнеют. Неполное окисление
ароматических аминов используется в производстве красителей. Эти реакции обычно
очень сложны.
ВИДЕО:
Получение диметиламина и его горение
III. Особые свойства анилина
Для анилина характерны реакции как по
аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным
влиянием атомов.
1).
Для анилина характерны свойства бензольного кольца – действие
аминогруппы на бензольное кольцо приводит к увеличению подвижности водорода в
кольце в орто- и пара- положениях:
С одной стороны, бензольное кольцо
ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и
даже с аммиаком.
С другой
стороны, под влиянием аминогруппы бензольное кольцо становится более активным в
реакциях замещения, чем бензол.
Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина
(белый осадок). Эта реакция может использоваться для качественного и количественного
определения анилина:
ВИДЕО:
Бромированиеанилина
2). Свойства аминогруппы:
С6Н5NН2 +
HCl → [С6Н5NН3 ]+Сl-
хлорид фениламмония
ВИДЕО:
Взаимодействиеанилина с соляной кислотой
ВИДЕО:
Окисление анилина раствором хлорной извести – качественная реакция
Взаимодействие анилина с дихроматом калия – получение красителей
10. Применение
Амины используют при
получении лекарственных веществ, красителей и исходных продуктов для
органического синтеза. Гексаметилендиамин при поликонденсации с адипиновой
кислотой дает полиамидные волокна.
Анилин находит широкое
применение в качестве полупродукта в производстве красителей, взрывчатых
веществ и лекарственных средств (сульфаниламидные препараты).
Источник
