Какие свойства аммиака лежат в основе его применения

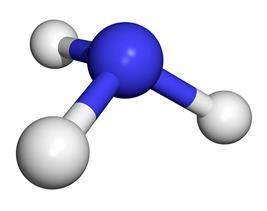
Одним из важнейших химических веществ, которое используют в разных сферах деятельности человека, является аммиак. Ежегодно это вещество производят в огромных количествах – больше 100 млн тонн. Только вдумайтесь в это число! Сразу же возникает вопрос: « Для чего производят такое количество аммиака?». В этой статье мы ответим на этот вопрос, а также выясним причину популярности аммиака.
Свойства аммиака
Физические и химические свойства аммиака обуславливают его применения в различных областях. Аммиак представляет собой газообразное вещество без цвета с очень резким и неприятным запахом. Вещество ядовито. При длительном воздействии на человеческий организм способен вызывать отёки и поражение различных органов.
Аммиак – это слабая кислота, он взаимодействует с кислотами, водой, а с металлами способен образовывать соли. Он способен вступать в различные химические реакции с другими химическими веществами. Например, реакция безводного аммиака с азотной кислотой на практике позволяет получить аммиачную селитру, которая применяется для производства удобрений.
Аммиак является восстановителем. Он способен восстанавливать разные металлы из их оксидов. Реакция взаимодействия аммиака с оксидом меди дает возможность получить азот.
Различные сферы использования аммиака
Несмотря на свою токсичность, аммиак используют в самых разных сферах. Основная часть производимого аммиака идет на изготовление разных продуктов химической промышленности. К таким продуктам относятся:
– аммиачные и аммиачно-нитратные удобрения (аммиачные и нитратная селитра, сульфат аммония, хлористый аммоний и др.). Такие удобрения подходят для разных сельскохозяйственных культур. Важно знать, что внесение в почву удобрений нормируется из-за того, что содержащиеся в них вещества могут мигрировать в спелые овощи и фрукты.
– сода. Существует аммиачный метод получения кальцинированной соды. Аммиак используется для насыщения солевого рассола. Данный метод активно используется для промышленного производства соды.
– азотная кислота. Для её производства используют синтетический аммиак. На данный момент промышленное производство данного вещества основано на явлении катализа синтетического аммиака.
– взрывчатые вещества. Нитрат аммония нейтрален к механическому воздействию, но при некоторых условиях характеризируется высокими взрывчатыми свойствами. Именно поэтому он используется для производства таких веществ. В результате получают аммониты – аммиачные взрывчатые вещества.
– растворитель. Аммиак, в жидком состоянии, может использоваться как растворитель различных органический и неорганических веществ.
– аммиачная – холодильная установка. Аммиак применяется в холодильной технике, в качестве холодильного агента. Аммиак не вызывает парниковый эффект, он экологически чистый и дешевле фреонов. Эти факторы обуславливают применения данного вещества в качестве хладагента.
– нашатырный спирт. Его применяют в медицине и в быту. Данное вещество отлично выводит пятна с одежды различного происхождения, а также нейтрализует кислоты.
Применение аммиака в медицине
Аммиак широко применяется в медицине в качестве 10% -ого раствора аммиака и имеет название – нашатырный спирт. Когда человек падает в обморок, нашатырным спиртом приводят его в чувство. Также его используют как рвотное средство. Для этого его разводят и в малых количествах принимают внутрь. Особенно популярный такой метод при алкогольных отравлениях. Из нашатырного спирта делают примочки и обрабатывают укусы насекомых. Хирурги используют разведенный в воде нашатырный спирт для обработки рук.
Важно помнить, что передозировка аммиаком очень опасна. Возможны болевые ощущения в различных органах, их отеки и даже летальный исход. Этого можно избежать, если использовать данное вещество по назначению и с осторожностью!
Источник
Аммиак – NH3

Аммиак
(в европейских языках его название звучит как «аммониак») своим
названием обязан оазису Аммона в Северной Африке, расположенному на
перекрестке караванных путей. В жарком климате мочевина (NH2)2CO,
содержащаяся в продуктах жизнедеятельности животных, разлагается
особенно быстро. Одним из продуктов разложения и является аммиак. По
другим сведениям, аммиак получил своё название от древнеегипетского
слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
1. Строение молекулы


Молекула аммиака имеет форму тригональной пирамиды с
атомом азота в вершине. Три неспаренных
p-электрона атома азота участвуют в образовании полярных ковалентных
связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара
внешних электронов является неподелённой, она может образовать
донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.
Вид химической связи: ковалентная полярная, три одинарные σ – сигма связи N-H
2. Физические свойства аммиака
При нормальных условиях
— бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти
вдвое легче воздуха, ядовит. По
физиологическому действию на организм относится к группе веществ удушающего и
нейротропного действия, способных при ингаляционном поражении вызвать
токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают
слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и
воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение,
боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы
кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно
велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме
воды.
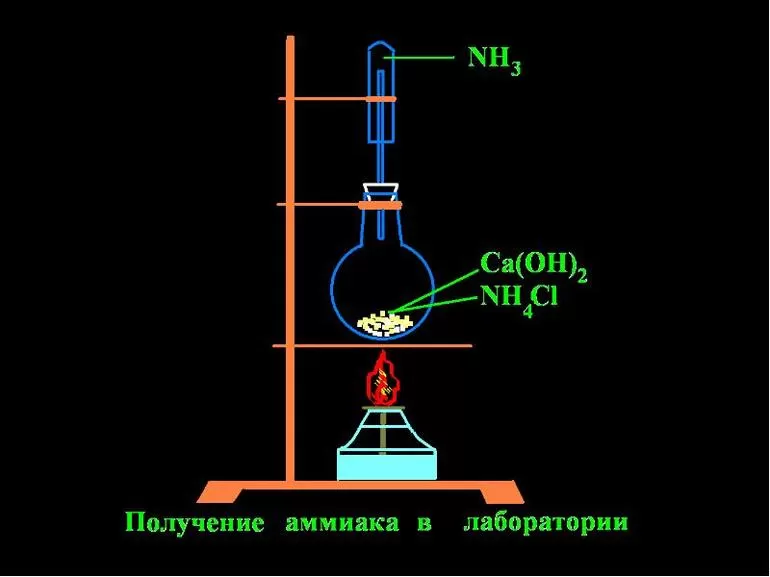
3. Получение аммиака
В лаборатории | В |
Для получения аммиака в лаборатории NH4Cl (NH4)2SO4 Внимание! Гидроксид аммония неустойчивое основание, При получении аммиака держите пробирку – приёмник дном кверху, так как аммиак легче воздуха: | Промышленный способ получения аммиака N2(г) + 3H2(г) ↔ 2NH3(г) Условия: катализатор температура давление Это так называемый процесс Габера (немецкий |
4. Химические свойства аммиака
Для аммиака характерны реакции:
- с
изменением степени окисления атома азота (реакции окисления) - без
изменения степени окисления атома азота (присоединение)
Реакции N-3 → N0 → N+2 NH3 – сильный |
с кислородом 1. Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H20 2. Каталитическое окисление амииака (катализатор Pt – Rh, температура) 4NH3 + 5O2 → 4NO + 6H2O Видео – Эксперимент ” Окисление аммиака в |
с оксидами металлов 2 NH3 |
с сильными окислителями 2NH3 + 3Cl2 = N2 + 6HCl |
аммиак – непрочное соединение, при 2NH3↔ N2 + 3H2 |
5. Применение аммиака
По объемам производства
аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100
миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде
водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду
применяют также непосредственно в виде удобрения, а иногда поля поливают из
цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого
хладагента в промышленных холодильных установках.
Аммиак используется
также для получения синтетических
волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка,
шерсти и шелка. В нефтехимической промышленности аммиак используют для
нейтрализации кислотных отходов, а в производстве природного каучука аммиак
помогает сохранить латекс в процессе его перевозки от плантации до завода.
Аммиак используется также при производстве соды по методу Сольве. В
сталелитейной промышленности аммиак используют для азотирования – насыщения
поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики
используют водные растворы аммиака (нашатырный спирт)
в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека
из обморочного состояния. Для человека аммиак в такой дозе не опасен.
ТРЕНАЖЁРЫ
Тренажёр №1 “Горение аммиака”
Тренажёр №2 “Химические свойства аммиака”
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
Источник
1. Каково электронное и пространственное строение молекулы аммиака?
Электронное строение молекулы аммиака: 3 испаренных электрона атома азота участвуют в формировании 3-х ковалентных связей с 3-мя атомами водорода. Общие электронные пары смещены в сторону более электроотрицательного атома азота. Пространственное строение: молекула аммиака имеет форму треугольной пирамиды.
2. Перечислите области применения аммиака. Какие свойства аммиака лежат в основе его применения в медицине, холодильных установках?
Аммиак легко сжижается при обычном давлении и температуре -33,4°С, а при испарении жидкого газа из окружающей среды поглощается много тепла, поэтому он применяется в холодильных установках.
Аммиак очень хорошо растворим в воде. 10 % раствор аммиака называется нашатырным спиртом и используется в медицине.
3. Какую химическую связь называют водородной? В чем особенности водородной связи? Что можно сказать о прочности водородных связей по сравнению с ковалентными и ионными? Какое значение имеет водородная связь в химии и биологии?
Водородная связь — это химическая связь между атомами водорода и атомами сильно электроотрицательных элементов (фтор, кислород, азот). Водородная связь образуется обычно между двумя соседними молекулами. Например, она образуется между молекулами воды, спиртов, фтороводорода, аммиака.
Это очень слабая связь— примерно в 15-20 раз слабее ковалентной. Благодаря ей некоторые низкомолекулярные вещества образуют ассоциаты, что приводит к повышению температур плавления и кипения веществ.
Аномально высокие температуры плавления и кипения характерны для воды (если рассматривать водородные соединения VI группы). Все водородные соединения VI группы, кроме воды, являются газами.
Очень важную роль играет водородная связь в молекулах важнейших для живых существ соединений — белков и нуклеиновых кислот.
4. Приведите примеры веществ, между молекулами которых образуются водородные связи. Как это отражается на физических свойствах этих веществ?
Водородные связи образуются между молекулами воды спиртов, кислой, галогенводородов, при этом аномально увеличиваются температуры плавления и кипения.
5. На примере образования катиона аммония из молекулы аммиака объясните принцип образования ковалентной связи по донорно-акцептоному механизму. Является ли связь, образованная по донорно-акцепторному механизму, особым типом химической связи? Объясните, почему.
Катион аммония образуется в результате взаимодействия свободной (неподеленной / электронной пары атома азота молекулы аммиака с катионом водорода, переходящего к аммиаку от молекулы кислот или воды. Механизм образования ковалентной связи, которая возникает не в результате обобществления неспаренных электронов, а благодаря свободной электронной паре, имеющейся у одного из атомов, называют донорно-аклепторным. Т.е. Донорно-аклепторный — это не особый вид связи, а лишь особый механизм образования ковалентной связи.
6. Как изменится окраска фенолфталеина при добавлении его к нашатырному спирту? Объясните ответ, составив уравнение химической реакции.

7. Какую степень окисления имеет азот: а) в аммиаке; б) в хлориде аммония; в) в нитрате аммония; г) в сульфате аммония?

8. Используя метод электронного баланса, определите коэффициенты в следующей схеме химической реакции: ![]()

9. Почему азот в аммиаке проявляет только восстановительные свойства?
Аммиак проявляет только восстановительные свойства, т.к. азот находится в самой низкой степени окисления и не может больше принимать электроны.
10. Как получают аммиак: а) в промышленности; б) в лабораторных условиях?

Источник

Описание элемента

В жидкой форме аммиака молекулы соединены водородной связью. Температура, вязкость и плотность аммиака по сравнению с водой значительно ниже. Процесс кипения начинается от 33 градусов, а процесс горения или плавления — от 77 градусов по Цельсию. Показатели проводимости и диэлектрической проницаемости аммиака низкие. Следовательно, прочность связей в состоянии жидкости низкая.
Аналогично воде, аммиак в жидком состоянии ассоциирован из-за наличия водородной связи. Переход химического состава в состояние жидкости, не имеющей цвета, с плотностью 681 килограмм на метр кубический, быстрый. Проводимость тока в этом состояние практически отсутствует.
Химические свойства
По свойствам аммиак замечательный растворитель для разнообразных органических и неорганических составов. В твёрдом состоянии представляет собой кристаллы, не имеющие цвета. Может взаимодействовать с кислородом, хлоридом, серной кислотой, а также реагировать на водные и соляные растворы.
Аммиак обладает следующими химическими свойствами:
- Играет роль нуклеофила или комплексообразователя в химических реакциях. При присоединении протона образовывает аммоний: NH3 + H+ → NH4+.
- В жидком растворе происходит слабая щелочная реакция из-за протекающего процесса: NH 3 + H2О → NH4+ +ОН-.
- При воздействии кислот получается соль аммония, что демонстрирует уравнение: NH3 + HNO3 → NH4NO3.
- В соединении с металлами за счет кислотных свойств образует амиды: 2NH3 +2К →2КNH2 +Н2.
Состав амида, имида и нитрида металла образуют за счет реакции с аммиаком в жидком состоянии. Нитрид получают посредством прогревания металла в азотной атмосфере.
Амиды имеют идентичные свойства гидроксидам (за счет неэлектронных ионов ОН, NH2 и молекулы воды). Основание амида сильнее гидроксида, поэтому он подвержен гидролизу, который необратим.
Растворы амидов на основе аммиака проводят ток и подвержены диссоциации: MNH2 → M+ + NH2.
Фенолфталеин в составе раствора приобретает красный оттенок, но после добавления кислот наступает процесс нейтрализации.
Аммиаку в жидком состоянии свойственны ионизирующие функции растворителя, который способен растворить щелочные металлы и щелочноземельные. При этом он приобретает синий цвет. Концентрированный раствор отличается блеском металла. Во время испарения металлы из щелочи получают в целом виде, а щёлочноземельные образуют с аммиаком комплексы со свойствами проводимости металлов.

В результате происходит распадение металлических атомов на ионы, которые положительно заряжены и электроны, сульфатированные в окружении молекул NH 3. Растворы с наличием свободных электронов имеют свойства сильнейших восстановителей.
За счет электронодонорного свойства частицы аммиака могут присутствовать в комплексных соединениях в виде лигандов. Для образования аминокомплексов вводят избыточное количество аммиака в солевой раствор металла.
Химическая реакция вызывает изменение цвета реагентов. Прочными связями комплекса обладают соединения с наличием хрома и кобальта, степень окисления которого +3.
Физическое воздействие
По физическим свойствам аммиак относится к веществам, обладающим удушающими характеристиками и действием на нервную систему. При попадании в область дыхательных путей способен токсинами поразить легкие и вызвать отек с поражением разных систем живого организма. По виду действия может быть местного применения и резорбтивного.
Аммиачные пары раздражает слизистую оболочку глаза и кожные покровы. Процесс протекает с сильным неприятным запахом. Вследствие воздействия пара происходит обильное выделение слез и боли в области лица. В результате появляется ожог роговицы глаза. Зрение человека ухудшается или происходит полная его потеря. Следом наступает приступ кашля, изменение цвета кожного покрова с сильным раздражением.
Во время попадания раствора на кожу происходит жжение пораженной поверхности и образование пузырей и изъязвлений. По своим свойствам в сжатом состояние во время процесса испарения поглощает тепло. Попадая на кожу, химический элемент способен вызвать отморожение разной степени. Наличие запаха ощущается при концентрации 37 миллиграмм на метр кубический.
Норма концентрации аммиака на рабочем месте не должна превышать 20 миллиграмм на метр кубический. Работать при более тяжелых условиях без средств индивидуальной защиты запрещено.
Раздражение глаз проявляется при 490 миллиграммах концентрации в воздухе, а зева — 280. Токсичное отравление и лёгочный отек происходит при концентрации состава в 1,5 грамма на метр кубический (если находиться в области облака испарений в течение двух часов).
Применение и использование
Аммиак входит в большое количество веществ в промышленности. Объемы изготовления этого химического элемента достигают 150 миллионов тонн. Чаще всего производят:

- азотные удобрения (аммоний и мочевина);
- вещества на взрывчатой основе;
- азотные кислоты.
Возможно применение аммиака в роли растворителя. В холодильной промышленности встречается в виде холодильного агента (R 717).
В области медицины аммиак или нашатырный спирт (более привычное название — нашатырь) выводит человека из состояния обморока, стимулирует рвотный рефлекс. Для наружного применения используют в качестве обеззараживания укусов насекомых и при обрабатывании рук врачей. При неосторожном использовании возможно получить ожог органов пищеварения, остановку работы легких.

Применение при дерматите, кожных заболеваниях, а также повреждениях кожи в результате травмы категорически запрещено. Местное использование разрешено на здоровой области кожи. При неаккуратном применении и попадании раствора на слизистую часть глазного яблока следует обработать пострадавшую область водой или борной кислотой. Обработку необходимо повторять каждые 10 минут.
Применять вещества на масляной основе и различные мази нельзя. При попадании на область носа следует промыть ее лимонной кислотой или соком из натуральных фруктов. При попадании в область рта рекомендуется обильное употребление воды, фруктового сока.
Способы получения
Аммиак производят при водородном и азотном взаимодействии молекул в промышленности. Техника производства называется процессом Габера. Вся реакция протекает с выбросом тепла и уменьшением объема. Таким образом, реакция проводится при пониженной температуре окружающей среды и повышенном давлении. Равновесие смещается вправо. В этих условиях скорость прохождения реакции маленькая, а при повышении показаний температуры скорость начинает увеличиваться. Для безопасного проведения реакции требуется специальное оборудование, поддерживающее повышенное давление.
Для ускорения получения состояния равновесия используют катализаторные материалы — железо с пористым составом и некоторым процентом добавок.
По всем свойствам процесс получения аммиака происходит при температуре в 500 градусов по Цельсию и при наличии высокого давления, достигающего 350 атмосфер. Процент добычи при соблюдении этих факторов составит 30 процентов. В промышленности процесс зациклен. Происходит охлаждение состава и удаление аммиака, а непрореагировавший азот и водород возвращают для повторного синтеза обратно. Этот способ добычи аммиака в промышленности считается самым экономичным.
В условиях лаборатории аммиак добывают за счет действия щелочей. Химический элемент получают путем нагревания аммония с известью. Для сушки аммиака используют известь с натром.

Благодаря физическим и химическим свойствам аммиака его успешно используют в промышленности, производстве, медицине, химии и многих других областях человеческой деятельности.
Источник
