Какие свойства аммиака лежат в основе
1. Каково электронное и пространственное строение молекулы аммиака?
Электронное строение молекулы аммиака: 3 испаренных электрона атома азота участвуют в формировании 3-х ковалентных связей с 3-мя атомами водорода. Общие электронные пары смещены в сторону более электроотрицательного атома азота. Пространственное строение: молекула аммиака имеет форму треугольной пирамиды.
2. Перечислите области применения аммиака. Какие свойства аммиака лежат в основе его применения в медицине, холодильных установках?
Аммиак легко сжижается при обычном давлении и температуре -33,4°С, а при испарении жидкого газа из окружающей среды поглощается много тепла, поэтому он применяется в холодильных установках.
Аммиак очень хорошо растворим в воде. 10 % раствор аммиака называется нашатырным спиртом и используется в медицине.
3. Какую химическую связь называют водородной? В чем особенности водородной связи? Что можно сказать о прочности водородных связей по сравнению с ковалентными и ионными? Какое значение имеет водородная связь в химии и биологии?
Водородная связь — это химическая связь между атомами водорода и атомами сильно электроотрицательных элементов (фтор, кислород, азот). Водородная связь образуется обычно между двумя соседними молекулами. Например, она образуется между молекулами воды, спиртов, фтороводорода, аммиака.
Это очень слабая связь— примерно в 15-20 раз слабее ковалентной. Благодаря ей некоторые низкомолекулярные вещества образуют ассоциаты, что приводит к повышению температур плавления и кипения веществ.
Аномально высокие температуры плавления и кипения характерны для воды (если рассматривать водородные соединения VI группы). Все водородные соединения VI группы, кроме воды, являются газами.
Очень важную роль играет водородная связь в молекулах важнейших для живых существ соединений — белков и нуклеиновых кислот.
4. Приведите примеры веществ, между молекулами которых образуются водородные связи. Как это отражается на физических свойствах этих веществ?
Водородные связи образуются между молекулами воды спиртов, кислой, галогенводородов, при этом аномально увеличиваются температуры плавления и кипения.
5. На примере образования катиона аммония из молекулы аммиака объясните принцип образования ковалентной связи по донорно-акцептоному механизму. Является ли связь, образованная по донорно-акцепторному механизму, особым типом химической связи? Объясните, почему.
Катион аммония образуется в результате взаимодействия свободной (неподеленной / электронной пары атома азота молекулы аммиака с катионом водорода, переходящего к аммиаку от молекулы кислот или воды. Механизм образования ковалентной связи, которая возникает не в результате обобществления неспаренных электронов, а благодаря свободной электронной паре, имеющейся у одного из атомов, называют донорно-аклепторным. Т.е. Донорно-аклепторный — это не особый вид связи, а лишь особый механизм образования ковалентной связи.
6. Как изменится окраска фенолфталеина при добавлении его к нашатырному спирту? Объясните ответ, составив уравнение химической реакции.
7. Какую степень окисления имеет азот: а) в аммиаке; б) в хлориде аммония; в) в нитрате аммония; г) в сульфате аммония?
8. Используя метод электронного баланса, определите коэффициенты в следующей схеме химической реакции:
9. Почему азот в аммиаке проявляет только восстановительные свойства?
Аммиак проявляет только восстановительные свойства, т.к. азот находится в самой низкой степени окисления и не может больше принимать электроны.
10. Как получают аммиак: а) в промышленности; б) в лабораторных условиях?
Источник
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:

Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3о:

У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:

Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
:NH3 + H2O ⇄ NH4+ + OH–

Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды.
Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например, хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
5. Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например, аммиак окисляется хлором до молекулярного азота:
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Источник
Одним из важнейших химических веществ, которое используют в разных сферах деятельности человека, является аммиак. Ежегодно это вещество производят в огромных количествах – больше 100 млн тонн. Только вдумайтесь в это число! Сразу же возникает вопрос: « Для чего производят такое количество аммиака?». В этой статье мы ответим на этот вопрос, а также выясним причину популярности аммиака.
Свойства аммиака
Физические и химические свойства аммиака обуславливают его применения в различных областях. Аммиак представляет собой газообразное вещество без цвета с очень резким и неприятным запахом. Вещество ядовито. При длительном воздействии на человеческий организм способен вызывать отёки и поражение различных органов.
Аммиак – это слабая кислота, он взаимодействует с кислотами, водой, а с металлами способен образовывать соли. Он способен вступать в различные химические реакции с другими химическими веществами. Например, реакция безводного аммиака с азотной кислотой на практике позволяет получить аммиачную селитру, которая применяется для производства удобрений.
Аммиак является восстановителем. Он способен восстанавливать разные металлы из их оксидов. Реакция взаимодействия аммиака с оксидом меди дает возможность получить азот.
Различные сферы использования аммиака
Несмотря на свою токсичность, аммиак используют в самых разных сферах. Основная часть производимого аммиака идет на изготовление разных продуктов химической промышленности. К таким продуктам относятся:
– аммиачные и аммиачно-нитратные удобрения (аммиачные и нитратная селитра, сульфат аммония, хлористый аммоний и др.). Такие удобрения подходят для разных сельскохозяйственных культур. Важно знать, что внесение в почву удобрений нормируется из-за того, что содержащиеся в них вещества могут мигрировать в спелые овощи и фрукты.
– сода. Существует аммиачный метод получения кальцинированной соды. Аммиак используется для насыщения солевого рассола. Данный метод активно используется для промышленного производства соды.
– азотная кислота. Для её производства используют синтетический аммиак. На данный момент промышленное производство данного вещества основано на явлении катализа синтетического аммиака.
– взрывчатые вещества. Нитрат аммония нейтрален к механическому воздействию, но при некоторых условиях характеризируется высокими взрывчатыми свойствами. Именно поэтому он используется для производства таких веществ. В результате получают аммониты – аммиачные взрывчатые вещества.
– растворитель. Аммиак, в жидком состоянии, может использоваться как растворитель различных органический и неорганических веществ.
– аммиачная – холодильная установка. Аммиак применяется в холодильной технике, в качестве холодильного агента. Аммиак не вызывает парниковый эффект, он экологически чистый и дешевле фреонов. Эти факторы обуславливают применения данного вещества в качестве хладагента.
– нашатырный спирт. Его применяют в медицине и в быту. Данное вещество отлично выводит пятна с одежды различного происхождения, а также нейтрализует кислоты.
Применение аммиака в медицине
Аммиак широко применяется в медицине в качестве 10% -ого раствора аммиака и имеет название – нашатырный спирт. Когда человек падает в обморок, нашатырным спиртом приводят его в чувство. Также его используют как рвотное средство. Для этого его разводят и в малых количествах принимают внутрь. Особенно популярный такой метод при алкогольных отравлениях. Из нашатырного спирта делают примочки и обрабатывают укусы насекомых. Хирурги используют разведенный в воде нашатырный спирт для обработки рук.
Важно помнить, что передозировка аммиаком очень опасна. Возможны болевые ощущения в различных органах, их отеки и даже летальный исход. Этого можно избежать, если использовать данное вещество по назначению и с осторожностью!
Источник
Нитрид водорода с формулой NH3 называется аммиаком. Это лёгкий (легче воздуха) газ с резким запахом. Строение молекулы определяет физические и химические свойства аммиака.

Строение
Молекула аммиака состоит из одного атома азота и трёх атомов водорода. Связи между атомами водорода и азота ковалентные. Молекула аммиака имеет форму тригональной пирамиды.
На 2р-орбитали азота находится три свободных электрона. С ними вступают в гибридизацию три атома водорода, образуя тип гибридизации sp3.
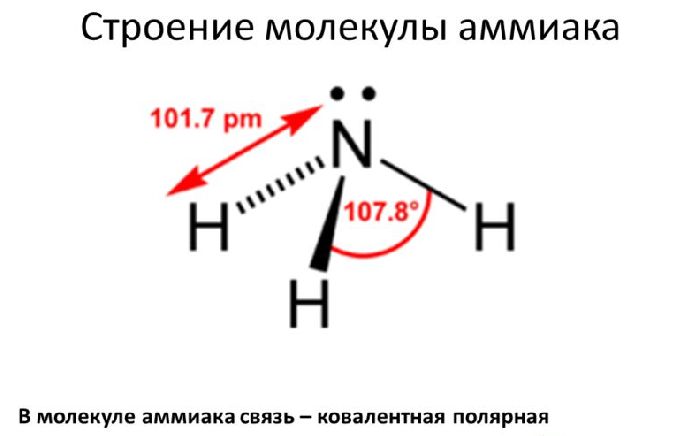
Рис. 1. Строение молекулы аммиака.
Если один атом водорода заменить углеводородным радикалом (CnHm), получится новое органическое вещество – амин. Замещаться может не только один атом водорода, но и все три. В зависимости от количества замещённых атомов различают три вида аминов:
- первичные (метиламин – CH3NH2);
- вторичные (диметиламин – СН3-NH-СН3);
- третичные (триметиламин – СН3-N-(СН3)2).
К молекуле аммиака могут присоединиться С2Н4, С6Н4, (С2Н4)2 и другие вещества, содержащие несколько атомов углерода и водорода.

Рис. 2. Образование аминов.
У аммиака и аминов остаётся свободной пара электронов азота, поэтому свойства двух веществ схожи.
Физические
Основные физические свойства аммиака:
- бесцветный газ;
- резкий запах;
- хорошая растворимость в воде (на один объём воды 700 объёмов аммиака при 20°С, при 0°С – 1200);
- легче воздуха.
Аммиак сжижается при температуре -33°С и становится твёрдым при -78°С. Концентрированный раствор содержит 25 % аммиака и имеет плотность 0,91 г/см3. Жидкий аммиак растворяет неорганические и органические вещества, но не проводит электрический ток.
В природе аммиак выделяется при гниении и разложении органических веществ, содержащих азот (белки, мочевина).
Химические
Степень окисления азота в составе аммиака – -3, водорода – +1. При образовании аммиака водород окисляет азот, отнимая у него три электрона. За счёт оставшейся пары электронов азота и лёгкого отделения атомов водорода аммиак является активным соединением, вступающим в реакции с простыми и сложными веществами.
Основные химические свойства описаны в таблице.
Взаимодействие | Продукты реакции | Уравнение |
С кислородом | Горит с образованием азота или взаимодействует с кислородом в присутствии катализатора (платины), образуя оксид азота | – 4NH3 +3O2 → 2N2 + 6H2O; – 4NH3 + 5O2 → 4NO + 6H2O |
С галогенами | Азот, кислота | 2NH3 + 3Br2 → N2 + 6HBr |
С водой | Гидроксид аммония или нашатырный спирт | NH3 + H2O → NH4OH |
С кислотами | Соли аммония | – NH3 + HCl → NH4Cl; – 2NH3 + H2SO4 → (NH4)2SO4 |
С солями | Замещает металл, образуя новую соль | 2NH3 + CuSO4 → (NH4)2SO4 + Cu |
С оксидами металлов | Восстанавливает металл, образуется азот | 2NH3 + 3CuO → 3Cu + N2 + 3H2O |

Рис. 3. Горение аммиака.
Что мы узнали?
Выяснили, какими свойствами обладает аммиак. Аммиак – бесцветный лёгкий газ с резким запахом. Сжижается при низкой температуре. Раствор аммиака – хороший растворитель. Способен отдавать атомы водорода, присоединяя углеводородный радикал и образуя амины. Аммиак за счёт оставшейся электронной пары азота реагирует с простыми и сложными веществами – галогенами, кислородом, водой, кислотами, солями, оксидами.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Костя Антонюк
4/5
Александр Котков
5/5
Оценка доклада
Средняя оценка: 4.3. Всего получено оценок: 355.
Источник
Описание элемента
В жидкой форме аммиака молекулы соединены водородной связью. Температура, вязкость и плотность аммиака по сравнению с водой значительно ниже. Процесс кипения начинается от 33 градусов, а процесс горения или плавления — от 77 градусов по Цельсию. Показатели проводимости и диэлектрической проницаемости аммиака низкие. Следовательно, прочность связей в состоянии жидкости низкая.
Аналогично воде, аммиак в жидком состоянии ассоциирован из-за наличия водородной связи. Переход химического состава в состояние жидкости, не имеющей цвета, с плотностью 681 килограмм на метр кубический, быстрый. Проводимость тока в этом состояние практически отсутствует.
Химические свойства
По свойствам аммиак замечательный растворитель для разнообразных органических и неорганических составов. В твёрдом состоянии представляет собой кристаллы, не имеющие цвета. Может взаимодействовать с кислородом, хлоридом, серной кислотой, а также реагировать на водные и соляные растворы.
Аммиак обладает следующими химическими свойствами:
- Играет роль нуклеофила или комплексообразователя в химических реакциях. При присоединении протона образовывает аммоний: NH3 + H+ → NH4+.
- В жидком растворе происходит слабая щелочная реакция из-за протекающего процесса: NH 3 + H2О → NH4+ +ОН-.
- При воздействии кислот получается соль аммония, что демонстрирует уравнение: NH3 + HNO3 → NH4NO3.
- В соединении с металлами за счет кислотных свойств образует амиды: 2NH3 +2К →2КNH2 +Н2.
Состав амида, имида и нитрида металла образуют за счет реакции с аммиаком в жидком состоянии. Нитрид получают посредством прогревания металла в азотной атмосфере.
Амиды имеют идентичные свойства гидроксидам (за счет неэлектронных ионов ОН, NH2 и молекулы воды). Основание амида сильнее гидроксида, поэтому он подвержен гидролизу, который необратим.
Растворы амидов на основе аммиака проводят ток и подвержены диссоциации: MNH2 → M+ + NH2.
Фенолфталеин в составе раствора приобретает красный оттенок, но после добавления кислот наступает процесс нейтрализации.
Аммиаку в жидком состоянии свойственны ионизирующие функции растворителя, который способен растворить щелочные металлы и щелочноземельные. При этом он приобретает синий цвет. Концентрированный раствор отличается блеском металла. Во время испарения металлы из щелочи получают в целом виде, а щёлочноземельные образуют с аммиаком комплексы со свойствами проводимости металлов.
В результате происходит распадение металлических атомов на ионы, которые положительно заряжены и электроны, сульфатированные в окружении молекул NH 3. Растворы с наличием свободных электронов имеют свойства сильнейших восстановителей.
За счет электронодонорного свойства частицы аммиака могут присутствовать в комплексных соединениях в виде лигандов. Для образования аминокомплексов вводят избыточное количество аммиака в солевой раствор металла.
Химическая реакция вызывает изменение цвета реагентов. Прочными связями комплекса обладают соединения с наличием хрома и кобальта, степень окисления которого +3.
Физическое воздействие
По физическим свойствам аммиак относится к веществам, обладающим удушающими характеристиками и действием на нервную систему. При попадании в область дыхательных путей способен токсинами поразить легкие и вызвать отек с поражением разных систем живого организма. По виду действия может быть местного применения и резорбтивного.
Аммиачные пары раздражает слизистую оболочку глаза и кожные покровы. Процесс протекает с сильным неприятным запахом. Вследствие воздействия пара происходит обильное выделение слез и боли в области лица. В результате появляется ожог роговицы глаза. Зрение человека ухудшается или происходит полная его потеря. Следом наступает приступ кашля, изменение цвета кожного покрова с сильным раздражением.
Во время попадания раствора на кожу происходит жжение пораженной поверхности и образование пузырей и изъязвлений. По своим свойствам в сжатом состояние во время процесса испарения поглощает тепло. Попадая на кожу, химический элемент способен вызвать отморожение разной степени. Наличие запаха ощущается при концентрации 37 миллиграмм на метр кубический.
Норма концентрации аммиака на рабочем месте не должна превышать 20 миллиграмм на метр кубический. Работать при более тяжелых условиях без средств индивидуальной защиты запрещено.
Раздражение глаз проявляется при 490 миллиграммах концентрации в воздухе, а зева — 280. Токсичное отравление и лёгочный отек происходит при концентрации состава в 1,5 грамма на метр кубический (если находиться в области облака испарений в течение двух часов).
Применение и использование
Аммиак входит в большое количество веществ в промышленности. Объемы изготовления этого химического элемента достигают 150 миллионов тонн. Чаще всего производят:
- азотные удобрения (аммоний и мочевина);
- вещества на взрывчатой основе;
- азотные кислоты.
Возможно применение аммиака в роли растворителя. В холодильной промышленности встречается в виде холодильного агента (R 717).
В области медицины аммиак или нашатырный спирт (более привычное название — нашатырь) выводит человека из состояния обморока, стимулирует рвотный рефлекс. Для наружного применения используют в качестве обеззараживания укусов насекомых и при обрабатывании рук врачей. При неосторожном использовании возможно получить ожог органов пищеварения, остановку работы легких.
Применение при дерматите, кожных заболеваниях, а также повреждениях кожи в результате травмы категорически запрещено. Местное использование разрешено на здоровой области кожи. При неаккуратном применении и попадании раствора на слизистую часть глазного яблока следует обработать пострадавшую область водой или борной кислотой. Обработку необходимо повторять каждые 10 минут.
Применять вещества на масляной основе и различные мази нельзя. При попадании на область носа следует промыть ее лимонной кислотой или соком из натуральных фруктов. При попадании в область рта рекомендуется обильное употребление воды, фруктового сока.
Способы получения
Аммиак производят при водородном и азотном взаимодействии молекул в промышленности. Техника производства называется процессом Габера. Вся реакция протекает с выбросом тепла и уменьшением объема. Таким образом, реакция проводится при пониженной температуре окружающей среды и повышенном давлении. Равновесие смещается вправо. В этих условиях скорость прохождения реакции маленькая, а при повышении показаний температуры скорость начинает увеличиваться. Для безопасного проведения реакции требуется специальное оборудование, поддерживающее повышенное давление.
Для ускорения получения состояния равновесия используют катализаторные материалы — железо с пористым составом и некоторым процентом добавок.
По всем свойствам процесс получения аммиака происходит при температуре в 500 градусов по Цельсию и при наличии высокого давления, достигающего 350 атмосфер. Процент добычи при соблюдении этих факторов составит 30 процентов. В промышленности процесс зациклен. Происходит охлаждение состава и удаление аммиака, а непрореагировавший азот и водород возвращают для повторного синтеза обратно. Этот способ добычи аммиака в промышленности считается самым экономичным.
В условиях лаборатории аммиак добывают за счет действия щелочей. Химический элемент получают путем нагревания аммония с известью. Для сушки аммиака используют известь с натром.
Благодаря физическим и химическим свойствам аммиака его успешно используют в промышленности, производстве, медицине, химии и многих других областях человеческой деятельности.
Источник
