Какие свойств проявляет мышьяк

Мышьяк является неметаллом, образует соединения, подобные по его химическим свойствам. Однако, наряду с неметаллическими свойствами, мышьяк проявляет и металлические. На воздухе при обычных условиях мышьяк слегка окисляется с поверхности. Ни в воде, ни в органических растворителях мышьяк и его аналоги нерастворимы.
Мышьяк химически активен. На воздухе при нормальной температуре даже компактный (плавленый) металлический мышьяк легко окисляется, при нагревании порошкообразный мышьяк воспламеняется и горит голубым пламенем с образованием оксида As2O3. Известен также термически менее устойчивый нелетучий оксид As2O5.
При нагревании (в отсутствие воздуха) As возгоняется (температура возгонки 615оС). Пар состоит из молекул As4 с ничтожной (порядка 0,03%) примесью молекул As2.
Мышьяк относится к группе элементов окислителей-восстановителей. При действии сильных восстановителей он проявляет окислительные свойства. Так, при действии металлов и водорода в момент выделения он способен давать соответствующие металлические и водородистые соединения:
6Ca +As4 = 2Ca3As2
При действии сильных окислителей мышьяк переходит в трех- или пятивалентное состояние. Например, при накаливании на воздухе мышьяк, окисляясь кислородом, сгорает и образует белый дым – оксид мышьяка (III) As2O3:
As4 + 3O2 =2As2O3
Устойчивые формы оксида мышьяка в газовой фазе – сесквиоксид (мышьяковистый ангидрид) As2O3 и его димер As4O6. До 300оС основная форма в газовой фазе – димер, выше этой температуры он заметно диссоциирован, а при температурах выше 1800оС газообразный оксид состоит практически из мономерных молекул As2O3.
Газообразная смесь As4O6 и As2O3 образуется при горении As в кислороде, при окислительном обжиге сульфидных минералов As, например арсенопирита, руд цветных металлов и полимерных руд.
При конденсации пара As2O3 (As4O6) выше 310оС образуется стекловидная форма As2O3. При конденсации пара ниже 310оС образуется бесцветная поликристаллическая кубическая модификация арсенолит. Все формы As2O3 хорошо растворимы в кислотах и щелочах.
Оксид As(V) (мышьяковый ангидрид) As2O5 – бесцветные кристаллы ромбической сингонии. При нагревании As2O5 диссоциирует на As4O6 (газ) и О2. Получают As2O5 обезвоживанием концентрированных растворов H3AsO4 с последующим прокаливанием образующихся гидратов.
Известен оксид As2O4, получаемый спеканием As2O3 и As2O5 при 280оС в присутствии паров воды. Известен также газообразный монооксид AsO, образующийся при электрическом разряде в парах триоксида As при пониженном давлении.
При растворении в воде As2O5 образует существующие только в растворе ортомышьяковистую H3AsO3, или As(OH)3, и метамышьяковистую HAsO2, или AsO(OH), кислоты, обладающие амфотерными, преимущественно кислыми, свойствами.
По отношению к кислотам мышьяк ведет себя следующим образом:
— с соляной кислотой мышьяк не реагирует, но в присутствии кислорода образуется трихлорид мышьяка AsCl3:
4As +3O2 +12HCl = 4AsCl3 +6H2O
— разбавленная азотная кислота при нагревании окисляет мышьяк до ортомышьяковистой кислоты H3AsO3, а концентрированная азотная кислота – до ортомышьякой кислоты H3AsO4:
3As + 5HNO3 + 2H2O = 3H2AsO4 +5NO
Ортомышьяковая кислота (мышьяковая кислота) H3AsO4*0.5H2O – бесцветные кристаллы; температура плавления – 36оС (с разложением); растворима в воде (88% по массе при 20оС); гигроскопична; в водных растворах – трехосновная кислота; при нагревании около 100оС теряет воду, превращаясь в пиромышьяковую кислоту H4As5O7, при более высоких температурах переходит в метамышьяковую кислоту HAsO3. Получают окислением As или As2O3 концентрированной HNO3. Она легкорастворимая в воде и по силе приблизительно равна фосфорной.
Окислительные свойства мышьяковой кислоты заметно проявляются лишь в кислой среде. Мышьяковая кислота способна окислить HI до I2 по обратимым реакциям:
H3AsO4 + 2HI = H3AsO3 + I2 + H2O
Ортомышьяковистая кислота (мышьяковистая кислота) H3AsO3 существует только в водном растворе; слабая кислота; получают растворением As2O3 в воде; промежуточный продукт при получении арсенитов (III) и других соединений.
— концентрированная серная кислота реагирует с мышьяком по следующему уравнению c образованием ортомышьяковистой кислоты:
2As + 3H2SO4 = 2H3AsO3 +3SO2
— растворы щелочей в отсутствие кислорода с мышьяком не реагируют. При кипячении мышьяка со щелочами он окисляется в соли мышьяковистой кислоты H3AsO3. При сплавлении со щелочами образуется арсин (мышьяковистый водород) AsH3 и арсенаты (III). Применяют AsH3
для легирования полупроводниковых материалов мышьяком, для получения As высокой чистоты.
Известны неустойчивые высшие арсины: диарсин As2H4, разлагается уже при -100оС; триарсин As3H5.
Металлический мышьяк легко взаимодействует с галогенами, давая летучие галогениды AsHal3:
As +3Cl2 = 2AsCl3
AsCl3 – бесцветная маслянистая жидкость, дымящаяся на воздухе, при застывании образует кристаллы с перламутровым блеском.
C F2 образует также и AsF5 — пентафторид – бесцветный газ, растворимый в воде и растворах щелочей (с небольшим количеством тепла), в диэтиловом эфире, этаноле и бензоле.
Порошкообразный мышьяк самовоспламеняется в среде F2 и Cl2.
С S, Se и Te мышьяк образует соответствующие халькогениды:
сульфиды — As2S5, As2S3 ( в природе – минерал аурипигмент), As4S4 (минерал реальгар) и As4S3 (минерал диморфит); селениды – As2Se3 и As4Se4; теллурид – As2Te3. Халькогениды мышьяка устойчивы на воздухе, не растворимы в воде, хорошо растворимы в растворах щелочей, при нагревании – в HNO3. Обладают полупроводниковыми свойствами, прозрачны в ИК области спектра.
С большинством металлов дает металлические соединения – арсениды. Галлия арсенид и индия арсенид – важные полупроводниковые соединения.
Известны многочисленные мышьякорганические соединения. Мышьякорганические соединения содержат связь As-C. Иногда к мышьякорганическим соединениям относят все органические соединения, содержащие As, например эфиры мышьяковистой кислоты (RO)3As и мышьяковой кислоты (RO)3AsO. Наиболее многочисленная группа мышьякорганических соединений – производные As с координационным числом 3. К ней относятся органоарсины RnAsH3-n, тетраорганодиарсины R2As-AsR2, циклические и линейные полиарганоарсины (RAs)n, а также органоарсонистые и диарганоарсинистые кислоты и их производные RnAsX3-n (X= OH, SH, Hal, OR’, NR2’ и др.). Большинство мышьякорганических соединений – жидкости, полиорганоарсины и органические кислоты As – твердые вещества, CH3AsH2 и CF3AsH2 – газы. Эти соединения, как правило, растворимы в органических растворителях, ограничено растворимы в воде, в отсутствие кислорода и влаги сравнительно устойчивы. Некоторые тетраорганодиарсины на воздухе воспламеняются.
Источник
 Мышьяк — минерал из класса самородных элементов, полуметалл, химическая формула As. Обычны примеси Sb, S, Fe, Ag, Ni; реже Bi и V. Содержание As в самородном мышьяке достигает 98%. Химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) четвёртого периода периодической системы; имеет атомный номер 33. Мышьяк (неочищенный мышьяк) представляет собой твердое вещество, извлекаемое из природных арсенопиритов. Он существует в двух основных формах: обыкновенный, так называемый «металлический» мышьяк, в виде блестящих кристаллов стального цвета, хрупких, не растворимых в воде и желтый мышьяк, кристаллический, довольно неустойчивый. Мышьяк используется в производстве дисульфида мышьяка, крупной дроби, твердой бронзы и различных других сплавов (олова, меди и т.п.)
Мышьяк — минерал из класса самородных элементов, полуметалл, химическая формула As. Обычны примеси Sb, S, Fe, Ag, Ni; реже Bi и V. Содержание As в самородном мышьяке достигает 98%. Химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) четвёртого периода периодической системы; имеет атомный номер 33. Мышьяк (неочищенный мышьяк) представляет собой твердое вещество, извлекаемое из природных арсенопиритов. Он существует в двух основных формах: обыкновенный, так называемый «металлический» мышьяк, в виде блестящих кристаллов стального цвета, хрупких, не растворимых в воде и желтый мышьяк, кристаллический, довольно неустойчивый. Мышьяк используется в производстве дисульфида мышьяка, крупной дроби, твердой бронзы и различных других сплавов (олова, меди и т.п.)
СТРУКТУРА
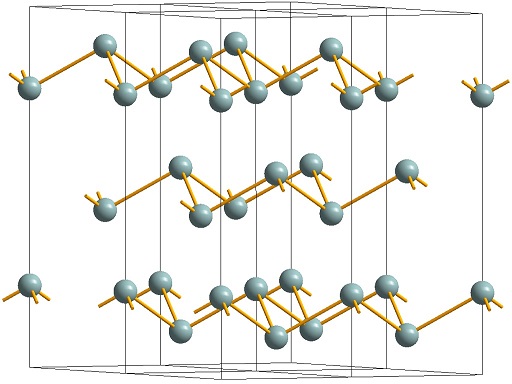 Кристаллическая структура мышьяка дитригонально-скаленоэдрическая симметрия. Сингония тригональная, в. с. L633L23PC. Кристаллы крайне редки, имеют ромбоэдрический или псевдокубический габитус.
Кристаллическая структура мышьяка дитригонально-скаленоэдрическая симметрия. Сингония тригональная, в. с. L633L23PC. Кристаллы крайне редки, имеют ромбоэдрический или псевдокубический габитус.
Установлено несколько аллотропных модификаций мышьяка. В обычных условиях устойчив металлический, или серый мышьяк (альфа-мышьяк). Кристаллическая решетка серого мышьяка ромбоэдрическая, слоистая, с периодом а=4,123 А, угол а = 54° 10′. Плотность (при температуре 20° С) 5,72 г/см3; температурный коэфф. линейного расширения 3,36 • 10 град ; удельное электрическое сопротивление (температура 0° С) 35 • 10—6 ом • см; НВ = ж 147; коэфф. сжимаемости (при температуре 30° С) 4,5 х 10-6cm2/кг. Температура плавления альфа-мышьяка 816° С при давлении 36 атмосфер.
Под атм. давлением мышьяк возгоняется при температуре 615° С не плавясь. Теплота сублимации 102 кал/г. Пары мышьяка бесцветны, до т-ры 800° С состоят из молекул As4, от 800 до 1700° С — из смеси As4 и As2, выше температуры 1700° С — только из As2. При быстрой конденсации паров мышьяк на поверхности, охлаждаемой жидким воздухом, образуется желтый мышьяк— прозрачные мягкие кристаллы кубической системы с плотностью 1,97 г/см3. Известны также другие метастабильные модификации мышьяка: бета-мышьяк — аморфная стеклообразная, гамма-мышьяк — желто-коричневая и дельта-мышьяк — коричневая аморфная с плотностями соответственно 4,73; 4,97 и 5,10 г/см3. Выше температуры 270° С эти модификации переходят в серый мышьяк.
СВОЙСТВА
 Цвет на свежем изломе цинково-белый, оловянно-белый до светло-серого, быстро тускнеет за счет образования тёмно-серой побежалости; чёрный на выветрелой поверхности. Твёрдость по шкале Мооса 3 — 3,5. Плотность 5,63 — 5,8 г/см3. Хрупкий. Диагностируется по характерному запаху чеснока при ударе. Спайность совершенная по {0001} и менее совершенная по {0112}. Излом зернистый. Уд. вес 5,63-5,78. Черта серая, оловянно-белая. Блеск металлический, сильный (в свежем изломе), быстро тускнеет и становится матовым на окислившейся, почерневшей с течением времени поверхности. Является диамагнетиком.
Цвет на свежем изломе цинково-белый, оловянно-белый до светло-серого, быстро тускнеет за счет образования тёмно-серой побежалости; чёрный на выветрелой поверхности. Твёрдость по шкале Мооса 3 — 3,5. Плотность 5,63 — 5,8 г/см3. Хрупкий. Диагностируется по характерному запаху чеснока при ударе. Спайность совершенная по {0001} и менее совершенная по {0112}. Излом зернистый. Уд. вес 5,63-5,78. Черта серая, оловянно-белая. Блеск металлический, сильный (в свежем изломе), быстро тускнеет и становится матовым на окислившейся, почерневшей с течением времени поверхности. Является диамагнетиком.
МОРФОЛОГИЯ
 Мышьяк обычно наблюдается в виде корок с натечной почковидной поверхностью, сталактитов, скорлуповатых образований, в изломе обнаруживающих кристаллически-зернистое строение. Самородный мышьяк довольно легко узнается по форме выделений, почерневшей поверхности, значительному удельному весу, сильному металлическому блеску в свежем изломе и совершенной спайности. Под паяльной трубкой улетучивается, не плавясь (при температуре около 360°), издавая характерный чесночный запах и образуя белый налет As2О3 на угле. В жидкое состояние переходит лишь при повышенном внешнем давлении. В закрытой трубке образует зеркало мышьяка. При резком ударе молотком издает чесночный запах.
Мышьяк обычно наблюдается в виде корок с натечной почковидной поверхностью, сталактитов, скорлуповатых образований, в изломе обнаруживающих кристаллически-зернистое строение. Самородный мышьяк довольно легко узнается по форме выделений, почерневшей поверхности, значительному удельному весу, сильному металлическому блеску в свежем изломе и совершенной спайности. Под паяльной трубкой улетучивается, не плавясь (при температуре около 360°), издавая характерный чесночный запах и образуя белый налет As2О3 на угле. В жидкое состояние переходит лишь при повышенном внешнем давлении. В закрытой трубке образует зеркало мышьяка. При резком ударе молотком издает чесночный запах.
ПРОИСХОЖДЕНИЕ
 Мышьяк встречается в гидротермальных месторождениях в виде метаколлоидных образований в пустотах, образуясь, очевидно, в последние моменты гидротермальной деятельности. В ассоциации с ним могут встречаться различные по составу мышьяковистые, сурьмянистые, реже сернистые соединения никеля, кобальта, серебра, свинца и др., а также нерудные минералы.
Мышьяк встречается в гидротермальных месторождениях в виде метаколлоидных образований в пустотах, образуясь, очевидно, в последние моменты гидротермальной деятельности. В ассоциации с ним могут встречаться различные по составу мышьяковистые, сурьмянистые, реже сернистые соединения никеля, кобальта, серебра, свинца и др., а также нерудные минералы.
В литературе имеются указания на вторичное происхождение мышьяка в зонах выветривания месторождений мышьяковистых руд, что, вообще говоря, мало вероятно, если учесть, что в этих условиях он очень неустойчив и, быстро окисляясь, разлагается полностью. Черные корочки состоят из тонкой смеси мышьяка и арсенолита (As2О3). В конце концов образуется чистый арсенолит.
В земной коре концентрация мышьяка невелика и составляет 1,5 промилле. Он встречается в почве и минералах и может попасть в воздух, воду и грунт благодаря ветровой и водной эрозии. Кроме того, элемент поступает в атмосферу из других источников. В результате извержения вулканов в воздух выделяется около 3 тыс. т мышьяка в год, микроорганизмы образуют 20 тыс. т летучего метиларсина в год, а в результате сжигания ископаемого топлива за тот же период выделяется 80 тыс. т.
На территории СССР самородный мышьяк был встречен в нескольких месторождениях. Из них отметим Садонское гидротермальное свинцово-цинковое месторождение, где он неоднократно наблюдался в виде почковидных масс на кристаллическом кальците с галенитом и сфалеритом. Крупные почкообразные скопления самородного мышьяка с концентрически-скорлуповатым строением были встречены на левом берегу р. Чикоя (Забайкалье). В парагенезисе с ним наблюдался лишь кальцит в виде оторочек на стенках тонких жил, секущих древние кристаллические сланцы. В виде обломков (рис. 76) мышьяк был найден также в районе ст. Джалинда, Амурской ж. д. и в других местах.
В ряде месторождений Саксонии (Фрейберг, Шнееберг, Аннаберг и др.) самородный мышьяк наблюдался в ассоциации с мышьяковистыми соединениями кобальта, никеля, серебра, самородным висмутом и др. Все эти и другие находки этого минерала практического значения не имеют.
ПРИМЕНЕНИЕ
 Мышьяк используется для легирования сплавов свинца, идущих на приготовление дроби, так как при отливке дроби башенным способом капли сплава мышьяка со свинцом приобретают строго сферическую форму, и кроме того, прочность и твёрдость свинца существенно возрастают. Мышьяк особой чистоты (99,9999 %) используется для синтеза ряда полезных и важных полупроводниковых материалов — арсенидов (например, арсенида галлия) и других полупроводниковых материалов с кристаллической решёткой типа цинковой обманки.
Мышьяк используется для легирования сплавов свинца, идущих на приготовление дроби, так как при отливке дроби башенным способом капли сплава мышьяка со свинцом приобретают строго сферическую форму, и кроме того, прочность и твёрдость свинца существенно возрастают. Мышьяк особой чистоты (99,9999 %) используется для синтеза ряда полезных и важных полупроводниковых материалов — арсенидов (например, арсенида галлия) и других полупроводниковых материалов с кристаллической решёткой типа цинковой обманки.
Сульфидные соединения мышьяка — аурипигмент и реальгар — используются в живописи в качестве красок и в кожевенной отрасли промышленности в качестве средств для удаления волос с кожи. В пиротехнике реальгар употребляется для получения «греческого», или «индийского», огня, возникающего при горении смеси реальгара с серой и селитрой (при горении образует ярко-белое пламя).
Некоторые элементоорганические соединения мышьяка являются боевыми отравляющими веществами, например, люизит.
В начале XX века некоторые производные какодила, например, сальварсан, применяли для лечения сифилиса, со временем эти препараты были вытеснены из медицинского применения для лечения сифилиса другими, менее токсичными и более эффективными, фармацевтическими препаратами, не содержащими мышьяк.
Многие из мышьяковых соединений в очень малых дозах применяются в качестве препаратов для борьбы с малокровием и рядом других тяжелых заболеваний, так как оказывают клинически заметное стимулирующее влияние на ряд специфических функций организма, в частности, на кроветворение. Из неорганических соединений мышьяка мышьяковистый ангидрид может применяться в медицине для приготовления пилюль и в зубоврачебной практике в виде пасты как некротизирующее лекарственное средство. Этот препарат в обиходе и жаргонно называли «мышьяк» и применяли в стоматологии для локального омертвления зубного нерва. В настоящее время препараты мышьяка редко применяются в зубоврачебной практике из-за их токсичности. Сейчас разработаны и применяются другие методы безболезненного омертвления нерва зуба под местной анестезией.
Мышьяк (англ. Arsenic) — As
| Молекулярный вес | 74.92 г/моль |
| Происхождение названия | русское название от слова «мышь», в связи с употреблением его соединений для истребления мышей и крыс. Английское от греч. Arsenikon, изначально применялось к минералу аурипигменту |
| IMA статус | действителен |
КЛАССИФИКАЦИЯ
| Strunz (8-ое издание) | 1/B.01-10 |
| Nickel-Strunz (10-ое издание) | 1.CA.05 |
| Dana (7-ое издание) | 1.3.1.1 |
| Dana (8-ое издание) | 1.3.1.1 |
| Hey’s CIM Ref. | 1.33 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | оловянно-белый, с поверхности переходящий в тёмно-серый или чёрный |
| Цвет черты | серый |
| Прозрачность | непрозрачный |
| Блеск | полуметаллический, тусклый |
| Спайность | совершенная по {0001} и менее совершенная по {0112} |
| Твердость (шкала Мооса) | 3,5 |
| Излом | неравномерный |
| Прочность | хрупкий |
| Плотность (измеренная) | 5.63 — 5.78 г/см3 |
| Радиоактивность (GRapi) |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | анизотропный |
| Оптическая анизотропия | различимая — желтовато-коричневый и светло-серый переходящий в желтовато-серый |
| Оптический рельеф | низкий |
| Плеохроизм | слабый |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | 3m (3 2/m) — Гексагональная-скаленоэдрическая |
| Пространственная группа | R 3m |
| Сингония | Тригональная |
| Параметры ячейки | a = 3.768Å, c = 10.574Å |
| Двойникование | Двойники редки, по {10_14}, также механические двойники давления по {01_12} |
mineralpro.ru
01.12.2016
Источник
Таблица
^
=>>
v
Плавление и кристаллизация мышьяка
Сначала при нагревании мышьяк возгоняется, образуются желтые пары, давление растет, при достижении определенной температуры остаток кристалла плавится, затем идет охлаждение ампулы. Подробнее >>
История открытия:
Соединения мышьяка (англ. и франц. Arsenic, нем. Arsen) известны очень давно. Так уже в I в. древнегреческий военный врач, фармаколог и натуралист Диоскорид описал обжигание аурипигмента (сульфида мышьяка) с образованием при этом белого мышьяка (Аs2O3). Когда именно впервые был получен металлический мышьяк неизвестно, обычно это приписывается Альберту великому (ХIII в.). В названии “мышьяк” предположительно отражены ядовитые свойства соединений элемента и их применение (от “мышь-яд”).
Нахождение в природе, получение:
Содержание мышьяка в земной коре 1,7·10-4% по массе. Это рассеяный элемент, известно около 200 мышьяксодержащих минералов, часто содержится в свинцовых, медных и серебряных рудах. Наиболее известны два природных соединения мышьяка с серой: оранжево-красный прозрачный реальгар AsS и лимонно-жёлтый аурипигмент As2S3. Главный промышленный минерал мышьяка — арсенопирит FeAsS.
Мышьяк получают как сопутствующий продукт при переработке содержащих его золотых, свинцово-цинковых, медноколчеданных и других руд. При их обжиге образуется летучий оксид мышьяка(III), который конденсируют и восстанавливают углем.
Физические свойства:
Мышьяк существует в нескольких аллотропных формах и в этом отношении весьма напоминает фосфор. Самая устойчивая из них – серый мышьяк, весьма хрупкое вещество, но имеет металлический блеск и электропроводно (отсюда название “металлический мышьяк”). При быстром охлаждении паров мышьяка получается прозрачное мягкое вещество желтого цвета, состоящее из молекул As4, имеющих форму тетраэдра. Существует также черный мышьяк – аллотропная модификация с аморфным строением.
Мышьяк при нагревании возгоняется, расплавить его можно только в запаянных ампулах под давлением (817°C, 3,6МПа).
Химические свойства:
Мышьяк химически активен. При нагревании на воздухе сгорает с образованием оксида мышьяка(III), с фтором и хлором самовоспламеняется, взаимодействует с халькогенами: серой, селеном, теллуром, образуя различные соединения. Взаимодействует с водородом, образуя газ арсин AsH3.
Разбавленная азотная кислота окисляет мышьяк до H3AsO3, концентрированная – до H3AsO4:
As + 5HNO3 = H3AsO4 + 5NO2 + H2O
Мышьяк нерастворим, не взаимодействует с водой и растворами щелочей.
Важнейшие соединения:
Оксид мышьяка(III), As2O3 – простейшая формула As4O6 – истинная, белые крист., ядовит, при растворении образует мышьяковистые кислоты. Реагирует с конц. соляной кислотой с образованием хлорида мышьяка(III): As2O3 + 6HCl = 2AsCl3 + 3H2O
Метамышьяковистая и ортомышьяковистая кислоты – HAsO2 и H3AsO3, очень слабые, соли – арсениты. Сильные восстановители
Оксид мышьяка(V), As2O5, получают при осторожном обезвоживании мышьяковой кислоты или окислением оксида мышьяка(III) озоном, азотной кислотой. При небольшом нагревании распадается на As2O3 и кислород.
Растворяется в воде с образованием мышьяковой кислоты.
Мышьяковая кислота – H3AsO4, белые крист., к-та средней силы, соли – арсенаты, гидро- и дигидроарсенаты. Качественная реакция – образование арсената серебра Ag3AsO4 (осадок, цвет “кофе с молоком”)
Сульфиды мышьяка, As2S3 — темно-жёлтые крист. (минерал аурипигмент), As2S5 — ярко-жёлтые крист., не растворимы. При взаимодействии с растворами сульфидов щелочных металлов или аммония растворяются, образуя соли соотв. тиокислот:
As2S3 + 3(NH4)2S = 2(NH4)3AsS3 (тиоарсенит аммония),
As2S5 + 3(NH4)2S = 2(NH4)3AsS4 (тиоарсенат аммония).
Растворяются и в щелочах, образуя смеси солей соответствующих кислот, например:
As2S3 + 6KOH = K3AsO3 + K3AsS3 + 3H2O
Хлорид мышьяка(III) – AsCl3, бесцветная маслянистая жидкость, на воздухе дымится. Водой разлагается: AsCl3 + 3H2O = H3AsO3 + 3HCl.
Арсин – AsH3, мышьяковистый водород, бесцв. очень токсичный газ, чесночный запах обусловлен примесями продуктов окисления.
Сильный восстановитель. Образуется при восстановлении многих мышьяковистых соединений цинком в кислой среде по схеме:
(As) + Zn + HCl => AsH3 + ZnCl2 + … .
На этом основана высокочувствительная качественная реакция на мышьяк — реакция Марша, поскольку выделяющийся арсин при пропускании через нагреваемую стеклянную трубку разлагается, образуя на ее стенках черный зеркальный налет.
Применение:
Мышьяк используется в металлургии, как компонент, улучшающий свойства некоторых специальных сплавов. Важной областью применения является также синтез соединений с полупроводниковыми свойствами (GaAs – арсенид галия, третий в масштабах применения полупроводник после кремния и германия).
По-прежнему, многие соединения мышьяка используют для борьбы с насекомыми и грызунами (As2O3, Ca3As2, парижская зелень), для изготовления некоторых медицинских препаратов.
Арапова К., Хабарова М.
ХФ ТюмГУ, 561 группа.
Источники: Википедия: Мышьяк
Популярная библиотека химических элементов. Мышьяк
Источник
