Какие существуют свойства веществ
Химия – наука о веществах, их свойствах, превращениях и явлениях, сопровождающих эти превращения.
Вещества – это то, из чего состоят предметы (физические тела) окружающего мира. Вещества, существующие в природе, постоянно претерпевают различные изменения.
Явления – различные изменения, которые происходят с веществами.
Физические явления – явления, не сопровождающиеся превращениями одних веществ, в другие (обычно изменяется агрегатное состояние веществ или их форма).
Химические явления – явления, в результате которых из данных веществ образуются другие.
Иначе химические явления называют химическими реакциями.
Каждое вещество обладает строго определёнными свойствами.
Свойства веществ – признаки, позволяющие отличить одни вещества от других, или установить сходство между ними.
Физические свойства:
m – масса, V – объём, ρ – плотность.
Масса может быть выражена в граммах, объем в миллилитрах (если это жидкость) или литрах (если это газ).
1 мл = 1 см3, 1 л = 1 дм3, 1000 л = 1 м3
Поэтому плотность измеряют в г/мл, г/см3 (если это жидкость), или в г/л, г/дм3 (если это газ).
Если принять V = 1, то плотность – это масса единичного объёма вещества.
Химические свойства – это те химические реакции, в которые вступает данное вещество.
Так же можно сказать, что химические свойства – это те химические реакции, которые характеризуют группу веществ (класс веществ). Например, мы будем в дальнейшем изучать свойства воды, свойства класса оксидов, свойства класса алканов и т.д.
ООсновы атомно – молекулярного учения
Идея о том, что вещества состоят из мельчайших частиц возникла в Древней Греции в философских учениях Левкиппа и его ученика Демокрита. Эти частицы они назвали атомами (неделимые).
Существование атомов было доказано эмпирическим путём в конце 16 – начале 17 века Джоном Дальтоном и М. В. Ломоносовым. Ими же были заложены основы атомно – молекулярного учения.
В настоящее время, в связи с открытием делимости атома и появлением теории химической связи, основные положения атомно – молекулярного учения существенно изменились. Его суть можно свести к ряду важных положений, которые необходимо запомнить.
Все вещества, существующие в природе, представляют собой совокупность очень большого числа частиц (атомов, молекул или ионов). В зависимости от типа частиц все вещества условно подразделяют на две группы: вещества молекулярного строения и вещества немолекулярного строения (атомного или ионного).
Вещества молекулярного строения – вещества, основной структурной единицей которых является молекула.
Вещества немолекулярного строения – вещества, основными структурными единицами которых являются атомы или ионы.
Частицы, из которых состоит данное вещество, взаимодействуют между собой посредством электромагнитных (кулоновских) сил и находятся в постоянном движении. Движение частиц ограничено силами взаимодействия между ними.Каждое вещество, в зависимости от условий (температуры, давления) может находиться в определённом агрегатном состоянии.
В твёрдом агрегатном состоянии вещества, составляющие его частицы находятся относительно упорядоченно (кристаллическое состояние), их кинетическая энергия (энергия движения) существенно меньше чем потенциальная (энергия покоя). В газообразном состоянии, частицы свободно движутся в предоставленном им объёме и их кинетическая энергия существенно выше чем потенциальная.
В жидкости же потенциальная энергия частиц примерно равна их кинетической энергии. Это связано с тем, что часть частиц жидкости находится относительно упорядоченно в составе так называемых кластеров(англ. cluster— скопление). Другие же частицы свободно перемещаются по объёму жидкости. Чем ниже температура жидкости, тем больше в ней кластеров и наоборот.
Рис. Кластеры воды, где число молекул 20-220
Следует отметить, что существуют еще два дополнительные “состояния”. Это жидкокристаллическое состояние и состояние плазмы.
Цитоплазматическая мембрана клетки – типичный пример жидкого кристалла. Молекулы фосфолипидов в биологической мембране относительно упорядоченно распределяются в двух слоях, но при этом могут в пределах слоя свободно перемещаться, а также “перескакивать” из одного слоя в другой.
Жидкие кристаллы имеют широкое применение в технике (напр., ЖК-мониторы компьютеров).
Плазма (от греч. πλάσμα «вылепленное», «оформленное») — ионизованный газ.
Плазма в своём составе содержит свободные электроны, катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы).
Так как плазма содержит заряженные частицы, то она проводит электрический ток и на неё можно воздействовать внешним магнитным полем. Различают низкотемпературную и высокотемпературную плазму.
Изучает свойства плазмы наука физика.
Вещество из одного агрегатного состояния может переходить в другие агрегатные состояния при изменении внешних условий – температуры (T) и давления (P). Такие переходы принято называть фазовыми переходами.
Так, при повышении температуры, твердое вещество превращается в жидкость, а жидкость при ещё большей температуре превращается в газ. Дальнейшее повышение температуры переводит газ в плазму. При таких переходах вещество в другие вещества не превращается. Напомним, что такие явления мы называем физическими. Поэтому фазовые переходы – это физические явления.
При понижении температуры происходят обратные фазовые переходы – газ превращается в жидкость, а жидкость переходит в твердое состояние.
Фазовые переходы имеют названия.
Твердое —> Жидкое (плавление, обратный переход – кристаллизация)
Жидкое —> Газообразное (испарение, обратный переход – конденсация)
Газообразное —> Плазма (ионизация, обратный переход – деионизация)
Твердое —> Газообразное (сублимация или возгонка, обратный переход – десублимация)
Вещество – совокупность большого числа частиц, находящаяся в определённом агрегатном состоянии в зависимости от условий (температуры и давления).
Поэтому, например, такая фраза как: “Вода – жидкое вещество”, является некорректной. Если мы говорим об агрегатном состоянии вещества, то следует обязательно уточнить условия в которых находится вещество – температуру и давление. Такая фраза как: “При нормальном атмосферном давлении и комнатной температуре, вода – жидкое по агрегатному состоянию вещество”, является правильной.
С точки зрения физики, что более точно, вещество – это форма материи, состоящая из частиц, обладающих массой покоя. Существуют частицы, не обладающие массой покоя, например, фотоны. Материя, состоящая из частиц, не обладающих массой покоя называется поле.
Протоны, нейтроны, электроны – это частицы, обладающие массой покоя, следовательно это частицы вещества. Но химия не изучает вещество, состоящее, к примеру, из электронов (электронный газ), или вещество, состоящее из нейтронов (нейтронный газ). Это удел физики.
Химия изучает вещества, состоящие из атомов, молекул или ионов.
Ввиду этого вещество условно можно подразделить на физическое (электронный газ в проводнике, нейтронный газ и т.д.) и химическое (состоящее из атомов, молекул, ионов, свободных радикалов).
Источник
Эта статья — о форме материи. О веществах, изучаемых химией, см. Вещество (химия).
Вещество́ — одна из форм материи, состоящая из фермионов или содержащая фермионы наряду с бозонами; обладает массой покоя, в отличие от некоторых типов полей, как например электромагнитное.
Обычно (при сравнительно низких температурах и плотностях) вещество состоит из частиц, среди которых чаще всего встречаются электроны, протоны и нейтроны. Последние два образуют атомные ядра, а все вместе — атомы (атомное вещество), из которых — молекулы, кристаллы и так далее. В некоторых условиях, как например в нейтронных звёздах, могут существовать достаточно необычные виды вещества.
Понятие вещества иногда используется и в философии как эквивалент латинского термина substantia[1].
Свойства вещества[править | править код]
Все вещества могут расширяться, сжиматься, превращаться в газ, жидкость или твёрдое тело. Их можно смешивать, получая новые вещества.
Каждому веществу присущ набор специфических свойств — объективных характеристик, которые определяют индивидуальность конкретного вещества и тем самым позволяют отличить его от всех других веществ. К наиболее характерным физико-химическим свойствам относятся константы — плотность, температура плавления, температура кипения, термодинамические характеристики, параметры кристаллической структуры, химические свойства.
Агрегатные состояния[править | править код]
Почти все химические вещества в принципе могут существовать в трёх агрегатных состояниях — твёрдом, жидком и газообразном. Так, лёд, жидкая вода и водяной пар — это твёрдое, жидкое и газообразное состояния одного и того же химического вещества — воды H2O. Твёрдая, жидкая и газообразная формы не являются индивидуальными характеристиками химических веществ, а соответствуют лишь различным, зависящим от внешних физических условий состояниям существования химических веществ. Поэтому нельзя приписывать воде только признак жидкости, кислороду — признак газа, а хлориду натрия — признак твёрдого состояния. Каждое из этих (и всех других веществ) при изменении условий может перейти в любое другое из трёх агрегатных состояний.
При переходе от идеальных моделей твёрдого, жидкого и газообразного состояний к реальным состояниям вещества обнаруживается несколько пограничных промежуточных типов, общеизвестными из которых являются аморфное (стеклообразное) состояние, состояние жидкого кристалла и высокоэластичное (полимерное) состояние. В связи с этим часто пользуются более широким понятием «фаза».
В физике рассматривается четвёртое агрегатное состояние вещества — плазма, частично или полностью ионизованное вещество, в котором плотность положительных и отрицательных зарядов одинакова (плазма электронейтральна).
При некоторых условиях (обычно достаточно отличающихся от обычных) те или иные вещества могут переходить в такие особые состояния, как сверхтекучее и сверхпроводящее.
Вещество в химии[править | править код]
В химии веществом называется вид материи с определёнными химическими свойствами — способностью участвовать в химических реакциях определенным образом.
Все химические вещества состоят из частиц — атомов, ионов или молекул; при этом молекула может быть определена, как наименьшая частица химического вещества, обладающая всеми его химическими свойствами.
Фактически химические соединения могут быть представлены не только молекулами, но и другими частицами, которые могут менять свой состав.
Химические свойства веществ, в отличие от физических, не зависят от агрегатного состояния, таким образом лед и вода — одно и то же вещество с точки зрения химии.
Химическое вещество характеризуется своим составом и структурой, вещества с одним и тем же химическим составом, могут быть разными из-за разной структуры — например, белый фосфор и чёрный фосфор.[3][4]
См. также[править | править код]
- Простые вещества
- Сложное вещество
Примечания[править | править код]
- ↑ См., к примеру, философский словарь Г. Н. Теплова, изданный в 1751 году.
- ↑ А. Эйнштейн. Собрание научных трудов. – М.: Наука, 1967 – T. 4, стр. 511
- ↑ L.Alikberova. Вещества в химии. www.alhimik.ru. Дата обращения: 22 октября 2017.
- ↑ Super User. Понятие структуры вещества. ucheba-service.ru. Дата обращения: 22 октября 2017. (недоступная ссылка)
Ссылки[править | править код]
Источник
«Вещества и их свойства. Чистые вещества и смеси»
Ключевые слова конспекта: предмет химии, вещества и их свойства, чистые вещества и смеси, способо разделения смесей.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Химия является одной из наук, изучающих природу. Вместе с биологией и физикой химия принадлежит к числу естественных наук.
Вещество — это то, из чего состоит физическое тело. Вещество характеризуется определенными физическими свойствами.
Свойства веществ — это признаки, по которым вещества отличаются друг от друга или сходны между собой, например:
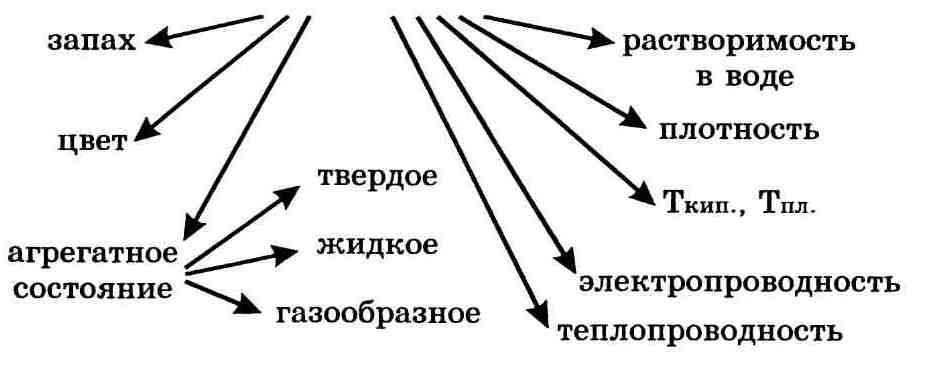
Важнейшие физические свойства вещества следующие: агрегатное состояние, цвет, запах, плотность, растворимость в воде, тепло-и электропроводность, температуры плавления и кипения.
Например, всем известное вещество алюминий можно охарактеризовать так: Алюминий — металл серебристо-белого цвета, сравнительно лёгкий (р = 2,7 г/см3), плавится при температуре 600°С. Алюминий очень пластичен. По электрической проводимости уступает лишь золоту, серебру и меди. Из-за лёгкости алюминий в виде сплавов широко используют в самолёто- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта.
Чистые вещества и смеси
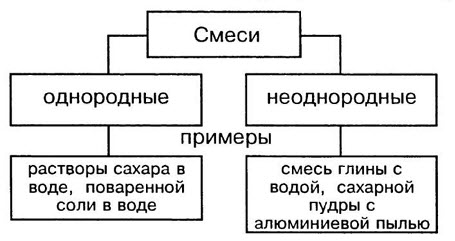
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.

Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
Способ разделения смесей
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.
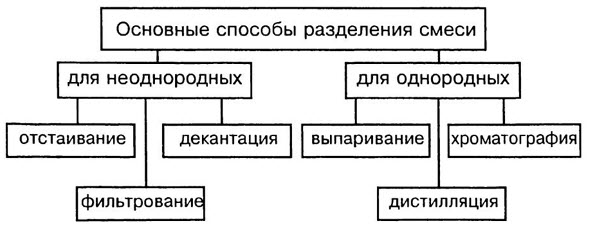
Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
- а) При выдерживании воды, содержащей частички глины, в емкостях глина медленно осаждается на дно, отстаивается. Применяется при очистке питьевой воды.
- б) Чтобы разделить смесь поваренной соли и речного песка, надо поместить ее в колбу и добавить воды. Соль растворится, а песок опустится на дно. Затем осторожно слить раствор, чтобы песок остался в колбе. Соль из раствора получают выпариванием воды.
- в) Для разделения смеси малорастворимых друг в друге жидкостей с различной плотностью используют делительную воронку. Это цилиндрический сосуд с краником внизу. Помещенная в эту воронку смесь бензина с водой или растительного масла с водой быстро расслаивается, причем водный слой оказывается внизу. Открывая кран, сливаем воду, а когда вода заканчивается, закрываем кран. В воронке — бензин или масло.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Хроматография. Метод разделения смесей, основанный на различиях относительной растворимости веществ в используемом растворителе (жидкая фаза) и прочности связывания этих веществ поверхностью сорбента (твердая фаза).
Бумажная хроматография. Нанесем каплю раствора смеси двух веществ на расстоянии 2 см от края длинной полоски фильтровальной бумаги. Подвесим полоску в стеклянном цилиндре, на дне которого находится растворитель. Нижнюю часть полоски погрузим в растворитель, при этом пятно со смесью находится чуть выше. Верхняя часть полоски удерживается проволокой у отверстия цилиндра. Сверху цилиндр закроем стеклом, чтобы не испарялся растворитель. Боковые стороны полоски не касаются стенок цилиндра. Растворитель смачивает полоску, и жидкий фронт движется вверх за счет капиллярных сил. Вместе с растворителем по бумаге движутся и растворенные вещества. Если они цветные, то за движением можно наблюдать визуально. Вещество, которое лучше растворимо и менее прочно удерживается сорбентом (бумагой), поднимется выше. Когда фронт поднимется достаточно высоко и пятна разделятся, полоску вынимают и разрезают.
Колоночная хроматография — процесс, родственный рассмотренному. В качестве твердой фазы служит силикагель, помещенный в колонку. Только в этом случае смесь наносят равномерно вверху колонки, а потом добавляют растворитель. Разделенные вещества собирают внизу в разные стаканчики.
Конспект урока «Вещества и их свойства. Чистые вещества и смеси».
Следующая тема: «Физические и химические явления».
Источник
1. Основные понятия, определения и законы химии
1.1. Вещество, его физические и химические свойства
Химия — наука о веществах, их строении, свойствах и превращениях.
В самом широком смысле вещество — это то, из чего состоят физические тела. Например, физическое тело «железный гвоздь» состоит из вещества железо. Физическое тело может состоять как из одного вещества (физическое тело «медная проволока» состоит из одного вещества — меди), так и из нескольких (физическое тело «автомобиль» состоит из различных металлов, пластмасс). Одно и то же вещество, в свою очередь, может образовывать несколько физических тел. Например: вещество вода образует айсберги, капли дождя, снежинки, иней; только из вещества железо состоят железные гвоздь, скрепка, проволока. В отличие от физического тела, понятие «вещество» абстрактное, вещество нельзя потрогать, нарисовать.
Вещество — только одна из форм материи. Вторая форма существования материи — поле. Поле — это материальная среда, посредством которой тела или частицы вещества взаимодействуют между собой. Примеры полей: гравитационное, электрическое, магнитное, ядерные силы. Вещество имеет дискретное (прерывистое, корпускулярное) строение, поскольку состоит из атомов, а поле однородно, непрерывно. Частицы поля (кванты), в отличие от частиц вещества, не имеют массы покоя (это означает, что они всегда находятся в движении). Характеристики поля: частота, потенциал, напряженность. Характеристики вещества: масса (покоя), размеры, плотность, окраска и т.д.
Традиционно физика и химия понятие «вещество» рассматривают по-разному. В физическом смысле веществом являются все материальные объекты, имеющие массу покоя; иными словами, это не только, например, порция воды массой 1 г, но и отдельно взятая молекула воды, а также любая элементарная частица — электрон, протон или нейтрон.
С химической точки зрения вещество — это устойчивая совокупность атомов, молекул или ионов:
- находящаяся в определенном агрегатном состоянии,
- обладающая некоторым набором постоянных при данных условиях физических и химических свойств.
Пример 1.1.
Укажите химические вещества: а) молекула воды; б) порция аммиака массой 10 г; в) соляная кислота; г) медный таз; д) порция метана объемом 1,12 дм3.
1) б, в, г, д; 3) а, б, в, д;2) б, в, д; 4) б, д.
Решение. Молекула воды является веществом только в физическом смысле, так как имеет массу, но не имеет определенного агрегатного состояния. Соляная кислота — это не вещество, а смесь HCl и H2O, медный таз — физическое тело. О веществах в химическом смысле говорится в случаях б), д).
Ответ: 4).
Физические свойства вещества — это набор определенных констант, характеризующих его агрегатное состояние, плотность, температуры плавления и кипения, цвет, растворимость, твердость, вязкость, летучесть, запах и вкус, теплопроводность, электрическую проводимость, магнитные и оптические свойства, диэлектрическую проницаемость и т.д.
Химические свойства вещества — это совокупность данных о том, с какими веществами и при каких условиях реагирует данное вещество и в какие другие вещества оно при этом превращается.
Например, физические свойства воды: бесцветная жидкость (обычные условия), без цвета, запаха и вкуса, плотность (н.у.) равна 1 г/см3, температуры кипения и плавления соответственно 100 °С и 0 °С, плохо проводит электрический ток. Химические свойства воды: взаимодействует с кислотными и основными оксидами, некоторыми металлами, при электролизе разлагается на водород и кислород.
Свойства вещества зависят от его состава и строения. Различают качественный и количественный состав вещества.
Качественный состав — это природа атомов, образующих вещество. Количественный состав — это число атомов каждого элемента в составе молекулы или в формульной единице вещества.
Например, вещество гидроксид натрия состоит из атомов натрия, кислорода и водорода (качественный состав), причем в формульной единице вещества, NaOH, мольное отношение атомов равно 1:1:1 (количественный состав).
Под строением вещества понимается природа его структурных единиц (молекулы — в случае веществ молекулярного строения или формульные единицы — для веществ немолекулярного строения), взаимное положение атомов и структурных единиц, длины связей, валентные углы, распределение электронной плотности в молекуле или формульной единице. Например, именно о строении идет речь, когда мы говорим, что вещество вода состоит из молекул, молекулы воды имеют угловое строение (валентный угол равен 105°), связь в молекуле ковалентная полярная.
Каждое вещество имеет свое название (названия). Названия бывают:
- международные (систематические): NaCl — хлорид натрия; KNO3 — нитрат калия; H2SO4 — сульфат водорода;
- традиционные (привычные): H2SO4 — серная кислота; H3PO4 — фосфорная кислота;
- специальные: NH3 — аммиак; H2O — вода; H2S — сероводород;
- тривиальные: олеум, норвежская селитра, угарный газ, пирит, галит, сусальное золото.
В зависимости от качественного состава вещества делят на простые и сложные. Простые вещества состоят из атомов одного элемента, причем число атомов в структурной единице простого вещества может быть разным: аргон Ar, медь Cu, водород Н2, кислород О2, белый фосфор Р4, ромбическая сера S8. Сложные вещества (химические соединения) состоят из атомов различных элементов. Например, вода Н2О, аммиак NH3, метан CH4. Сложные вещества, в отличие от простых, можно разложить на несколько других простых и/или сложных веществ:
2H2O →электролиз 2H2↑ + O2↑
2KNO3→t° 2KNO2 + O2↑
CaCO3→t° CaO + CO2↑
В свою очередь простые вещества делятся на неметаллы и металлы. Неметаллы, как правило, плохо проводят теплоту и электрический ток, при обычных условиях могут быть жидкими (бром), твердыми (кремний, бор, сера) или газообразными (водород, кислород, азот, хлор). Металлы (медь, железо, кальций) хорошо проводят электрический ток и теплоту, твердые при обычных условиях (кроме ртути), ковкие, непрозрачные.
Сложные вещества классифицируются:
- по происхождению (органические и неорганические);
- составу (бинарные, т.е. состоящие из атомов двух различных элементов — CaO, H2O, PH3, и многоэлементные, состоящие из атомов трех и более различных элементов — H3PO4, CH3COOH).
Бинарные вещества в свою очередь делятся на оксиды (CuO, K2O), нитриды (Ca3N2), фосфиды (Mg3P2), карбиды (CaC2), гидриды (NaH), галогениды (KCl, FeBr3) и халькогениды (K2S, CS2, Al2Se3).
Среди многоэлементных веществ различают соли, гидроксиды (кислородсодержащие кислоты, основания и амфотерные гидроксиды), комплексные соединения (K3[Al(OH)6], Na2[Zn(OH)4]) и кристаллогидраты (CuSO4 ⋅ 5H2O, Na2SO4 ⋅ 7H2O). Комплексные соединения содержат внешнюю и внутреннюю (указана в квадратных скобках) сферы. Частицы, образующие внутреннюю сферу соединения, очень устойчивы и в водных растворах существуют самостоятельно: [Al(OH)6]3−, [Zn(OH)4]2−.
При записи формул бинарных соединений вначале, как правило, записывается символ менее электроотрицательного элемента. Исключения: аммиак NH3, гидразин N2H4, углеводороды CH4, C2H2 и др., фосфин PH3.
Физические и химические явления
В природе с веществами происходят различные изменения (явления), которые принято классифицировать на химические и физические.
Физические явления — это изменения агрегатного состояния, скорости движения, температуры и формы тел. При этих явлениях новые вещества не образуются. Например, таяние снега, испарение воды, возгонка (сублимация) сухого льда СО2 (сублимация — переход вещества при нагревании из твердого состояния в газообразное, минуя жидкое).
К физическим явлениям относятся также ядерные реакции:
B510+n01→L37i+H24e
и радиоактивные превращения:
R88226a→R86222n+H24e
В этих процессах новые вещества хотя и образуются, однако это связано с изменением природы атомов.
Химические явления, или химические реакции — это изменения веществ, процесс их превращения в другие вещества, протекающий без изменения природы атомов (атомы в химических реакциях сохраняются).
В результате химических явлений могут изменяться:
- как качественный состав, так и строение веществ:
BaCl2 + H2SO4 = BaSO4 + 2HCl
- только строение веществ с сохранением качественного и количественного состава:
CH3–CH2–CH=CH2→t°, кат. CH3–CH=CH–CH3
C (алмаз) →t° C (графит);
- количественный состав (с сохранением качественного) и строение:
3O2 = 2O3
2NO → N2O4
1. В результате химических явлений молекулы (формульные единицы) разрушаются, а атомы не изменяются (сохраняются).
2. Ядерные реакции и радиоактивные превращения относятся к физическим явлениям.
Каждому химическому явлению сопутствует физическое, которое может быть зафиксировано непосредственно нашими органами чувств или специальными приборами. К числу важнейших физических признаков химических явлений относятся выделение газа, выпадение или растворение осадка, изменение окраски, выделение или поглощение теплоты, излучение света, появление запаха.
Следует иметь в виду, что само по себе каждое из отмеченных физических явлений еще не будет однозначным признаком химической реакции. Например, если ударить молотком по куску железа, то выделится тепло и железо нагреется (механическая энергия переходит в тепловую), однако новые вещества при этом не образуются. Откроем флакон с духами — появится запах, но и в этом случае новые вещества не образуются. Оба описанных явления относятся к физическим. Однозначный признак химической реакции — это образование новых веществ.
Закон сохранения массы вещества
Поскольку при химических реакциях атомы не исчезают и их природа сохраняется (новые атомы не образуются), то и общее число атомов до и после реакции остается неизменным. Отсюда следует закон сохранения массы в химических реакциях (М.В. Ломоносов, 1748; А. Лавуазье, 1789): масса веществ, вступивших в химическую реакцию, равна массе продуктов.
Отметим, что этот закон справедлив только в практическом смысле, так как из-за взаимосвязи массы и энергии выделение или поглощение теплоты (энергии) в химических реакциях должно приводить к тому, что массы исходных веществ и продуктов будут различаться. Оценим численное значение этого различия.
Связь массы и энергии выражается уравнением А. Эйнштейна:
Е = mc
2,
где c — скорость света (c = 3 ⋅ 108 м/с).
Отсюда следует, что изменение массы
Δm=ΔEc2.
Для химических реакций значение ΔЕ(Q) порядка нескольких сотен килоджоулей, поэтому при огромной скорости света значения Δm получаются чрезвычайно малыми (≈ 10−9 г) и не поддаются непосредственному измерению. (Изменение энергии огромно в ядерных реакциях, например процессах образования ядер атомов из протонов и нейтронов. Это приводит к так называемому дефекту масс, суть которого состоит в том, что масса ядра атома всегда меньше общей суммы масс составляющих его протонов и нейтронов.) Тем не менее, более правильно говорить о сохранении не только массы, но и энергии (т.е. материи) в химических реакциях:
суммарные масса и энергия веществ, вступающих в химическую реакцию, равны суммарным массам и энергии продуктов реакции.
Чистые вещества и смеси
В природе вещества встречаются как в индивидуальном виде (так называемые чистые вещества), так и (чаще) в виде смесей.
Смесь — система, состоящая из двух и более разных веществ, не изменяющих свои свойства в результате смешивания. Примеры смесей: молоко, бетон, дым, туман, пена.
1. Абсолютно чистых веществ в природе нет и быть не может.
2. Смеси к веществам не относятся.
Вещество считают чистым (индивидуальным), если содержание примесей в нем настолько мало, что практически не влияет на физические и химические свойства вещества.
Чистые сложные вещества следует отличать от смесей (табл. 1.1).
Таблица 1.1
Различия между смесями и сложными веществами
| Сложное вещество | Смесь веществ |
|---|---|
| Образуется в результате химической реакции | Образуется при смешивании |
| Физические и химические свойства отдельных веществ, из которых получено сложное вещество, не сохраняются | Физические и химические свойства веществ, образующих смесь, сохраняются (исключение — растворы) |
| Имеет определенный качественный и количественный состав, который может быть выражен химической формулой | Состав произвольный и не может выражаться определенной химической формулой |
| Разлагается на составные части только в химических реакциях | Можно разделить на составные компоненты сравнительно простыми физическими методами (выпаривание, фильтрование и т.д.) |
| Физические свойства постоянные | Физические свойства не постоянные |
Например, при нагревании железных опилок с серой образуется новое химическое вещество с определенным качественным и количественным составом — сульфид железа(II) FeS. В составе FeS химические свойства веществ железо и сера утрачены, не проявляются. Разложить сульфид железа(II) на отдельные простые вещества железо и серу простыми физическими методами нельзя. Плотность сульфида железа(II) постоянна, магнитом это вещество не притягивается.
Смешаем железные опилки и серу без нагревания. Во-первых, смешивать эти вещества можно в любых соотношениях (состав смеси произвольный и не имеет определенной формулы), во-вторых, железо и сера не утратили своих свойств (в составе ?
